多金属氧酸盐基稀土金属簇合物在癌症诊断和治疗中的潜在应用
2022-11-10贾明洁林焦敏杨仕平
贾明洁,林焦敏,杨仕平
(上海师范大学化学与材料科学学院,上海 200234)
0 引言
与过渡金属(TM)阳离子相比,稀土(RE)阳离子具有以下特征:1)镧系(Ln)具有Ln收缩作用;2)由于外部完全占据的5s和5p轨道将Ln阳离子的4f轨道有效屏蔽,Ln基配合物的配体场稳定能低于TM基配合物;3)根据软硬酸碱理论,RE离子具有亲氧性,易与含氧配体配位;4)RE离子具有优良的光物理特性,基于Ln元素的发光材料能显示出一些特殊的发光特性[1].因此,将RE离子引入多金属氧酸盐(POMs)中,以构建RE取代的POMs极为重要.迄今为止,关于RE金属簇合物的研究已经取得了一些进展,该类化合物在光、电、磁、催化等领域具有独特的性质[2-3].
POMs简称多酸,是一类离散的、大部分为阴离子的、含TM元素(主要是钒(V)、铌(Nb)、钼(Mo)和钨(W))的金属-氧簇合物[4].分子结构通常是角、边和面共享的多面体高度对称组装体.到目前为止,已经建立了几种经典的POMs阴离子结构类型,如Keggin,Wells-Dawson,Lindqvist,Anderson-Evans,Weakley,Finke,Silverton和Stranberg[5].多酸在溶液中对酸碱度比较敏感,在改变pH值的情况下,可发生降解反应,掉落金属-氧多面体得到缺位多酸.掉落之后,裸露的氧原子可以作为RE离子的配位点.此外,由于多酸具有合成简单、结构多样性以及亲核能力较强等优势,有望作为无机氧-供体配体构筑丰富的多金属氧酸盐基稀土金属簇合物.在POMs的发展史上,Keggin,Dawson和Lindqist型POMs一直扮演着重要的角色,它们是开发多金属氧酸盐基稀土金属簇合物的最佳选择[6].
POMs通常具有纳米尺寸、高负电荷、磁性、氧化还原性、酸性、发光性等性质[7].这些显著的物理和化学特性使其可被应用于生物医学领域.通过文献研究可以发现POMs有希望成为抗癌药物,1965年,MUKHERJEE[8]首次应用磷钼酸(H3[PMo12O40])治疗胃肠道癌患者.之后,研究者们开始关注POMs的生物活性[9-10].
利用POMs的结构特性作为无机氧-供体配体构筑丰富的多金属氧酸盐基稀土金属簇合物,将POMs和RE金属簇合物两者的优势进行整合,拓宽多金属氧酸盐基稀土金属簇合物在癌症诊断和治疗中的潜在应用.本文作者根据缺位多酸构筑单元对多金属氧酸盐基稀土金属簇合物进行分类,并介绍了其在磁共振成像(MRI)、计算机断层扫描(CT)成像以及荧光成像(FI)癌症诊断方面应用的现状,并进一步讨论其抗癌活性以及在放射治疗(RT)、光热治疗(PTT)癌症治疗中的潜在应用.
1 分类
根据缺位多酸构筑单元对结构多样的多金属氧酸盐基稀土金属簇合物进行分类.根据文献统计结果发现结构中的缺位多酸构筑单元大多源自经典的Keggin和Dawson型POMs,主要包含单缺位、双缺位、三缺位和多缺位POMs片段.
1.1 基于单缺位的POMs构筑单元
单缺位POMs单元即饱和的经典POMs结构失去1个金属一氧多面体.其中,RE取代的POMs单元可分为1∶1,1∶2和2∶2三种类型.1∶1型指一个RE离子与一个单缺位POMs单元的组合,1∶2型指2个单缺位POMs单元共享一个RE离子,2∶2型是两个单缺位POMs单元通过2个RE离子连接.因为分类较简单,基于单缺位的多金属氧酸盐基稀土金属簇合物的结构并不复杂,在此便不再详述了.
1.2 基于双缺位的POMs构筑单元
同理,双缺位POMs单元即饱和的POMs结构失去2个金属一氧多面体.双缺位的POMs片段是优良的无机多齿氧-供体配体,这些配体为金属离子提供了更多的缺位,具有强大的掺入TM和RE离子的潜力.2016年,LI等[11]报道了Ln取代的无机[Ln27Ge10W106O406(OH)4(H2O)24]59-纳米簇(Ln表示镧(La)和铈(Ce)),该簇是套娃形的四壳结构(Ln⊂W6⊂Ln26⊂W100),如图1(a)所示.其中,最外层壳4是10个双缺位[GeW10O38]12-多氧阴离子.REINOSO等[12]通过简单的一锅反应,制备得到多阴离子[K⊂K7Ce24Ge12W120O456(OH)12(H2O)64]52-,如图1(b)所示.该结构包含12个[Ce2GeW10O38]6-单元,每个单元由1个双缺位的Keggin片段组成.2007年,BASSIL等[13]合成了20核的RE金属簇Na56[Ce20Ge10W100O376(OH)4(H2O)30]·nH2O(n≈180),如图1(c)所示.该化合物是由2个半单元[Ce10Ge5W50O188(OH)2(H2O)15]28-组成的二聚体,每个半单元包含5个双缺位的Keggin片段{GeW10O38},它们通过10个Ce3+中心不对称连接.
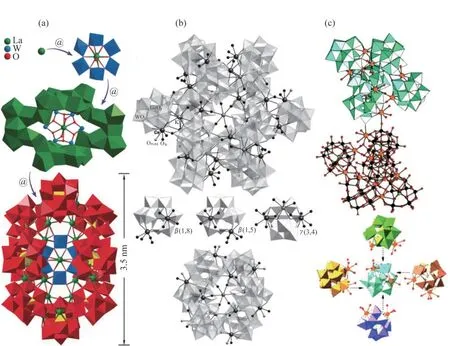
图1 基于双缺位POMs构筑的稀土金属簇合物结构展示.
1.3 基于三缺位的POMs构筑单元
相对于单缺位和双缺位的POMs构筑单元,三缺位的POMs构筑单元显示出更复杂的结构多样性.2018年,LIU等[14]通过一锅反应合成了化合物Na1(6NH4)10H{8[W14CeⅣ6O61](W3Bi6CeⅢ(3H2O)3O14][α-BiW9O33]3)2}·ca.38H2O,如图2(a)所示.该结构的外围有6个三缺位的Keggin单元{BiW}9,从而进一步稳定了中心部分.2015年,IBRAHIM等[15]报道了巨型四面体3d-4f杂金属POM[sDy30Co8Ge12W108O40(8OH)4(2OH2)30]56-,如图2(b)所示.多阴离子结构单元包含6个夹心型结构单元{(GeW9O34)2DyⅢ(3μ-OH)(3H2O)},每个单元中2个三缺位的[A-α-GeW9O34]10-单元将{DyⅢ3(μ-OH)3(OH2)}6+单元夹在中间.FANG等[16]报道了[{α-P2W15O5}6{6Ce3Mn(2μ3-O)(4μ2-OH)2}(3μ2-OH)(2H2O)(2PO4)]47-,如图2(c)所示,它是基于Dawson型[α-P2W18O62]6-的三缺位衍生物形成的多种分子成分,包含6个三缺位[α-P2W15O56]12-Dawson型阴离子.HUSSAIN等[17]合成了2个新结构[Gd6As6W65O22(9OH)(4H2O)1(2OAc)2]38(-1)和[Yb10As10W88O30(8OH)(8H2O)28(OAc)4]40(-2),如图2(d)所示.1的组分包含4个B-α-AsW9O33和2个B-β-AsW9O33三缺位Keggin单元.2的组分包含8个三缺位Keggin单元B-α-AsW9O33.
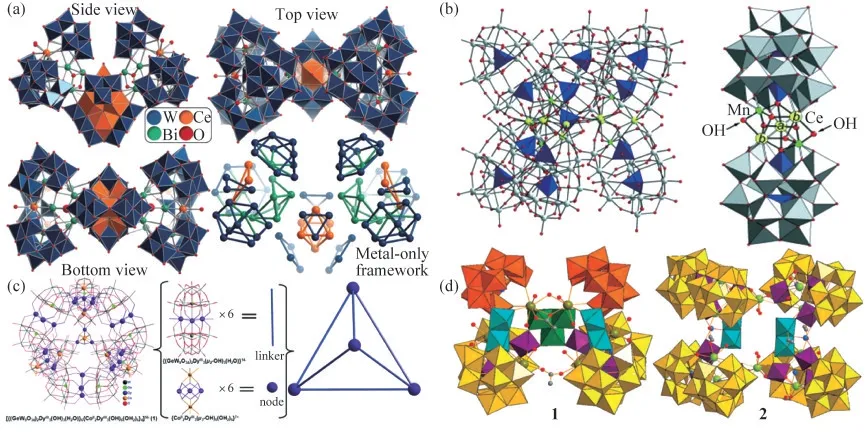
图2 基于三缺位POMs构筑的稀土金属簇合物结构展示.
1.4 基于多缺位的POMs构筑单元
与大多数单缺位、双缺位和三缺位的POMs片段不同,多缺位的POMs片段不仅可以分离成纯POMs前驱体,还可以在制备过程中原位生成.几乎所有的多缺位POMs片段都在简单的含氧金属盐的自组装中原位形成,或者在反应过程中由缺位POMs前驱体降解或重排而来.
2019年,HAN等[18]报道了一例具有超长(约6 nm)带状结构、含有3d-4f的高核POM,[(CH3)2NH2]4H52[Eu16Co7Se16W128O448(CIT)10(HCIT)2(NO3)4(OH)4(H2O)52]·nH2O(H4CIT为柠檬酸,n约为192).多氧阴离子包含2个相同的四聚体,每个四聚体均由{[Eu4W4O8(CIT)3(OH)(H2O)6][Co(NO3)(H2O)4](Se2W14O52)2}(二聚体1)和{[Eu4W4O8(CIT)3(NO3)(OH)(H2O)5][Co(H2O)5](Se2W14O52)2}(二聚体2)组成,二聚体1和二聚体2均包含2个罕见的原位生成的四缺位Dawson型{Se2W14O52}片段.2011年,RITCHIE等[19]合成了3个Ln有机POMs配合物,[Tb2(pic)(H2O)2(B-β-AsW8O30)2(WO2(pic))3]10-(1),[Tb8(pic)6(H2O)22(B-β-AsW8O30)4(WO2(pic))6]12-(2)和[Eu8(pic)6(H2O)22(B-β-AsW8O30)4(WO2(pic))6]12-(3),2和3是同构的.1的结构包含2个四缺位Keggin型单元{B-β-AsW8O30},2和3可视为2个1分子通过2个晶体学上等效的{Ln(pic)(H2O)3}单元连接.
2 POMs在癌症诊断和治疗中的应用
POMs是抗癌药物的候选者,1993年,YAMASE[20]提出了多钼酸盐[NH3Pri]6[Mo7O24](PM-8)抗肿瘤活性的可能机制.[Mo7O24]6-与黄素单核苷酸(FMN)相互作用产生1∶1的复合物,该复合物提供的氧化还原电位比FMN高0.1 V,[Mo7O24]6-在肿瘤细胞中重复的氧化还原循环将抑制三磷酸腺苷(ATP)的产生以及在线粒体中从还原型辅酶I(NADH)到辅酶Q的电子转移.多金属氧酸盐基稀土金属簇合物将POMs的抗肿瘤活性与RE金属的特性结合在一起,将在癌症诊断和治疗中发挥更大的作用.
2.1 MRI
MRI由于具有更高的组织分辨率,以及非电离辐射和多平面成像的优势,成为一种强大的成像方式[21].2020年,ZHOU等[22]通过静电相互作用将聚(聚乙二醇甲基醚甲基丙烯酸酯)-b-聚(甲基丙烯酸-共-三甲基溴化铵丙基甲基丙烯酸酯)(PPMT)和K13[Gd(β2-SiW11O39)2](GdSiW11)组装成pH响应型纳米级药物载体(PPMTGdSiW11),[Gd(β2-SiW11O39)2]13-的过量负电荷促进了对抗癌药物阿霉素(DOX)的捕获,在肿瘤微环境下实现pH响应的DOX释放,如图3(a)所示.其中,GdSiW11作为MRI造影剂,表现出优异的纵向弛豫性(材料的纵向弛豫率(r1)为49.6 mmol-1·L·s-1,而纯GdSiW11的r1值为16.6 mmol-1·L·s-1,商用马根维显(Gd-DTPA)造影剂的r1值为4.3 mmol-1·L·s-1),如图3(b)所示,该工作成功开发了成像-药物递送治疗平台.类似地,在2018年,LY等[23]将[Gd(W5O18)2]9-(GdWO)与含有20或40个甲基丙烯酸二甲氨基乙酯(DMAEMA)阳离子单体单元的阳离子mPEG嵌段共聚物进行自组装,得到纳米组装体,如图3(c)所示.研究发现材料的r1值取决于电荷比,具有最低电荷比(0.2)的材料显示出最高的r1(12.1 mmol-1·L·s-1),与纯GdWO(2.77 mmol-1·L·s-1)或临床MRI造影剂Gd-DTPA(4.1 mmol-1·L·s-1)相比,材料表现出优良的纵向弛豫性,如图3(d)所示.
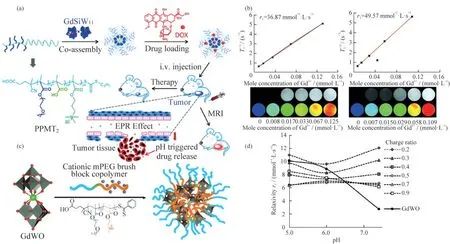
图3 多金属氧酸盐基稀土金属簇合物在磁共振成像领域的应用举例.
2.2 CT成像
CT成像具有较高密度的分辨率、较短的图像采集时间、灵活的3D图像重建技术和精确定位的优点,已成为使用最广泛的分子成像技术之一[24].2018年,ZONG等[25]制备了GdW10@Ti3C2复合纳米片,可作为造影剂用于CT成像和MRI,实现了多模态成像纳米平台的构建,如图4(a)所示.GdW10中的Gd可用于T1加权MRI,此外具有高原子序数的W(Z=74)可用于增强型CT,如图4(b)所显示材料的X射线吸收系数为20.33 HU mmol-1·L.类似地,2016年,YONG等[26]合成了牛血清白蛋白(BSA)包裹的GdW10O36(GdW10)纳米簇(NCs)表示为GdW10@BSA NCs,如图4(c)所示.该材料具有高r1弛豫性和强大的X射线衰减能力,是有效的MRI和CT成像造影剂,此外该材料还可用于PTT以及具有增强RT的作用.GdW10@BSA NCs的X射线吸收系数为19.2 HU mmol-1·L,是商业碘化丙啶(6.09 HU mmol-1·L)的3倍,如图4(d)所示.
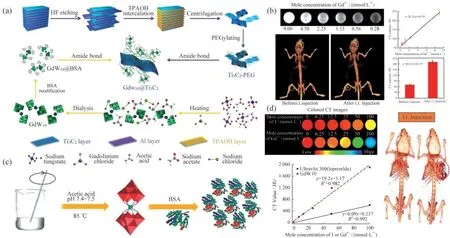
图4 多金属氧酸盐基稀土金属簇合物在电子CT成像领域的应用举例.
2.3 FI
FI的高灵敏度、快速响应和无创性等优点,使其成为具有高时空分辨率的生物过程监测的强大技术之一[27].WANG等[28]将钨铕杂多酸(EuW10)、介孔二氧化硅和pH/热响应共聚物集成在一个单元中,得到了具有红色发光的双响应药物输送系统.该系统在紫外线照射下可以发出红光,可清楚地用肉眼观察到.因此,在肿瘤靶向、癌症诊断和治疗领域具有潜在的应用价值.LI等[29]合成了一系列Keggin型含RE元素POMs,K4(H2O)4[K3.5Ln0.5(H2O)8ClPTi2W10O40]·NH2OH(Ln分别表示La3+,Nd3+,Pr3+,Er3+,Eu3+时,对应的化合物分别用HPB-1,HPB-2,HPB-3,HPB-4和HPB-5表示).通过噻唑兰(MTT)实验在6种癌细胞系(HepG2,U87,U251,A549,Hela,MCF-7)上研究了5种POMs的抗肿瘤活性,结果表明HPB1~HPB5的抗肿瘤活性均高于K7[PTi2W10O40]·6H2O(PM-19)和报道的含RE的磷钨酸.此外,以HPB-5为例,发现可以通过自发荧光特性监控治疗肿瘤细胞的过程,在细胞中提供准确的位置信息,并实时显示细胞杀伤的效率,在视觉治疗方面具有潜在的应用.
2.4 抗癌药物
多金属氧酸盐基稀土金属簇合物具有良好的抗肿瘤活性,有很高的抑制各种肿瘤类型的潜力,有望作为化疗药物进行生物应用[10].2021年,LIU等[30]制备了一例具有抗肿瘤活性的巨型异金属多氧钨酸盐簇{[(Sn(CH3)2)2O]4{[CeW5O18][TeW4O16][CeSn(CH3)2]4[TeW8O31]4}2}46-(1),如图5(a)所示.之后针对人宫颈癌(HeLa)细胞进行MTT比色法测试,以分析评估细胞毒性.图5(b)的结果表明,当材料1物质的量浓度为100 μmol·L-1时,HeLa细胞的活力降低到19.4%,而制备该材料的前驱体钨酸钠(Na2WO4·2H2O)、亚碲酸钾(K2TeO3)、硝酸铈(Ce(NO3)3·6H2O)、二甲基二氯化锡(Sn(CH3)2Cl2)以及市售化疗药物5-氟尿嘧啶(5-FU)在相同物质的量浓度(100 μmol·L-1)时,具有明显更高的HeLa活力(Na2WO4·2H2O:84.7%;K2TeO3:43.0%,Ce(NO3)3·6H2O:79.0%;Sn(CH3)2Cl2:90.9%;5-FU:79.94%),表明材料对HeLa细胞的增殖有抑制作用.

图5 巨型异金属多氧钨酸盐簇的结构以及体外评估其抗肿瘤活性图.
2.5 RT
RT是治疗癌症的重要方法,具有高原子序数的原子,可以增加光电效应的可能性.它的放射线吸收系数高于软组织,这可能导致放射线剂量沉积在癌细胞上[31].2017年,YONG等[32]制备了GdW10@CSsiRNA纳米球,将含钆多金属氧酸盐共轭壳聚糖(GdW10@CS)和缺氧诱导因子-1α小干扰RNA(HIF-1α siRNA)整合到一个体系中.含有高原子序数金属元素的GdW10@CS纳米球用作外部放射增敏剂,沉积辐射剂量用于在X射线照射下产生大量活性氧(ROS),同时纳米球还可以作为有效的HIF-1α siRNA纳米载体来抑制断裂的DNA恢复.此外,研究还发现GdW10@CS纳米球具有通过氧化还原反应消耗细胞内谷胱甘肽(GSH)的能力,更有效地促进了ROS的生成,提高了RT的治疗效率,如图6(a)所示.之后,克隆形成实验评估了缺氧条件下材料的放射增敏效果,如图6(b)~6(e)所示.
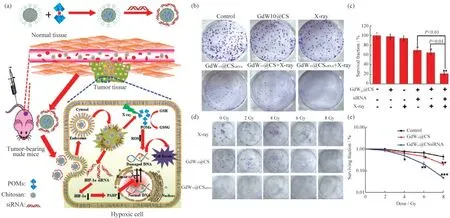
图6 GdW10@CSsiRNA的制备、作用机理以及体外评估其放射增敏效果图.(a)GdW10@CSsiRNA材料的制备及递送siRNA用于有效的RT对缺氧肿瘤细胞的放射增敏作用;(b)GdW10@CS在集落形成过程中在X射线辐射(6 Gy)下增强了BEL-7402细胞的体外增殖抑制作用;(c)不同处理后,相应的BEL-7402细胞的存活分数;(d)在缺氧条件下,剂量依赖性的X射线与GdW10@CS和GdW10@CSsiRNA孵育的BEL-7402细胞的集落形成测定;(e)不同处理后相应的细胞存活分数
2.6 PTT
PTT是一种非侵入性/微创性癌症治疗方法.在激光照射下,通过光热转换产生的热量用于消融癌细胞.与传统的癌症治疗方法相比,PTT显示出许多优势,为癌症治疗提供了更为温和的选择[33].YONG等[26]制备的GdW10@BSA NCs材料在电化学还原后,具有近红外(NIR)吸收能力.在功率密度为1 W·cm-2的808 nm NIR激光照射下,溶液实验发现该材料在辐射10 min后,温度达到55℃,证明材料可以有效地将NIR光转换为热量.之后在细胞层面研究了材料的PTT作用,表明光热有效地将癌细胞消融,证明了该材料可用作光热试剂的潜力.
3 总结与展望
由于RE离子与缺位POMs的配位能力较强,反应强烈易生成沉淀,关于多金属氧酸盐基稀土金属簇合物的报道较少,如何进行有效的设计来定向合成,在该领域今后相当长的一段时间还需进行探索.此外,将该类化合物应用于癌症诊断和治疗方面的工作相应更少,尽管50多年来,人们都知道POMs具有抗癌活性,目前的一些文献阐明了其在癌症诊断和治疗领域的潜力,但是依旧有一系列问题亟待解决.例如,关于POMs介导的抗肿瘤增殖作用背后机制的问题目前仍未得到清晰解答,确切的作用方式仍不清楚,细胞死亡涉及来自各种信号通路的众多信号分子,如何解释不同POMs类型可能的抗增殖机制和潜在靶点.探索这些问题将有助于提供证据,支持POMs在临床应用中的潜在价值.此外,如何利用POMs和RE金属的特性以在癌症诊疗方面发挥更大的作用,还需进行思考以丰富其应用.
