金纳米棒在NIR-Ⅱ区光热治疗中的研究进展
2022-11-10朱孜璇田启威杨仕平
朱孜璇,田启威,2,杨仕平*
(1.上海师范大学化学与材料科学学院,上海 200234;2.上海健康医学院上海市分子影像学重点实验室,上海 201318)
0 引言
癌症目前是全球最常见的威胁生命的疾病之一,也是世界上人类死亡的主要原因之一[1].传统的癌症治疗类型是化学疗法(CT)、放射疗法和手术治疗[2-4].然而,这些方法有许多难以克服的缺点,比如:对恶性肿瘤组织的特异性较差,容易产生耐药性和全身副作用[5-6].因此,需要开发新的治疗方法,使其可以消除癌细胞或癌组织,同时不会对正常细胞或组织造成损伤和副作用.光热疗法(PTT)作为传统癌症治疗方法的替代或补充,其具有创伤小、并发症少、恢复快的优点.PTT通过光热试剂在近红外(NIR)光的照射下,不断吸收热量,使局部温度升高,选择性破坏异常细胞,从而达到治疗癌症的目的[7].由于局域表面等离子体共振(LSPR),等离子体金纳米颗粒表现出独特的纳米尺寸和光学性质[8-9].各种金纳米结构,比如胶体粒子、纳米壳、纳米笼、纳米棒和纳米玫瑰的聚集体,已经被证明可用于癌症治疗中的NIR PTT.在这些聚集体中,由于金纳米棒(Au NRs)与金纳米球(Au NPs)相比于其他结构制备简单,受到科研人员的广泛关注.Au NPs的最大吸收波长位于400~600 nm之间,在活体治疗中,会产生非常低的光穿透率,从而导致PTT效果不显著[10].相比之下,由于Au NRs有2个LSPR峰,其吸收峰位置强烈依赖于棒的长径比大小,可以从可见区到NIR区进行调整,从而达到更高的光热转换效率[11].
尽管Au NRs的光热性能优异,但是其光热稳定性较差,在激光照射后,Au NRs的形状、分散性以及紫外吸收光谱都发生了明显的改变.研究人员通过结构设计、复合材料制备和协同治疗等多种方式提高Au NRs在PTT中的光热性能和稳定性.但很少有文章针对此纳米材料在PTT中的研究进展进行综述,因此,本文作者归纳了基于Au NRs的纳米材料在近红外一区(NIR-I)和近红外二区(NIR-Ⅱ)激光照射增强的PTT,以及其他的疗法增强PTT,为开发新颖的化学试剂提供了思路.
1 不同近红外激光驱动的PTT
与紫外光和可见光相比,NIR光与生物组织的相互作用相对较弱,对人体危害更小,从而更适用于体内治疗.目前的光学疗法主要利用NIR-I(700~1 000 nm)的NIR光进行,组织穿透深度有限(约1 cm)[12].相比之下,在NIR-Ⅱ(1 000~1 700 nm),光散射可以在皮肤、脑和肌肉等各种生物组织中受到显著抑制,具有更好的组织穿透性[13].
1.1 NIR-I激光驱动Au NRs PTT
目前,合成Au NRs最主要的方法是金种子生长法,这种方法可以很容易地合成紫外吸收在800 nm左右的短Au NRs,其主要吸收坐落于NIR-I.因此,基于Au NRs的PTT主要是NIR-I驱动.ZHONG等[14]合成了用于协同近红外触发的光动力学疗法(PDT)/光热治疗的层次化双反应可裂解纳米系统——Au NRs/Cur/UCNPs@PBE,其紫外-可见光谱(UV-vis)的吸收在850 nm左右,利用NIR-I(808 nm)激光照射肿瘤部位,Au NRs把光能转换成热能,大大提高了肿瘤内的温度.同时,由于稀土上转换发光材料(UCNPs)的存在,激发姜黄素与癌细胞内的氧气(O2)反应生成单线态氧(1O2),为在单个纳米平台通过高性能整合PDT和PTT开辟了可能性.
如图1所示,XU等[15]开发了一种基于透明质酸(HA)功能化的Au NRs的酸碱/近红外(pH/NIR)双触发药物释放纳米平台(GNRs-HA-FA-DOX),用于乳腺癌的CT协同PTT.其利用种子法合成了UV-vis吸收为802 nm的Au NRs,用808 nm激光(功率密度:1.5 W·cm-2)照射小鼠的肿瘤部位5 min,温度升高了40℃左右,足以杀死癌细胞.同时,由于肿瘤内的微酸性环境以及PTT提供的热量,使阿霉素(DOX)大量释放,进一步辅助癌症治疗.

图1 GNRS-HA-FA-DOX作用的机理图以及体内验证材料的治疗效果图.(a)pH/NIR双响应GNRS-HA-FA-DOX靶向递送和PTT协同CT治疗乳腺癌的示意图;(b)不同材料的UV-vis吸收图谱;(c)不同材料体内光热(PT)成像图
1.2 NIR-Ⅱ激光驱动Au NRs PTT
在PTT中,目前大多数研究集中在NIR-I窗口,而对NIR-Ⅱ窗口的研究很少.与NIR-I窗口相比,NIR-Ⅱ窗口被认为具有更深的组织穿透能力、更高的辐射上限和更大的组织耐受性,并且在光热转换中显示出更大的应用潜力[16-17].因此,NIR-Ⅱ窗口中的光热试剂引起了越来越多的研究兴趣.目前,将金纳米材料的LSPR峰稳定地从NIR-I移到NIR-Ⅱ的方法较少.一些具有超高纵横比或极薄壳层的Au NRs,虽然可以实现NIR-Ⅱ吸收,但它们中的大多数光稳定性较差,限制了其治疗效果[18].除此之外,通过表面包覆也会引起吸光度的红移或蓝移.例如,SHI等[19]发现氧化亚铜(Cu2O)层可以使Au NRs的最高吸收峰从600 nm红移到800 nm,但是大多数金属氧化物具有生物毒性.因此,开发具有生物相容性和刺激响应的等离子体包覆Au NRs涂层仍然是一个巨大的挑战.
ZHOU等[20]使用二元表面活性剂晶种生长法合成了长径比为6.7的长金纳米棒(LAuNRs),如图2所示,其最大紫外吸收峰为1 064 nm,在NIR-Ⅱ(1 064 nm)激光照射下,温度可升高38.1℃,可作为高效的NIR光热剂,其表现出约20%的高NIR光热转换效率和优异的光热稳定性.即使在6 mm厚的猪肉组织表面涂覆LAuNRs水分散体,在1 064 nm,1.0 W·cm-2的激光照射下,温度仍可增加13.1℃.这些结果都表明LAuNRs作为NIR-Ⅱ窗口中的有效光热剂具有很大的潜力.

图2 LAuNRs的表征.(a)LAuNRs的透射电子显微镜(TEM)图;(b)LAuNRs的UV-vis吸收图谱;(c)LAuNRs水分散体和纯水在1 064 nm激光(1.0 W·cm-2)照射下的光热曲线;(d)在1 064 nm激光照射下(1.0 W·cm-2),厚度为0,2,4,6 mm猪肉组织的LAuNRs水分散体的光热曲线
2 基于Au NRs的NIR-Ⅱ协同治疗
通过以上对比,NIR-Ⅱ激光相对NIR-I具有明显的优势,特别是在一些治疗材料的帮助下,NIR-Ⅱ的PTT可以与多种治疗方法结合,以提高治疗效果.文章综述了基于Au NRs在NIR-Ⅱ区的PTT联合其他治疗,从而达到增强PTT效果,将会在癌症治疗领域中发挥更重要的作用.
2.1 NIR-ⅡPTT/PDT协同治疗
PDT是一种通过在激光照射下,光敏剂与O2反应生成活性氧(ROS),从而选择性的杀死癌细胞.由于其具有双重选择性且对正常组织损伤较小,受到广泛的关注[21].但是,由于光敏剂吸收可见光较多,近红外光吸收较少,而可见光不能深入生物组织,其PDT效果并不明显.升高肿瘤组织的温度可以促进PDT的效果,联合PTT与PDT协同作用可以提高恶性肿瘤的治疗效果[22].
CHEN等[23]成功合成了具有刺激响应的多功能纳米平台——DOX-Pt-tipped Au@ZIF-8,在1 064 nm激光照射下,与单独Au NRs以及铂金包覆的金纳米棒(Pt-covered Au NRs)相比,由于等离子体共振可以更有效地生成电子-空穴对,铂金尖端的金纳米棒(Pt-tipped Au NRs)具有更优异的光热和光动力学性能,如图3所示.激光照射产生的热量可以增强铂(Pt)的催化活性,改善氧水平,从而缓解肿瘤缺氧环境.同时,DOX-Pt-tipped Au@ZIF-8在NIR-Ⅱ区的强吸收和高原子序数(high-Z)元素(Au,Pt)为PT成像和电子计算机扫描(CT)成像提供了可能性.体外和体内实验结果表明:DOX-Pt-tipped Au@ZIF-8具有显著的协同等离子增强PTT/PDT作用,并成功地抑制了肿瘤生长.综上所述,此研究为设计一种合理的PT/CT成像引导的NIR-Ⅱ区协同CT-光疗纳米平台提供了一个思路.

图3 DOX-Pt-tipped Au@ZIF-8作用的机理图以及体外体内验证材料的治疗效果图.(a)在NIR-Ⅱ激光下DOX-Pt-tipped Au@ZIF-8纳米平台光疗和多模态成像引导的协同抗癌疗法的示意图;(b)不同材料的体外治疗效果;(c)不同方法治疗后小鼠肿瘤体积的变化情况
2.2 NIR-ⅡPTT/CT协同治疗
CT是一种常见的癌症临床治疗方法,但由于CT药物不能特异性识别癌细胞,在杀死癌细胞的过程中还会杀死正常细胞,对人体的毒副作用较大[24].当CT与PTT联合时,可以增强细胞对药物的摄取,并在肿瘤部位触发药物释放,从而相应地提高治疗效果,减少副作用[25].
WANG等[26]构建了一种可注射的海藻酸钙(ALG-Ca2+)水凝胶,以捕获玉米状金/银纳米棒(Au/Ag NRs)和亲水化疗药物盐酸阿霉素(DOX·HCl),最终合成NR/DOX/ALG水凝胶(其中NR表示Au/Ag NRs),从而实现PTT/CT协同的局部治疗,如图4所示.将复合水凝胶局部注射到肿瘤组织后,ALG通过Ca2+介导的交联快速形成水凝胶,可以有效地将Au/Ag NRs和DOX固定在肿瘤部位.Au/Ag NRs在NIR-Ⅱ窗口具有很强的吸收,在1 064 nm的激光照射下可以产生大量的热,从而立即消融大多数肿瘤细胞.同时,DOX可以破坏残留的肿瘤细胞.此外,PTT产生的热量能够触发DOX从水凝胶中按需释放.此研究通过联合PTT/CT为局部癌症治疗提供了良好的策略.

图4 可注射ALG水凝胶作用机理图以及体内体外验证材料的治疗效果图.
2.3 NIR-ⅡPTT/化学动力学疗法(CDT)协同治疗
CDT通过金属离子介导的芬顿或类芬顿反应来催化肿瘤微环境中过表达的过氧化氢(H2O2)产生剧毒的羟基自由基(·OH),从而导致癌细胞凋亡或坏死[27-28].PTT产生的热量提高了肿瘤部位的温度,高温可以促进芬顿或类芬顿反应的速度,从而快速产生大量的·OH,达到杀死肿瘤细胞的目的.
如图5所示,HE等[29]将GNR(金纳米棒)涂上二氧化硅(SiO2),然后用二氧化锰(MnO2)覆盖得到的GNR@SiO2@MnO2(GSMs)纳米材料.制备的纳米材料有2种方法使Au NRs的LSPR峰红移至NIR-Ⅱ:1)在合成Au NRs的过程中,调节AgNO3的用量,随着AgNO3的用量变多,Au NRs的UV-vis从670 nm红移至850 nm;2)在SiO2包覆金纳米棒GNR@SiO2(GS)的表面覆盖一层MnO2层,导致了Au NRs周围折射率的变化,通过调节MnO2层的厚度,可以调节Au NRs的LSPR峰值,随着MnO2厚度的增加,Au NRs的LSPR峰值红移增大.所制备的具有NIR-Ⅱ等离子体特性的GSMs可用于NIR-Ⅱ光声成像(PAI)和PTT,并且肿瘤微环境中H2O2和H+水平的升高可以使MnO2层降解为Mn2+,从而实现磁共振成像(MRI)和CDT.这种在NIR-Ⅱ窗口下,将PTT,CDT和MRI以及PAI结合在一起的多模态影像指导的协同治疗,为开发更新型的NIR-Ⅱ试剂指明了新的研究方向.
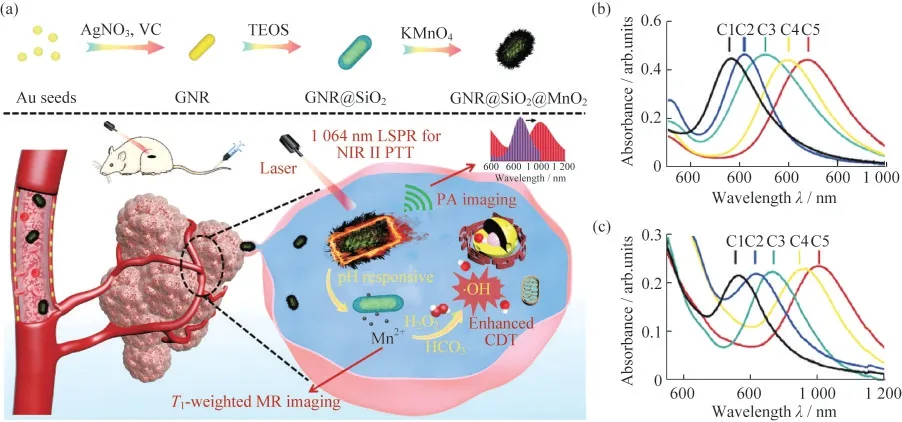
图5 GSMs的制备、作用机理及不同方法调控Au NRs的UV-vis图.
3 结论与展望
最近几年由于Au NRs在PTT中的应用治疗效果优异且毒副作用可忽略不计,在临床上拥有广阔的应用前景.Au NRs作为光热剂在PTT中发展迅速,本文作者概述了Au NRs在NIR-I,NIR-Ⅱ不同的PTT效果,以及与其他治疗手段相结合所展现出优异的癌症治疗效果.除此之外,由于Au NRs具有高比表面积、高效的传质特性、良好的生物相容性、高度灵敏的纵向等离子体共振(SPR),以及在高离子强度条件下的高稳定的固有性质,在不同类型的纳米生物传感器(压电、光学、电化学和热/量热生物传感器)的设计中起着关键的作用.但是,由于Au NRs在癌症治疗上仍有许多弊端,例如光热稳定性不好导致一次比一次治疗效果差,限制了其PTT的治疗效果.因此,为了达到更好的PTT治疗效果,提高癌症治疗效率,迫切需要开发新型、高效、生物相容性良好的光热试剂.随着纳米医学的蓬勃发展,Au NRs在癌症治疗方面将具有更广阔的应用前景.
