MMP-2和MMP-9及胃蛋白酶对喉鳞状细胞癌侵袭作用的机制研究
2022-11-10王留珍王益玲冯海燕
王留珍,王益玲,冯海燕
(1.广西中医药大学,广西 南宁 530200;2.柳州市人民医院 耳鼻咽喉科,广西 柳州 545006)
喉癌是头颈肿瘤的高发病,我国部分省市的恶性肿瘤就诊患者中,喉癌仅次于鼻咽癌和鼻腔癌,而居于第3位[1],大多数喉癌为鳞状细胞癌。《2020年全球癌症统计》报告显示,2020年有184 615例新的喉癌病例和99 840例死于喉癌[2]。不同部位的喉癌有局部侵袭扩散和淋巴结转移的趋势,细胞外基质的降解和破坏是肿瘤细胞侵袭转移的重要机制,基质金属蛋白酶(metrix metalloproteineas, MMP)能降解细胞外基质成分,其中MMP-2、MMP-9在多种肿瘤增殖、侵袭、转移中起关键性作用。在临床实践及前期对头颈肿瘤的研究[3-4]过程中,我们发现许多喉癌病人同时伴有咽喉反流(Laryngopharyngeal reflux, LPR),胃蛋白酶(Pepsin)是反流物的主要成分,我们猜想Pepsin可能对喉癌的发生和局部侵袭也有重要的促进作用。本研究采用qRT-PCR检测喉鳞状喉细胞癌肿瘤组织和肿瘤旁组织中MMP-2、MMP-9及Pepsin mRNA表达情况,同时结合临床资料进行分析,探讨MMP-2、MMP-9及Pepsin对喉鳞状细胞癌局部侵袭的作用。
1 材料与方法
1.1 组织样本与临床资料
本研究项目经柳州市人民医院伦理委员会批准,患者或授权人知情同意并自愿参与相关研究。收集柳州市人民医院耳鼻咽喉科手术治疗的喉鳞状细胞癌32例。纳入标准:①经我院电子喉镜、颈部CT或MRI等影像学检查及病理检查确诊的患者;②有手术指征,无手术禁忌。排除标准:①术前放化疗史、甲状腺功能减退、严重心理、精神等疾病;②合并其他恶性肿瘤。分别收集患者癌组织及配对的邻近癌旁组织:癌旁组织为术中快速冰冻确诊为无癌的邻近组织,同时收集喉癌患者分型、分期、年龄等临床资料。
根据国际抗癌联盟(UICC)2017年第8版TNM分期方案[5],将所纳入喉癌患者分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ期共18例,Ⅲ、Ⅳ期共14例;纳入喉癌患者均为鳞状细胞癌:其中高分化22例、中-低分化10例;淋巴结转移情况:淋巴结转移8例,未转移24例;声门型21例,声门上型4例,声门下型1例,声门旁型6例;年龄分组情况:年龄52~78岁,中位数为66岁,其中≥60岁27例,<60岁5例;不同性别分组中,由于女性喉癌患者仅2例,故未探讨不同性别之间的差异。
1.2 主要试剂及仪器
Trizol提取法提取组织细胞RNA,提取试剂盒购自北京宝如亿生物公司;荧光定量PCR试剂盒购自广西卓一生物公司;荧光定量PCR仪为LightCycler®480Ⅱ(美国罗氏)。
1.3 实验方法
分别从所收集的新鲜喉癌组织、癌旁组织样本中提取组织RNA,根据逆转录试剂盒说明书制备所需cDNA,以HS-ACTB为内参,mRNA的相对表达量采用2-ΔΔCT方法计算;qRT-PCR引物序列如下,所有引物均有桂林卓一生物公司合成(表1)。
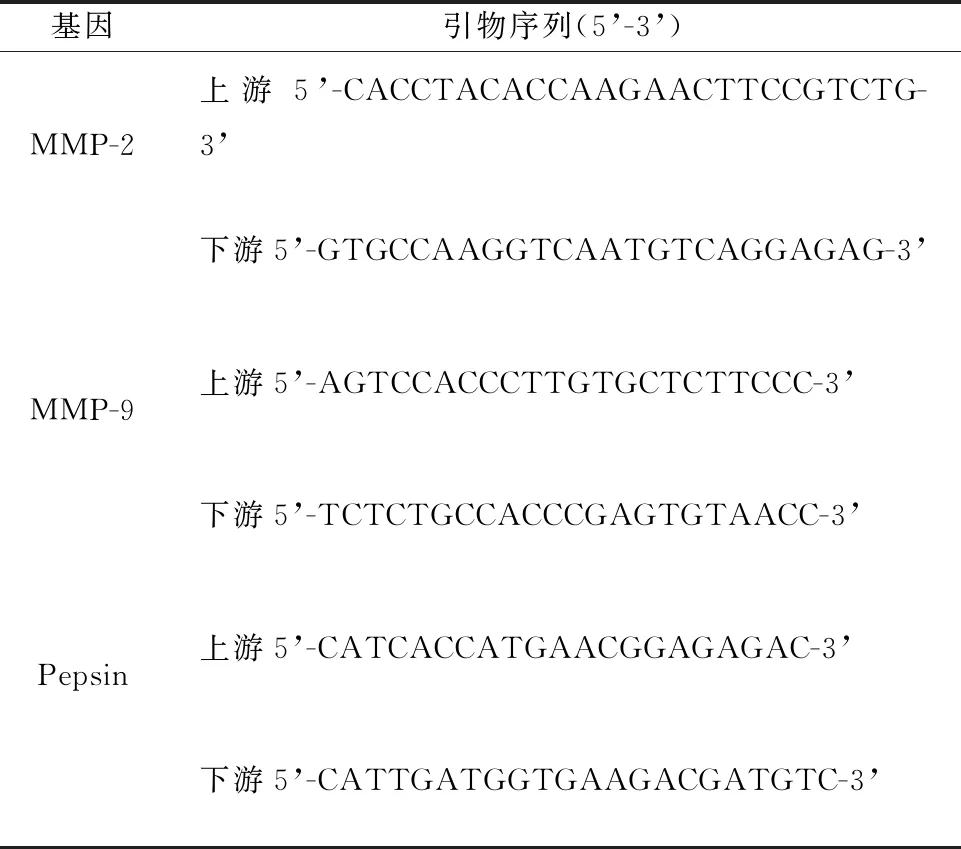
表1 基因及对应引物序列
1.4 统计学分析
2 结果
2.1 MMP-2、MMP-9及Pepsin mRNA在喉癌及癌旁组织中的表达情况
MMP-2、MMP-9及Pepsin mRNA在喉癌组织中的表达量均高于癌旁组织,表达均存在差异,且差异具有统计学意义(P<0.05),详见表2、图1。
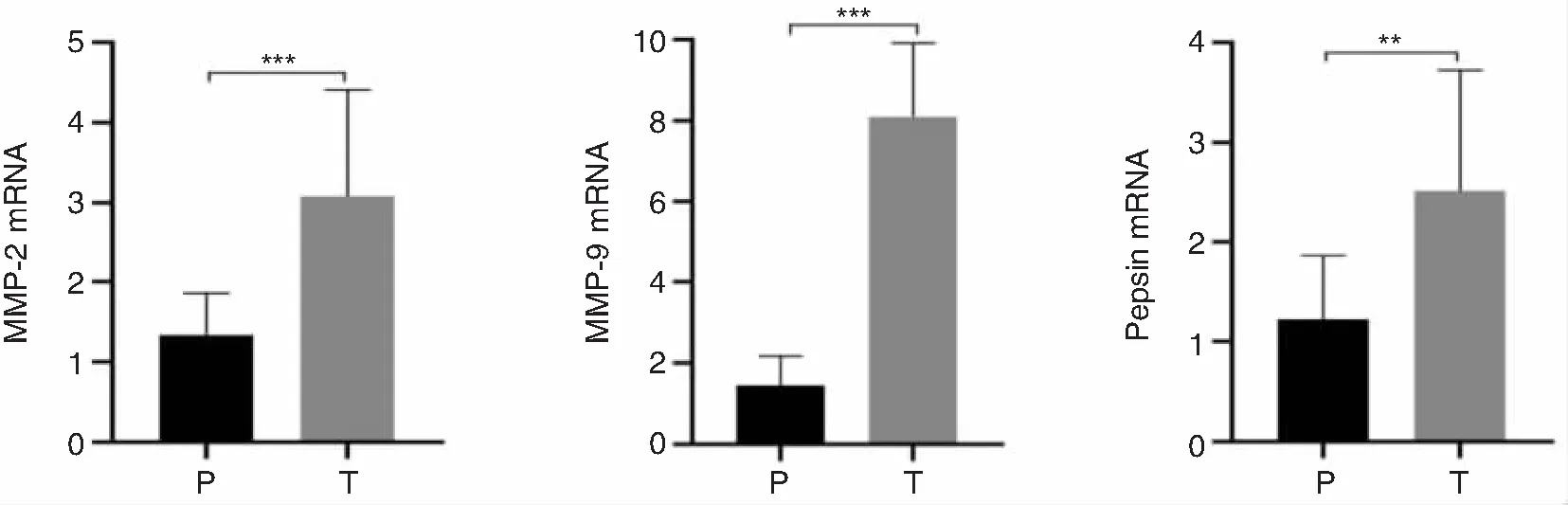
图1 MMP-2、MMP-9及Pepsin mRNA在喉癌及癌旁组织中的表达

表2 MMP-2、MMP-9及Pepsin mRNA在喉癌及癌旁组织中的表达
2.2 MMP-2、MMP-9及Pepsin mRNA在喉癌的表达水平与临床特征间的关系
MMP-2、MMP-9及Pepsin mRNA表达水平均与喉癌患者是否淋巴结转移及临床分期相关,伴淋巴结转移的喉癌患者组MMP-2、MMP-9及Pepsin mRNA表达高于无淋巴结转移组(P<0.05);Ⅲ、Ⅳ期患者喉癌组织中MMP-2、MMP-9及Pepsin mRNA表达高于Ⅰ、Ⅱ期患者(P<0.05)。在不同病理分化程度分组中,中-低分化患者组中MMP-2、MMP-9 mRNA表达高于高分化患者组(P<0.05),而Pepsin mRNA表达同样高于高分化患者组,但差异无统计学意义(P>0.05);在不同年龄分组中,60岁及以上患者组中Pepsin mRNA表达高于60岁以下患者组(P<0.05),而MMP-2、MMP-9 mRNA表达同样高于60岁以下患者组,但差异无统计学意义(P>0.05);在不同肿瘤部位分组中,声门型喉癌患者MMP-2、MMP-9及Pepsin mRNA表达较非声门型患者偏低,但差异无统计学意义(P>0.05)。具体数据见表3。

表3 MMP-2、MMP-9及Pepsin mRNA在喉癌的表达与临床特征间的关系
3 讨论
1990—2019年我国喉癌的标化发病率呈上升趋势,特别是在中老年人群的疾病负担仍较为沉重[6],早期喉癌可以采用激光手术、开放手术和放疗等方法,临床效果大多良好,但多数患者确诊时已发展至中晚期,出现失声、呼吸困难、淋巴结远处转移等,临床分期Ⅰ、Ⅱ期的患者5年生存率为80.17%,而Ⅲ、Ⅳ期仅为29.31%[7]。本项目中Ⅲ、Ⅳ期喉癌患者14例,约占44%(14/32),早期病例偏高,虽说病例数不多,但这可能与电子喉镜,特别是窄带成像、高分辨率CT等检查的联合使用,以及由三甲医院牵头的医疗联合体措施的落实,基层的肿瘤筛查和防癌意识得到加强,使许多早期患者,甚至癌前期病人能及早诊断和处理。
3.1 MMP-2、MMP-9在喉癌发生发展中的作用
喉癌的病因及发病机制尚不明确,其侵袭转移机制仍为研究热点。MMP在结直肠癌、口腔鳞状细胞癌、肺癌、乳腺癌、骨恶性肿瘤、血液肿瘤等多种肿瘤发生发展过程中表达上调,越来越多的研究证实MMP的升高与肿瘤进展和侵袭性有关[8-11]。胶原酶(MMP-2、MMP-9)是MMP中重要类型之一,通过降解细胞外基质(extracellular matrix, ECM)及基底膜的主要结构蛋白Ⅳ型胶原蛋白,使细胞基底膜破坏甚至缺失、ECM瓦解而疏松,同时在基质重建过程中,Ⅳ型胶原蛋白水解使内皮下基底膜中隐藏的蛋白质序列暴露,促进血管生成,新血管网络的形成支持营养物质扩散和氧气的输送,促进组织新陈代谢和肿瘤细胞生长,并为癌细胞的增殖和扩散维持良好的微环境[12]。
在正常生理条件下,健康组织中MMP-2、MMP-9表达量非常少,但在肿瘤组织中,肿瘤的侵袭力越强,MMP-2、MMP-9表达量越多[13]。Grzelczyk等[14]研究发现,MMP-2、MMP-9 mRNA在癌组织和非肿瘤组织中的表达水平以及术前血清中的蛋白水平均显著高于健康对照组;沉默MMP-9使喉癌细胞增殖、侵袭能力明显下降[15];基质金属蛋白酶抑制因子2(tissue inhibitors of metalloproteinase 2, TIMP-2)的mRNA在癌组织受到明显抑制[16],引起MMP-2高表达,进而促进癌组织生长、侵袭及迁移。在下咽癌患者中,临床分期越晚期的患者肿瘤组织中MMP-2、MMP-9的表达量越高,在息肉样患者组织MMP-2、MMP-9的表达量几乎为0[17]。
本研究中,MMP-2、MMP-9在喉鳞状细胞癌组织中表达高于配对癌旁组织中的表达,此外,MMP-2、MMP-9 mRNA表达水平在Ⅲ、Ⅳ期喉癌患者组高于Ⅰ、Ⅱ期患者组;伴淋巴结转移组高于无淋巴结转移组;中-低分化组高于高分化组,相对恶性程度越高的患者中,其表达水平相对偏高,且差异具有统计学意义,说明在喉鳞状细胞癌向邻近部位侵袭和淋巴结转移等发展过程中,MMP-2、MMP-9可能参与基质屏障的破坏,从而导致肿瘤的局部侵袭等恶性行为的发生。
3.2 Pepsin在喉癌发生发展中的作用
3.2.1 Pepsin增加喉癌发病风险 许多研究证实LPR增加喉癌发病的风险[18],存在反流的情况下,肿瘤抑制因子钙黏蛋白E(e-cadherin, E-Cad)的表达会降低[19]。在声门型喉癌患者中,反流阳性声门癌环氧化酶-2(cyclooxygenase-2, COX-2)的表达明显高于反流阴性声门癌,咽喉反流因子可能通过增加COX-2的表达引起组织损伤、炎症以及肿瘤细胞的进展[20]。Pepsin作为咽喉反流物中主要成分之一,多组实验发现Pepsin暴露有利于细胞增殖、集落形成以及迁移[21-22]。有学者研究发现:在喉恶性肿瘤、良性肿瘤及无咽喉反流症状或体征的对照者唾液中,Pepsin浓度依次降低,且恶性病变组中高阳性样本数量最多,故Pepsin在喉良恶性肿瘤的发生发展中均起重要作用[23]。将下咽癌细胞暴露于不同浓度梯度(0.01、0.1 mg/mL或1 mg/mL)Pepsin中,随着Pepsin浓度的增加,细胞转移和集落形成能力明显提高[24]。另有学者分别用0.1 mg/mL Pepsin以及正常生长培养基(对照)体外处理正常喉上皮细胞1 h,并通过RNA测序发现单次、短暂地暴露于Pepsin的喉上皮细胞中,397个基因在Pepsin处理后表现出不同的表达情况,包括癌症相关分子和KRT82以及长链非编码RNA、脂蛋白受体相关蛋白的失调,揭示了Pepsin可能导致癌变的另一机制[25]。
3.2.2 Pepsin在喉癌发病过程中的激活机制 Pepsin作为咽喉反流物的关键成分,胃质子泵H+/K+ATPase产生的胃酸使其保持活性,胃H+/K+ATPase由胃壁细胞表达,是位于不同染色体上由ATP4A和ATP4B基因编码的α和β亚单位组成的异二聚体复合物。Altman等[26]认为H+/K+ATPase在LPR患者的喉黏液腺及导管中有不同程度表达,在不可逆的反流病变或癌组织,反流导致的化生、癌性食管和颌下腺及喉组织,也有其表达,喉质子泵的局部酸分泌可能激活反流过程中沉积的Pepsin,从而引起进一步的损害。另外,Johnston等[27]研究证实,下咽上皮细胞通过受体介导的内吞作用摄取Pepsin,运往细胞内某些低pH的细胞器如高尔基体囊泡中,合适的pH环境使Pepsin活化而引起细胞损伤。McCormick等[28]在表达全质子泵的喉癌和反流的细胞中观察到线粒体损伤和基因表达的变化,而表达单个亚单位的没有此变化,进一步说明上气道黏膜功能性H+/K+ATPase表达的胃酸可能导致炎症和肿瘤局部细胞的分子变化。
本研究中,Pepsin mRNA在喉鳞状细胞癌组织中表达高于癌旁组织,且在伴淋巴结转移、临床分期Ⅲ、Ⅳ期患者及60岁及以上患者喉癌组织中高表达,如同反流性食管炎引起细胞DNA损伤、增殖过度等细胞变性而致Barrett食管,增加患食管癌的风险,喉癌患者中可能存在咽喉反流中的Pepsin或潜伏于咽喉组织中的惰性Pepsin被反流的胃酸激活,促使喉癌肿瘤生长转移。
3.3 MMP-2、MMP-9及Pepsin在喉鳞状细胞癌侵袭过程中的协同促进作用
上述结果均提示在喉鳞状细胞癌病变过程中MMP-2、MMP-9及Pepsin可能破坏黏膜屏障,在肿瘤发生、进展、局部侵袭过程中,与肿瘤侵袭基因发挥协调促进作用,喉鳞状细胞癌病理分化恶性程度越高、临床分期越晚者,MMP-2、MMP-9及Pepsin表达水平越高,在临床中,或许可以对手术患者检测MMP-2、MMP-9及Pepsin的表达水平,有助于高危患者亚群的判断,表达水平较高者考虑加强随访,或结合患者身体情况术后考虑辅助放化疗,以使患者获得最大受益,减缓肿瘤进展;对于不能手术或者放化疗不敏感的喉鳞状细胞癌患者,或许可以考虑使用抑制MMP-2、MMP-9表达的生物抑制剂,可能降低肿瘤浸润转移风险。同时,在喉鳞状细胞癌预防过程中,特别对于老年人的咽喉反流进行干预,有助于延缓肿瘤的局部侵袭和扩散。
本次研究样本例数偏少,深入研究挖掘MMP-2、MMP-9及Pepsin在喉鳞状细胞癌组织中的表达情况及临床意义,更进一步在分子层面挖掘其通过哪种信号通路或途径发挥调控作用,可能是未来研究的方向之一,由于有限的时间,关于入组患者5年生存率、病死率的相关研究尚未完成,有待以后继续研究,随着越来越深入的研究,期待MMP-2、MMP-9及Pepsin能够在喉鳞状细胞癌预防、诊断、治疗等方面得到更广阔的前景。
