扩散加权成像和临床分期在鼻咽癌预后评估中的价值
2022-11-10芮银芳周楠杨阳周正扬
芮银芳,周楠,杨阳,周正扬
(1.南京医科大学鼓楼临床医学院,江苏 南京 210008;2.南京市高淳人民医院 南京鼓楼医院高淳分院 肿瘤科,江苏 南京 211300;3.南京大学医学院附属鼓楼医院 医学影像科,江苏 南京 210008;4.南京大学医学院附属鼓楼医院 肿瘤科,江苏 南京 210008)
鼻咽癌为起源于鼻咽上皮细胞的恶性肿瘤,是常见的头颈部恶性肿瘤之一,最常见的病理类型为鳞状细胞癌[1]。中国是鼻咽癌的高发区,我国每年约有6万新发鼻咽癌病例[2]。放疗或放化疗联合是鼻咽癌主要治疗手段,而局部复发和远处转移是其治疗失败的主要原因[3]。鼻咽癌复发转移后再治疗效果差且副反应大,因此,初治时筛选出高危患者,在治疗上早期干预,可以改善鼻咽癌患者的预后。
TNM分期(tumor node metastasis classification)是预测鼻咽癌预后的重要依据,但其仅基于解剖学结构而无法提供肿瘤的生物学信息。治疗前血浆EB病毒中EBV DNA水平被证实与治疗后复发、转移相关,但目前临床研究主要来自鼻咽癌高发区,而仍有部分鼻咽癌与EB病毒感染无关[4],且EBV DNA检测方法有待统一。扩散加权成像(diffusion-weighted imaging,DWI)为鼻咽部磁共振(MRI)检查常规序列之一,能够反映组织中水分子扩散情况,且其参数表观扩散系数值(apparent diffusion coefficient,ADC)可用于定量分析。既往研究发现肿瘤细胞密度与ADC值呈负相关,ADC值越低代表肿瘤增殖越活跃[5]。DWI检查无创、方便,也许能够弥补TNM分期在预后判断方面的不足。
目前,关于原发肿瘤ADC值在预后评估方面的应用尚存在争议。有研究表明局部复发组或复发转移组与无复发转移组原发肿瘤ADC值无显著差异[6-7]。另有研究[8]显示远处转移组ADC值低于无远处转移组,但并非独立预后因素。Zhang等[9]证实高ADC值组3年无局部复发生存率和无病生存率低于低ADC值组,而Yan等[10]的研究结果与之相反。上述研究终点和入组病例的病理分化类型差异可能是造成结果不同的因素[11-12]。本研究在前期研究基础上选择性纳入了低分化鳞癌患者,以无病生存为研究终点,进一步验证分析DWI和鼻咽癌分期在预后评估方面的价值,指导临床个体化治疗。
1 资料与方法
1.1 一般资料
入组标准:①病理确诊鼻咽低分化鳞形细胞癌;②行鼻咽癌放疗或联合化疗;③放疗前1周内行鼻咽部和颈部常规MRI扫描;④治疗后行规律随访。
排除标准:①MRI检查绝对禁忌证(如人工耳蜗、心脏起搏器置入患者等);②DWI图像不能满足诊断要求。
按照患者入组及排除标准,收集2015年1月—2021年1月诊治的鼻咽癌患者90例,其中男65例,女25例;年龄21~84岁,中位年龄55岁。所有患者均行调强放疗,早期患者行单纯放疗,局部中晚期联合化疗。高风险区总剂量64~75 Gy,区域颈部淋巴结引流区剂量54~60 Gy,化疗以铂类为基础的单药或两药联合方案,其中3例患者联合靶向治疗。本研究经我院伦理委员会审核同意,伦理同意号:(同)2021-178-01。
根据实体肿瘤的疗效评价标准RECIST 1.1版[13],完全缓解(CR)定义为全部肿瘤病灶(包括靶病灶和非靶病灶)消失。根据患者长期随访结果分为疾病进展组和非进展组。疾病进展组:放疗后3个月复查MRI评估CR,随访中出现局部复发或远处转移,并经病理学或临床证实或随访中患者死亡。非进展组:放疗后3个月复查MRI评估CR,长期随访病情稳定,未出现局部复发或远处转移。随访至2021年6月,中位随访时间为54个月(5~90个月)。其中疾病进展组为29例,非进展组为61例。
按照我国2017版鼻咽癌TNM分期标准[14],由2位分别有8年和15年MRI影像诊断经验的医师利用鼻咽部和颈部MRI图像进行分期;对于分期有差异的病例,由这2位放射科医师讨论确定最终分期。患者TNM分期及临床分期信息如表1所示。
1.2 方法
所有患者均在MRI检查前禁食2 h,MRI扫描采用西门子公司Verio 3.0T MRI成像仪和16通道头颈联合相控阵线圈。患者采用仰卧位头先进方向。扫描序列包括鼻咽癌常规扫描序列(T1WI,T2WI,T1WI增强序列等)及DWI序列。DWI序列扫描采用单次激发快速自旋回波序列,其b值为0、800 s/mm2,层厚为5 mm。
DWI图像采用MITK-Diffusion软件(German cancer research center, Heidelberg, Germany)进行分析处理。结合T1WI增强图像,在对应的DWI图像上测量鼻咽部原发灶ADC值。勾画感兴趣区(region of interest,ROI)时选取肿瘤横断位最大层面实质区进行测量,避开坏死、出血区,测量3次后取平均值。
1.3 统计学分析
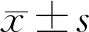
2 结果
2.1 患者MRI及DWI表现
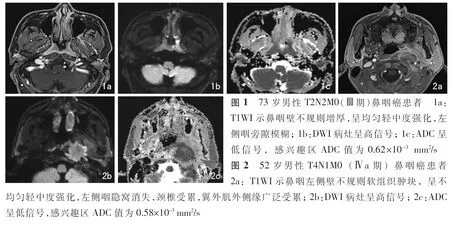
鼻咽部原发灶表现为鼻咽壁不规则增厚或软组织肿块,T1WI呈等或低信号,T2WI呈稍高信号,增强后均匀或不均匀强化(图1a、图2a),DWI呈高信号(图1b、图2b),相应ADC图呈低信号(图1c、图2c)。
2.2 鼻咽癌ADC值及与患者临床分期相关性
不同TMN分期和临床分期患者ADC值分布如表1所示。不同T分期患者原发肿瘤ADC值差异具有统计学意义(Z=8.322,P<0.05),进一步两两比较发现,T4期原发肿瘤ADC值显著低于T1期(P<0.05)和T2期(P<0.05),患者其余各期原发肿瘤ADC值无显著差异。不同N分期组原发肿瘤ADC值无显著差异(P>0.05)。Ⅰ、Ⅱ、Ⅲ、Ⅳa期原发肿瘤ADC值差异具有统计学意义(Z=10.268,P<0.05)。进一步两两分析发现,Ⅰ、Ⅱ期原发肿瘤ADC值显著高于Ⅲ期(P=0.031)和Ⅳa期(P=0.002),其余各期原发肿瘤ADC值无显著差异(P>0.05)。
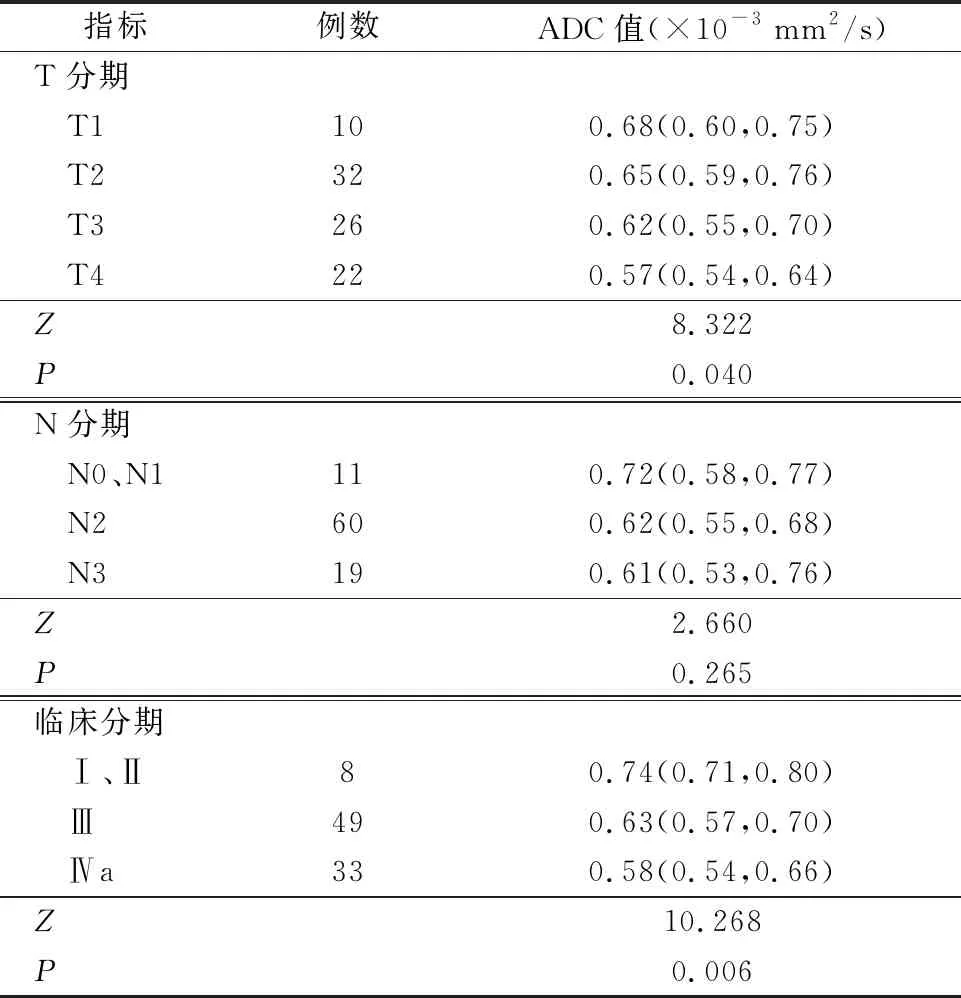
表1 原发肿瘤ADC值在不同TNM分期和临床分期患者中的比较 [M(P25,P75)]
相关性分析显示,T分期与ADC值呈负相关(r=-0.303,P=0.004),表明T分期越高,ADC值越低。临床分期与ADC值呈负相关(r=-0.314,P=0.003),表明临床分期越高,ADC值越低。N分期与ADC值无相关性(P>0.05)。
2.3 单因素分析鼻咽癌不同预后组ADC与临床参数的相关性
表2所示,不同预后组临床分期差异具有统计学意义(P<0.05)。Ⅳa期患者发生疾病进展的概率大于Ⅰ~Ⅲ期患者(χ2=10.330,P=0.001)。疾病进展组和非进展组ADC值、年龄、T分期、N分期差异无统计学意义(P>0.05)。
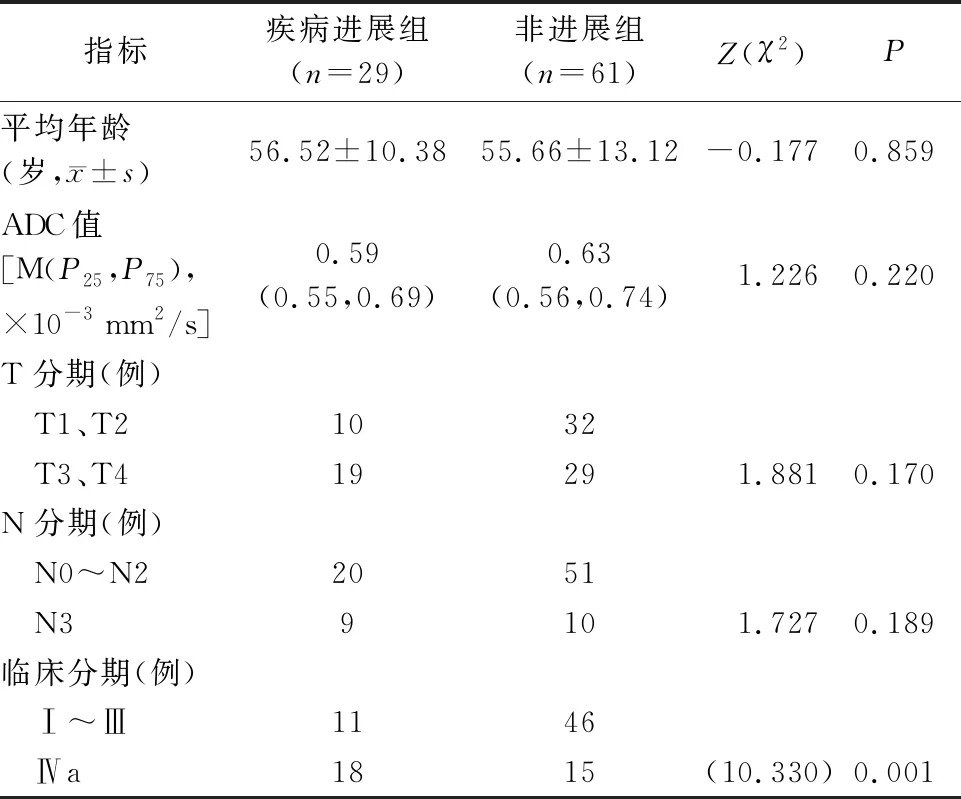
表2 鼻咽癌不同预后组单因素分析
2.4 多因素分析
以临床分期、年龄、ADC值为协变量,分析多个因素对鼻咽癌患者无病生存时间的影响。表3所示,多因素Cox分析结果显示,临床分期与鼻咽癌预后相关(P<0.05)。与Ⅰ~Ⅲ期相比,Ⅳa期疾病进展的风险为3.497倍(P=0.001)。
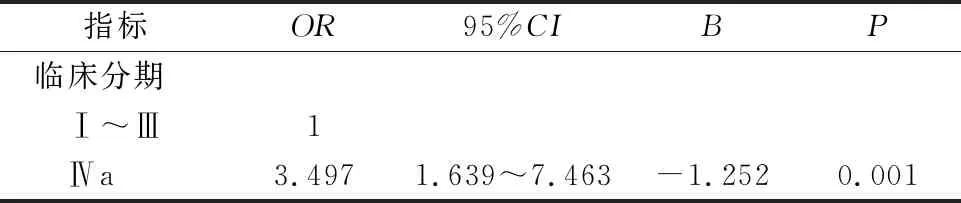
表3 影响患者无病生存时间的多因素分析
3 讨论
MRI扫描成像是鼻咽癌诊断、分期、疗效评估和随访的重要辅助检查,DWI作为常规序列,利用水分子的扩散运动特性进行成像,使MRI对人体的研究深入到细胞水平。肿瘤细胞排列紧密,细胞外水分子运动受限,DWI呈高信号,ADC呈低信号,ADC值可以量化反映肿瘤组织的微观结构特征。与其他功能检查如体素内不相干运动扩散成像和动态增强MRI成像相比,DWI成像所需时间短且不需注射造影剂,在鼻咽癌鉴别诊断、疗效预测、复发诊断等方面运用广泛[15-17]。
治疗前进行预后评估指导个体化治疗方案制定,可以改善鼻咽癌患者的预后。TNM分期仅基于解剖学侵犯范围判定肿瘤预后,临床上需要有效且方便的手段从微观层面反映肿瘤侵袭性[18]。原发肿瘤ADC值可以用于预测鼻咽癌患者远期预后[9-10]。也有ADC值与其他肿瘤预后相关性的报道[19-20]。恶性度越高的肿瘤增殖越活跃,细胞密度增加导致水分子扩散受限程度增加,ADC值降低,因此ADC值与肿瘤侵袭性相关,在肿瘤预后评估中具有一定价值。
本研究中,鼻咽癌原发肿瘤ADC值随T分期和临床分期增加而下降,两两比较显示,T4期组ADC值显著低于低分期组,Ⅰ、Ⅱ期组ADC值显著高于高分期组,而相邻组别间鉴别较困难,这可能与鼻咽部解剖结构复杂,侵犯范围难以界定有关。孙家元等[21]的研究也证实ADC值与临床分期呈负相关,临床分期Ⅰ期和Ⅱ期组的平均ADC值分别为(0.75 ±0.07)×10-3mm2/s、(0.71 ±0.08)×10-3mm2/s,与本研究结果0.74(0.71,0.80)×10-3mm2/s相近,但不同T分期组ADC值无显著差异。笔者分析,孙家元等[21]研究参照2008分期系统,本研究所参考的2017分期将翼外肌、鼻旁窦、翼内肌等侵犯降低分期,新版分期不同T分期组间侵袭性差异可能更明显,另外,该项研究中并未对纳入的对象具体病理类型作描述。周玮等[22]也证实ADC值随T分期增加而降低,但其测得各T分期组的ADC值均高于本研究,这可能与病例选择相关,其研究对象包括未分化癌、鳞状细胞癌和黏液表皮样癌,且样本数相对较少。本研究中不同分期间ADC值存在重叠,在实际临床运用中,ADC值量化较困难,还需要进一步多中心大样本的研究。
相较于常规二维(2DRT),调强放射治疗的剂量分布优势在提高肿瘤照射剂量的同时降低了周围正常组织的受量,使鼻咽癌治疗疗效进一步提高,5年总生存率和局部控制率达到77%~84%、87%~92%[23]。筛选放/化疗后复发转移高危的人群,优化治疗方案,是进一步提高鼻咽癌疗效的关键。中国鼻咽癌2017版分期在2008分期基础上参照UICC/AJCC第8版修订,在判断预后方面具有重要价值。本研究中,Ⅳa期患者较Ⅰ~Ⅲ期更容易发生复发转移,临床上对于局部分期较晚的鼻咽癌,高强度的化疗能够消灭潜在的转移病灶,降低疾病进展的风险,延长患者的无进展生存期[24]。另外,在诱导和同期放/化疗基础上联合免疫治疗的临床试验正在开展,有望改善Ⅳa期鼻咽癌患者预后[25]。
联合其他临床因素或分子标志物辅助TNM分期预测预后,是当前鼻咽癌领域研究的热点[2]。本研究中ADC值与T分期和临床分期呈负相关,但不同预后组间ADC值差异无统计学意义。既往有报道肯定了原发肿瘤ADC值在预后判断中的价值。Yan等[10]纳入了93例鼻咽癌患者,以原发肿瘤ADC值0.72×10-3mm2/s为阈值进行分组,发现低ADC值组3年无局部复发生存率显著低于高ADC值组,随访中出现死亡、局部复发或远处转移病例的原发肿瘤ADC值显著低于随访稳定组,另外病理类型为未分化型组的ADC值低于高、低分化组,该研究病例包含不同分化程度非角化癌和角化性鳞状细胞癌,这可能是该研究测得原发肿瘤ADC平均值(0.72×10-3mm2/s)高于本研究进展组和非进展组的中位值(0.59×10-3mm2/s、0.63×10-3mm2/s)的原因之一,病理类型未统一也许是造成预后结果差异的原因之一。Zhang等[9]的研究与之相反,其纳入541例病例,发现高ADC值组(ADC值≥0.747×10-3mm2/s)3年无局部复发生存率和无病生存率显著低于低ADC值组(ADC值<0.747×10-3mm2/s),但纳入的病例包括角化性鳞状细胞癌、分化型非角化癌、未分化癌,且中位随访时间为37.3个月,病理类型不一和随访时间相对较短可能造成结果偏倚。本研究发现ADC值与分期相关,临床分期是预后的预测因素,提示原发肿瘤ADC值可以辅助TNM分期,在预后预测中存在一定价值。由于本研究和上述两项研究纳入的病例大部分为局部中晚期患者,可能存在病例选择偏差,同时纳入的病例数少、扫描设备不统一、ADC值定量结果受多种因素干扰等原因,ADC在预后预测中的作用有待进一步验证。
本研究存在一些不足:①ADC值受选择的肿瘤层面和勾画的ROI面积影响,未来将结合全容积直方图更全面的反映肿瘤组织的异质性;②由于是回顾性研究,样本量有限,存在一定偏倚可能,后期将扩大样本量纳入更多病例;③部分复发和转移病例因活检取材困难,无法获取病理诊断复发转移,研究中根据长期随访进行判定,后期将继续延长随访时间。
综上所述,DWI表观扩散系数值与鼻咽癌分期相关,临床分期是鼻咽癌预后的预测因子。
