miR-196b-5p减轻大鼠脊髓损伤后组织水肿和星形胶质细胞活化机制探讨
2022-11-10孔俊东李坚张强强李刚蔡家骏范仲凯
孔俊东,李坚,张强强,李刚,蔡家骏,范仲凯△
脊髓损伤(spinal cord injury,SCI)后继发性水肿是SCI的重要病理过程,通常在SCI后2 h出现,在3 d内达到高峰[1-2]。水通道蛋白4(AQP4)是主要的选择性水通道蛋白,主要表达于神经元和血管周围的星形胶质细胞足突中,参与中枢神经系统水肿的形成过程[3]。SCI后,星形胶质细胞活化增生形成反应性星形胶质细胞(RA),表达胶质纤维酸性蛋白(GFAP)并参与胶质瘢痕的形成,阻碍SCI后脊髓修复过程[4]。既往研究发现,抑制SCI后AQP4的表达除能够减轻脊髓水肿外,还能降低GFAP的表达,抑制星形胶质细胞的活化增生[5-6]。因此,脊髓水肿与星形胶质细胞活化增生之间可能存在一定的联系,但具体机制尚不明确。微小RNA(miR)在多种生理病理活动中发挥着重要作用[7-8]。既往研究发现,miR-196b-5p可通过下调AQP4的表达抑制胃癌的进展[9],但鲜见在SCI领域中miR-196b-5p与AQP4关系的研究。本研究旨在探讨miR-196b-5p对大鼠SCI后水肿和星形胶质细胞活化增殖的影响,以期为SCI的治疗寻求新方法、新思路。
1 材料与方法
1.1 实验材料 成年雌性SPF级SD大鼠78只,体质量180~220 g,由锦州医科大学SPF级实验动物中心[动物生产许可证号SYXK(辽)2019-0007]提供。miR-196b-5p模拟物(agomiR-196b-5p)/miR-196b-5p阴 性 对 照(antagomiR-196b-5p)购自苏州吉玛生物科技有限公司,使用DEPC处理水溶解,浓度60 nmol/L。重组质粒AQP4野生型/突变型(AQP4 WT/MUT)和miR-196b-5p模拟物/阴性对照(miR-196b-5p mimicis/mimicis control)由湖南普拉特泽公司构建。PrimeScriptTMRT reagent with gDNA Eraser、TB Green®Premix Ex TaqTMⅡ购自日本Takara公司;miRcute增强型miRNA cDNA第一链合成试剂盒、miRcute增强型miRNA荧光定量检测试剂盒购自天根生化科技(北京)有限公司;兔源AQP4多克隆抗体购自武汉三鹰生物技术有限公司,兔源GFAP、SCI 4周的生长相关蛋白43(GAP-43)单克隆抗体,鼠源增殖细胞核抗原(PCNA)单克隆抗体,HRP标记山羊抗兔二抗、山羊抗小鼠二抗购自美国Cell Signaling Technology公司;鼠源β-actin单克隆抗体购自美国Santa Cruz公司;RIPA裂解液、BCA蛋白浓度测定试剂盒、Western blot预制胶、超敏ECL化学发光检测试剂盒、苏木素-伊红(HE)染色试剂盒均购自沈阳万类生物科技有限公司。
1.2 研究方法
1.2.1 模型建立及分组18只成年雌性SD大鼠采用随机数字表法分为假手术(Sham)组及SCI 1、2、3、5及7 d组,每组3只。另外60只成年雌性SD大鼠按照随机数字表法分为Sham组、SCI组、agomiR-196b-5p干预(miRNA)组和miR-196b-5p阴性对照(NC)组,每组15只,每组再使用随机数字表法分为5个亚组,每个亚组3只。Sham组仅行椎板去除术,SCI组、miRNA组和NC组均采用改良后大鼠脊髓挤压装置诱导大鼠中度脊髓损伤,挤压时大鼠出现后肢痉挛性颤动和尾巴痉挛性摆动,麻醉苏醒后呈双下肢弛缓性瘫痪视为造模成功[10]。在诱导SCI成功后,miRNA组和NC组使用微量注射器分别向大鼠鞘内注射agomiR-196b-5p与antagomiR-196b-5p,20µL/d,连续3 d,Sham组和SCI组注射等量生理盐水。大鼠出现摆尾反射,回抽出现脑脊液视为微量注射器插入髓鞘内。2只大鼠造模后死亡,1只大鼠未成功诱导SCI被剔除并及时补齐相应分组。术后每日腹腔注射青霉素8万单位预防感染,连续3 d。人工协助大鼠排尿,早晚各1次,直至大鼠排尿反射恢复。所有动物饲养温度为(24±2)℃,湿度40%~50%,12 h/12 h光暗交替,食物、水分充足供应。实验大鼠的模型操作和术后护理遵循中国实验动物保护和伦理委员会规定。
1.2.2 双荧光素酶报告实验 应用TargetScan(https://www.targetscan.org)和miRDB(http://mirdb.org)数据库预测AQP4的上游调控基因,通过筛选发现miR-196b-5p是AQP4的上游调控基因。使用双荧光素酶检测报告检测miR-196b-5p与AQP4之间的靶向关系。miR-196b-5p mimics与AQP4 WT或AQP4 MUT质粒共转染293T细胞,并以mimics control为对照。转染48 h后,多功能酶标仪分别检测萤火虫荧光素酶反应强度和海肾荧光素酶反应强度。实验结果以两荧光素酶相对荧光强度表示,重复3次。
1.2.3 RT-qPCR检 测SCI后 脊 髓miR-196b-5p与AQP4mRNA表达Sham组及SCI后1、2、3、5及7 d组大鼠以损伤点为中心取长度约为1 cm的脊髓组织,采用低温匀浆仪匀浆30 s,Trizol试剂提取各样本总RNA,检测miR-196b-5p及AQP4在不同时间点表达水平。miR-196b-5p和AQP4分别使用第一链合成试剂盒逆转录成相应cDNA模板。miRNA RT-qPCR反应体系:2×miRcute Plus miRNA PreMix 10 µL,上、下游引物各0.4µL,cDNA 1µL,DEPC处理水8.6µL。反应条件:95℃预变性15 min;94℃变性20 s,60℃退火延伸34 s,40个循环。U6作为标准内参。miR-196b-5p及U6引物由广州锐博生物公司合成(序列保密)。AQP4 RT-qPCR反应体系:2×SYBR SuperMix Plus 10 µL,上、下游引物各2 µL,cDNA 1µL,DEPC处理水5µL。反应条件:95℃预变性1 min;95℃变性20 s,60℃退火20 s,72℃延伸30 s,40个循环。GAPDH作为内参。AQP4及GAPDH引物由武汉塞维尔公司合成,相对表达水平以2-ΔΔCt法计算,引物序列见表1。
1.2.4 干湿质量法检测脊髓组织含水量 术后3 d,收集大鼠以损伤点为中心的长度为1 cm的新鲜脊髓组织,用高灵敏度分析天平(METFLERAE26)称质量(湿质量),随后放入80℃恒温烘箱中烘干48 h,连续称质量直至质量稳定不再变化(干质量),每个样本连续测量3次,取平均值。按埃利奥特(Ellicot)公式计算组织含水量:含水量=(湿质量-干质量)/湿质量×100%。
1.2.5 Western blot法检测AQP4、GFAP、PCNA和GAP-43表达水平 术后3 d,以损伤点为中心,取长度约为1 cm的脊髓组织。加入适量的RIPA后依次经过剪碎、组织破碎、细胞破碎、静止30 min、4℃12 000 r/min离心20 min后取蛋白上清液,按照BCA蛋白浓度测定试剂盒说明书步骤测定各样本的蛋白浓度。每组蛋白上样量30 µg,在室温进行SDS-PAGE电泳,将凝胶上蛋白转至PVDF膜上,1%BSA室温封闭2 h,TBST洗膜后加入稀释好的一抗AQP4(1∶1 000)、GFAP(1∶1 000)、PCNA(1∶1 000)、β-actin(1∶1 500)并于4℃冰箱孵育过夜,次日洗膜后,加入对应二抗(1∶5 000)室温孵育2 h,ECL化学发光法显色。术后4周,以同样方法取得脊髓组织并检测GAP-43表达水平。
1.2.6 HE染色检测大鼠脊髓空洞大小 术后4周取脊髓,脊髓纵向切片在去离子水中洗涤5 min,依次进行二甲苯浸泡,梯度乙醇脱水,苏木精染色2 min,伊红染色15 s,中性树胶封片。染色图像使用Image J软件测量空洞相对大小。
1.3 统计学方法 采用SPSS 23.0软件进行数据分析。符合正态分布的计量资料以±s表示,2组间比较采用独立样本t检验,多组间的比较采用单因素方差分析,组间多重比较用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-196b-5p可调控AQP4基因表达 双荧光素酶报告实验显示,与对照质粒比较,miR-196b-5p mimics与AQP4 3'-UTR野生型质粒共转染后,细胞荧光素酶活性下降(P<0.01);而miR-196b-5p与AQP4 3'-UTR突变型质粒共转染后,荧光素酶活性与对照质粒差异无统计学意义(P>0.05),见图1。
2.2 各组脊髓miR-196b-5p与AQP4 mRNA表达水平比较 与Sham组比较,SCI后各时间点miR-196b-5p相对表达水平降低(均P<0.05)。与Sham组比较,SCI 1 d、2 d、3 d和5 d组AQP4 mRNA相对表达水平升高(均P<0.05);与SCI 2 d组比较,SCI 1 d、3 d、5 d及7 d组AQP4 mRNA相对表达水平降低(P<0.05),见表2。

Fig.1 Prediction and validation of the targeting relationship between AQP4 and miR-196b-5p图1 AQP4与miR-196b-5p靶向关系的预测与验证
Tab.2 Expression levels of miR-196b-5p and AQP4 in groups of rats after SCI表2 SCI后各组大鼠miR-196b-5p与AQP4表达变化(n=3,±s)

Tab.2 Expression levels of miR-196b-5p and AQP4 in groups of rats after SCI表2 SCI后各组大鼠miR-196b-5p与AQP4表达变化(n=3,±s)
**P<0.01;a与Sham组比较,b与SCI 1 d组比较,c与SCI 2 d组比较,P<0.05;表3、4同。
组别Sham组SCI 1 d组SCI 2 d组SCI 3 d组SCI 5 d组SCI 7 d组F miR-196b-5p 1.00±0.15 0.01±0.00a 0.02±0.00a 0.07±0.01a 0.11±0.02a 0.11±0.02a 119.063**AQP4 mRNA 1.00±0.18 13.96±1.30a 25.61±2.04ab 16.15±0.78ac 10.79±1.49ac 3.84±0.64c 156.183**
2.3 各组miR-196b-5p、AQP4及脊髓组织含水量比较 与Sham组比较,SCI组、miRNA组和NC组AQP4 mRNA及蛋白相对表达水平、脊髓含水量增加,而SCI组及NC组miR-196b-5p相对表达水平降低(均P<0.05);与miRNA组比较,SCI组和NC组AQP4 mRNA及蛋白相对表达水平、脊髓含水量增加,而miR-196b-5p表达水平降低(均P<0.05);SCI组与NC组各指标比较差异无统计学意义(P>0.05),见表3、图2A。
2.4 各组GFAP、PCNA及GAP-43蛋白相对表达水平比较 与Sham组比较,SCI组、miRNA组及NC组GFAP、PCNA和GAP-43蛋白相对表达水平升高(均P<0.05);与SCI组及NC组比较,miRNA组GFAP、PCNA相对表达水平降低,GAP-43相对表达水平升高(均P<0.05);SCI组与NC组各蛋白相对表达水平差异无统计学意义,见图2B、C,表4。
2.5 miR-196b-5p促 进SCI后 脊 髓 修 复Sham组脊髓结构完整,无损伤空洞,SCI组、miRNA组及NC组出现明显脊髓空洞,见图3。SCI组、miRNA组、NC组脊髓空洞相对面积分别为(1.00±0.04)、(0.49±0.03)及(1.00±0.01),差异有统计学意义(n=3,F=338.227,P<0.05),miRNA组脊髓空洞面积小于SCI组和NC组(P<0.05),SCI组及NC组差异无统计学意义。
Tab.3 Changes of miR-196b-5p,AQP4 and water content after treatment in four groups of rats表3干预后各组大鼠miR-196b-5p、AQP4及脊髓含水量变化 (n=3,±s)

Tab.3 Changes of miR-196b-5p,AQP4 and water content after treatment in four groups of rats表3干预后各组大鼠miR-196b-5p、AQP4及脊髓含水量变化 (n=3,±s)
组别Sham组SCI组miRNA组NC组F miR-196b-5p 1.00±0.15 0.15±0.02a 0.86±0.03b 0.25±0.06ac 80.655**AQP4 mRNA 1.00±0.31 24.12±2.26a 9.66±0.30ab 25.53±4.14ac 74.657**AQP4 0.78±0.16 2.67±0.37a 1.86±0.26ab 2.68±0.30ac 30.444**脊髓含水量(%)70.17±0.18 74.18±0.23a 72.31±0.17ab 74.38±0.20ac 299.531**
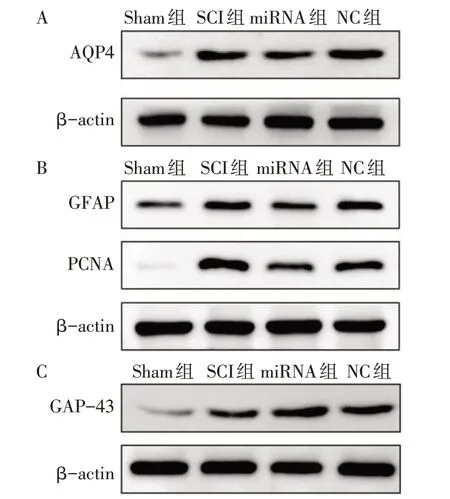
Fig.2 Effects of AQP4,GFAP,PCNA and GAP-43 protein expression levels after SCI in four groups of rats图2各组大鼠SCI后对AQP4、GFAP、PCNA及GAP-43蛋白表达水平的影响
Tab.4 Comparison of relative expression levels of GFAP,PCNA and GAP-43 protein between the four groups of rats表4各组大鼠GFAP、PCNA及GAP-43蛋白相对表达水平比较 (n=3,±s)

Tab.4 Comparison of relative expression levels of GFAP,PCNA and GAP-43 protein between the four groups of rats表4各组大鼠GFAP、PCNA及GAP-43蛋白相对表达水平比较 (n=3,±s)
组别Sham组SCI组miRNA组NC组F GFAP 1.00±0.12 1.99±0.21a 1.48±0.01ab 1.88±0.11ac 34.792**PCNA 1.00±0.18 16.95±1.42a 11.29±1.02ab 16.18±0.91ac 164.079**GAP-43 1.00±0.03 1.72±0.16a 2.78±0.06ab 1.81±0.04ac 194.353**
3 讨论
MiRNA广泛存在于中枢神经系统[11]。大量研究表明,多种miRNA与SCI后继发性损伤有关,如通过鞘内注射miR-125a-5p可以有效保护SCI后大鼠血-脊髓屏障功能并促进运动功能的恢复[12];miR-29b可以减弱缺血诱导的血脑屏障破坏和脑水肿形成,减少缺血后梗死体积[13];miR-126可以影响新血管形成,从而促进大鼠脊髓损伤后脊髓组织和运动功能恢复[14]。miRNA一般通过与靶基因3'-UTR区结合而沉默靶基因[15]。本研究通过TargetScan和miRDB数据库预测发现,AQP4 3'-UTR区与miR-196b-5p存在互补结合位点,并通过双荧光素酶报告验证了AQP4与miR-196b-5p之间的靶向关系。通过RT-qPCR发现,SCI后miR-196b-5p表达下降而AQP4表达升高,表明miR-196b-5p可能能够抑制AQP4的表达,这与Li等[9]的研究相符。

Fig.3 Results of spinal cord repair after SCI in four groups of rats(HE,×50)图3各组大鼠SCI后脊髓损伤修复结果(HE,×50)
SCI后继发性水肿可迅速引起髓鞘内压力增大,局部组织缺血坏死,加剧神经元的损伤和运动功能的丧失[16-17]。AQP4参与血-脊髓屏障及中枢神经系统水肿的形成,是SCI诱导水肿的主要参与者,抑制AQP4的表达能有效降低SCI后脊髓水肿程度[3]。另有研究发现,过表达的miR-196b-5p同样能抑制GFAP与PCNA的表达,这表明过表达的miR-196b-5p不仅能够减轻脊髓水肿,还能抑制星形胶质细胞的活化增生[18]。本研究亦证实,过表达的miR-196b-5p能在基因和蛋白水平抑制AQP4的表达,并降低脊髓含水量。星形胶质细胞活化形成RA参与胶质瘢痕的形成,通过级联反应刺激炎症细胞因子和具有神经毒性的活性氧等物质产生和释放,阻碍神经元轴突延伸和神经修复,因此,抑制胶质瘢痕的形成对SCI的恢复具有重要意义[19-20]。本研究结果显示,过表达的miR-196b-5p能上调神经元轴突再生的标志蛋白GAP-43的表达并减小脊髓空洞的面积,这表明过表达的miR-196b-5p能够促进SCI后脊髓组织修复和神经元轴突再生。AQP4参与SCI后定位于星形胶质细胞的细胞毒性水肿,并通过抑制细胞色素氧化酶5A(cytochrome coxidase,COX5A)的表达,而影响星形胶质细胞能量代谢[21]。因此,笔者推测AQP4可能是通过介导能量代谢的方式使星形胶质细胞处于应激状态,促使其向RA转变并增殖,形成胶质瘢痕组织,阻碍神经元的再生。
综上所述,过表达的miR-196b-5p可通过靶向抑制AQP4的表达,减轻SCI后脊髓水肿和星形胶质细胞的活化增生,减少胶质瘢痕的形成,促进SCI后神经元再生和组织修复,提示miR-196b-5p治疗SCI有较大潜力。然而,对于AQP4与星形胶质细胞之间的联系,miRNA在临床工作中如何应用,其治疗的有效性、安全性等问题还有待进一步研究。
