碘对比剂诱发甲状腺功能减退的病因及临床特点研究进展
2022-11-10韩楚仪张敬霞丛洪良
韩楚仪,张敬霞,丛洪良△
碘对比剂(iodinated contrast media,ICM)目前已广泛应用于临床实践。然而,单剂量超生理负荷的ICM可触发机体防御机制,进而导致甲状腺激素合成暂时减少(Wolff-Chaikoff效应),一般在1周后甲状腺功能开始恢复正常;如未能及时逃逸急性效应会导致暂时或永久性的甲状腺功能减退(hypothyroidism,Hypo)[1-2]。目前这种效应机制仍未完全阐明。ICM暴露对基线风险人群,尤其是基线亚临床甲状腺功能减退(subclinical hypothyroidism,SCH)患者甲状腺功能的影响以及碘诱发性事件的时间进程等尚未完全确定。本文就ICM诱发性甲状腺功能减退(ICM-induced hypothyroidism,IIHypo)相关的上述问题予以综述,以期更合理判断ICM前后患者的甲状腺功能变化及其风险因素。
1 IIHypo的机制
正常情况下,循环碘化物经甲状腺滤泡细胞基底外侧膜的Na/I同向转运体(Na/I symporter,NIS)蛋白进入细胞,游离碘化物在细胞顶端膜外被甲状腺过氧化物酶氧化,然后与甲状腺球蛋白的酪氨酸残基共价结合[3],见图1。一个标准的非离子型ICM约为300 g/L,同一溶液也存在游离碘污染,其上限为90 mg/L[4-5]。传统观点认为,来源于ICM制剂或组织中的ICM脱碘后释放出的大量游离碘化物介导了甲状腺摄取碘障碍,同时甲状腺细胞NIS蛋白表达显著减少导致短暂的Hpyo,但这种观点从未得到证实[1,6-7]。为验证上述观点,Vassaux等[8]采用质谱分析定量测得碘美普尔(Iomeron)和碘克沙醇(Visipaque)中游离碘化物浓度分别为30µmol/L和100µmol/L;在表达NIS的小鼠甲状腺、唾液腺中分别注射ICM及作为游离碘化物的碘化钠(NaI)后以微单光子发射计算机断层成像检测,发现甲状腺、唾液腺均对碘化物类似物高99mTcO4-的摄取减少,而注射Iomeron仅发现甲状腺对99mTcO4-的摄取减少,在注射4 d后甲状腺组织几乎无法检测出NIS蛋白,而唾液腺则无上述影响;注射Visipaque也获得了类似的结果。
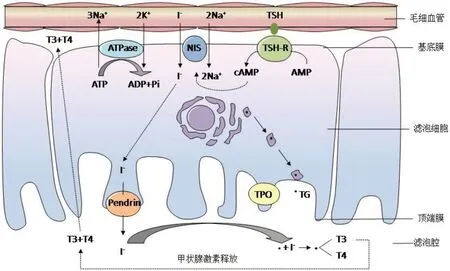
Fig.1 Schematic representation of the role of NIS in iodide transport in normal thyroid follicular cells图1 NIS在正常甲状腺滤泡细胞碘转运中的示意图
为明确ICM诱导的甲状腺细胞内事件与由游离碘化物触发的事件是否相同,Hichri等[3]应用定量蛋白质组学评估ICM和NaI处理后小鼠甲状腺蛋白质含量。该研究发现,与各自对照组比较后分别确定了12个和57个差异表达蛋白,其中仅H2-D1、KRT25蛋白为两者的共同差异表达;对路径改变的IPA分析表明,在ICM和NaI两种处理的小鼠甲状腺中分别独有25条及15条路径、9条共同路径,包括代谢途径和信号通路。ICM诱导甲状腺细胞蛋白质的急剧变化导致16条不同路径激活,这些被激活的路径可能是导致甲状腺NIS表达减少、碘化物摄取减少的共同机制,并可能是ICM长期影响甲状腺碘摄取的原因。该研究证实了常见的细胞内机制参与了ICM和NaI两种效应物促进的甲状腺碘化物摄取减少。
目前关于促甲状腺激素(thyroid-stimulating hormone,TSH)在过量碘负荷导致甲状腺功能障碍(thyroid dysfunction,TD)中的作用研究较少。正常生理条件下,TSH与其受体结合刺激一些上皮细胞(包括甲状腺细胞和唾液腺导管细胞)表达NIS,碘化物得以通过并进入细胞内[9-10]。Hichri等[3]研究发现,在ICM给药后1 d,小鼠甲状腺对99mTcO4-摄取量较低,注射人类重组TSH未能显著增加甲状腺摄取99mTcO4-,并且发现甲状腺组织TSH受体表达下调,表明ICM诱导的细胞变化除了影响NIS外还会降低TSH受体的表达,导致甲状腺对由TSH诱导的碘摄取减少。Resende等[11]通过肌内注射重组人TSH可以逆转患者甲状腺对碘化物摄取的抑制,但该队列研究中的9例患者异质性较大,ICM诱发甲状腺顿挫程度相对较低。
2 IIHypo事件发病率和时间进程及其评估
有关IIHypo的患病率的临床数据很少,结果差异也较大。Bonelli等[12]在碘负荷对缺血性心脏病患者甲状腺功能影响的单中心横断面研究中发现,ICM暴露后1个月IIHypo发生率为2.4%。Si等[13]对接受冠状动脉血管造影(coronary angiography,CAG)或经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的154例总三碘甲 状腺原氨酸(total triiodothyronine,TT3)降低的稳定型心绞痛患者研究表明,术后6个月SCH发生率为3.9%,但未发现显性甲状腺功能减退(overt hypothyroidism,OHypo)。Barr等[14]报道,18岁以下患者在ICM暴露后发生Hypo占所有ICM诱发TD病例的84%。
IIHypo患病率难以确定的原因较为复杂,主要原因之一是ICM暴露后对甲状腺功能评估和随访时间不同。一项跨越70年的Meta分析显示,在ICM暴露后评估甲状腺功能的1 493篇文献中,研究的终点时间在1~541 d;在符合入选标准的30篇中有28项研究的时间终点选择在7~56 d,数据提取集中在碘暴露后1周和1个月两个时间点[15]。这些研究中低质量证据的原因可能涉及基线特征及疾病定义的异质性、甲状腺激素评估的时间间隔及随访时间不同、研究规模较小、使用不同种类的ICM以及缺乏对诱发事件风险因素的预测等诸多因素[1,16]。
明确过量碘负荷后TD的发生和持续时间对临床合理评估、筛查诱发事件具有一定临床意义。Wolff-Chaikoff效应是甲状腺适应过量碘的自我调节机制,在实验及临床研究中暂时性TD一般发生在1周内,恢复时间可能从几个星期到几个月[2,5]。在一些过量碘不能从体内迅速消除的患者中出现IIHypo延长,在极少数情况下IIHypo可能是永久的[17-18]。最近一项评估这种效应持续时间的研究发现,在静脉注射Iomeron 2周后患者甲状腺的闪烁扫描区域缺乏显影,给药后2个月时该区域摄取99mTcO4-能力仍较低[3]。有研究报告甲状腺功能正常的结节性甲状腺肿患者在ICM暴露6个月后仍可发生Hypo,这种ICM后发生的延迟效应机制是复杂的,可能涉及ICM暴露后部分甲状腺激素相关基因的表达降低[19]。ICM暴露后甲状腺功能性反应的程度和持续时间存在不确定性,使临床判断面临困难。
鉴于诱发TD事件的时间不可预测,从ICM暴露后几天到2年不等[20-21]。近年来临床开始关注从ICM暴露到发生诱导事件时间之间的“易受攻击时间窗”。Barr等[14]研究发现,从ICM给药到发生Hypo事件的中位时间为10.8个月,因此将ICM暴露定义为在确诊TD的前2年内最早的给药日期。在Jick等[4]的研究中,诱导事件的时间为碘暴露后1~310 d,平均117 d。Kornelius等[21]也报告IIHypo持续时间为ICM暴露后2.1年,并认为ICM诱导事件与碘暴露有时间关系,而其他病因引起的TD病例不一定发生在碘暴露时间附近。上述研究表明,碘暴露后甲状腺的易受攻击时间窗实际上比在实验和临床观察中发现的仅仅几天或几周时间窗更宽,TSH对碘负荷的反应是高度可变和不可预测的。在ICM暴露后评估患者甲状腺功能时,无法找到一个预测甲状腺最大反应的时间点和合理的监测时间间隔,因而可能遗漏和(或)隐匿了一些延迟性甲状腺功能性反应,甚至OHypo病例,或在碘暴露后过宽的易攻击时间窗内出现了混淆病因的因素,例如非甲状腺疾病在急性发作期间血清TSH水平短暂地升高[22-23],新发和潜在性甲状腺疾病/共病的进展等,临床实践中很难将发生甲状腺功能异常的病因明确归于ICM的诱发[24]。碘暴露后诱发事件发生时间越晚,事件的原因越不易确定。此外,当碘暴露时间窗过宽时,由于尿中碘浓度可能不再增加,Hypo和ICM暴露的关系可能很难证实,目前各种有关TD的国际指南也没有详细解决ICM暴露的问题[5,25]。因此,如何界定甲状腺对过量碘负荷功能性反应的时间窗,以便准确评估甲状腺功能、及时发现TD患者有待进一步研究。
3 ICM暴露对基线Hypo患者甲状腺功能的影响
目前对ICM诱导性TD的研究多为甲状腺功能正常的人群,对于在ICM暴露后基线Hypo特别是SCH患者的甲状腺功能如何变化、是否增加发生OHypo的风险研究极少。一些研究显示,在ICM暴露数周后血清TSH、游离甲状腺素(free thyroxine,FT4)和游离三碘甲状腺原氨酸(free triiodothyronine,FT3)水平的变化取决于碘的摄入量及已存在的甲状腺疾病[1,26]。在Gartner等[20]的研究中,22例甲状腺功能正常者在ICM后7 d内血清TSH最大值与基线血清TSH值呈高度相关(r=0.794,P<0.01),血清FT4和FT3保持不变,且ICM剂量与血清TSH水平无相关性,显示ICM后血清TSH变化似乎取决于甲状腺最初的状态。一项关于CAG检查前患者甲状腺功能的研究发现,约有40%的患者出现TD,其中低T3综合征28%,Hypo约10%;对接受PCI的患者随访发现,低T3综合征患者死亡风险增加[1]。因此,在ICM暴露前发现未经诊断的基线TD患者具有一定临床意义[27]。然而,也有ICM诱发事件与甲状腺基础状态无关的研究报告。Üreyen等[9]回顾性研究显示,基线SCH患者占2.5%,在因冠状动脉慢性完全闭塞病变和非复杂病变而行PCI时,无一例基线SCH患者发展为OHypo。在对基线甲状腺功能亢进(hyperthyroidism,Hyper)的研究中也发现类似结果,无论患者是否有基线Hyper,碘暴露对甲状腺分泌的影响似乎没有差异[12]。Bervini等[15]的Meta分析并没有显示出基线甲状腺状态是ICM诱发Hyper的一个重要影响因素。因为未经治疗的基线SCH患者在ICM后存在病情加重的可能,ICM后应密切监测基线SCH患者的甲状腺功能[1]。
总体来说,基线Hypo患者在面临SCH和过量碘刺激导致功能性甲状腺反应的两种病因共存时,其甲状腺功能障碍是否加重甚至发展为OHypo,及其临床意义值得关注。有必要进一步研究基线TD患者在ICM后甲状腺功能变化及临床策略。
4 IIHypo的风险因素
一些危险因素与ICM诱导的TD相关,多见于患有潜在甲状腺疾病者,其中最常见的是结节性甲状腺肿[2,28]。Kornelius等[19]首次证实甲状腺功能正常的结节性甲状腺肿患者在ICM暴露后有更高的Hypo风险,高龄也与发生IIHypo的风险呈线性相关。其他影响甲状腺功能的甲状腺疾病如自身免疫性甲状腺炎、甲状腺部分切除术、经治疗的Graves病、产后或者亚急性甲状腺炎更易发生IIHypo。IIHypo主要发生在碘摄入充足地区和自身免疫性甲状腺炎患者。Wang等[29]研究表明,成人碘摄入量与甲状腺疾病之间存在U形关系,碘缺乏和碘过量都是成人甲状腺疾病的危险因素。一些药物如胺碘酮等使用后也有发生IIHypo的风险[30-32]。由于发生短暂IIHypo风险的潜在甲状腺疾病患者在未来可能处于永久性Hypo风险中,因此建议对大多数IIHypo患者在ICM暴露后给予密切监测[1]。
一些与甲状腺相关的共病也可能与ICM暴露后发生TD有关。研究发现,ICM暴露后大多数共病患者并没有增加TD的风险,仅贫血增加了整体TD的风险,系统性红斑狼疮增加了Hypo的风险,但ICM暴露后查尔森共病指数较高的患者发生TD的风险较高[19]。肾功能不全时碘清除受损和留滞可通过Wolff-Chaikoff效应增加发生Hypo的风险[33-34]。迄今尚无关于ICM暴露前后共病是否增加TD风险的前瞻性研究。
目前对反复多次ICM暴露是否增加TD风险的研究结果并不一致。Bøhmer等[6]首次报道了经历多次(甚至高达40次)ICM后会引起甲状腺功能的各种变化,在6周后可恢复到正常水平,认为在ICM后甲状腺有足够的自我调节能力。与此相反,有研究观察到了ICM重复暴露的累积效应,与暴露率较低的患者相比,平均每年超过1次的反复ICM暴露患者罹患TD的风险升高[35]。ICM暴露的频率与Hypo的风险明显相关,有2次或2次以上ICM暴露的患者发生Hypo的风险更高[19]。这种结果的确切机制尚不清楚,可能的解释是甲状腺未能逃逸Wolff-Chaikoff效应[1,27]。此外,关于单次高剂量ICM对甲状腺功能的影响仍存争议。Si等[13]研究发现ICM对患者甲状腺功能的影响与ICM剂量相关。然而,Gartner等[20]研究发现,ICM给药剂量与血清TSH峰值之间没有显著相关性。
5 小结
ICM暴露导致TD的机制仍未阐明,ICM可能独立于游离碘而选择性减少甲状腺对碘化物的摄取。由于碘暴露时间窗过宽、诱发事件的程度和持续时间存在不确定性,随访期间对患者以不恰当的时间间隔评估甲状腺功能可能会遗漏或隐匿一些ICM诱发病例,特别是对于基线TD或有风险因素的患者,因其在ICM后Hypo可能加重。优化ICM暴露后的患者管理程序、识别易导致IIHypo的共病是今后临床实践面临的课题。
