水中菌落总数3种检测方法的比较
2022-11-10曹新垲尹宝国张宝华张雨晨
曹新垲,张 琦,尹宝国,张宝华,张雨晨
(北京市自来水集团有限责任公司水质监测中心,北京 100012)
菌落总数作为评价水质优劣的卫生指示标准指标,是微生物检测的重要参数之一。现阶段国内常用的水中菌落总数检测方法为传统平皿计数法,该方法所使用的营养琼脂平板不能满足厌氧菌等特殊细菌的生理需求,导致部分细菌难以繁殖生长[1]。且在整体试验过程中不仅前处理操作繁琐,易引入外来污染与人为误差,同时对实验室无菌环境及试验人员技术能力要求较高,部分实验室检测能力难以达到要求,不适用于实验室的日常检测。
酶底物法(SimPlate法)培养基底物可与微生物特异性酶反应生成蓝色荧光的物质,培养后统计分析得到最终菌落总数[2-3]。美国环保署(EPA)于2002年将SimPlate法纳入EPA 9215E中,表明饮用水及地表水可以使用其检测菌落总数[4];广东省地方标准《水中菌落总数复合酶底物检测方法》(DB 44/T 1163—2013)[5]于2013年将SimPlate法引入国内;国家城市供水水质监测网武汉监测站于2019年采用定量盘法检测水中菌落总数,该方法的试验原理与SimPlate法基本一致,其检测结果与平皿计数法相比也没有显著的统计学差异[6];《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—XXXX)(2022年征求意见稿)[7]中也表明,可以使用SimPlate法检测生活饮用水及水源水的菌落总数。与平皿计数法相比,SimPlate法无需配制培养基,采用SimPlate法,不稀释的情况下1 mL水样可以检测738 MPN/mL的菌落总数,减少了培养基配制及样品稀释的误差,且不需要严格的无菌环境,更适用于检测水中菌落总数较高的样品。
EasyDisc法是对平皿计数法的革新,于2021年研发成功,目前还处于试用阶段。2022年,孙杰[8]采用EasyDisc法检测水中菌落总数,其检测结果与平皿计数法相比没有显著的统计学差异。EasyDisc法的PCA培养基脱水固定于47 mm的平皿底部,无需配制,微生物生长的代谢产物与PCA培养基中的显色物质反应生成蓝色菌落,便于人工计数。与平皿计数法相比,EasyDisc法减少了配制培养基等试验步骤,试验操作简便,生成的蓝色菌落便于计数,显著降低了外来污染和人为误差。
本文采用酶底物法、EasyDisc法和平皿计数法3种方法检测NSI菌落总数定量质控样品和实际样品,并将检测结果进行统计学分析[9-10]。
1 试验部分
1.1 试验设备
SimPlate法培养基、84孔分配盘、EasyDisc法培养基、NSI菌落总数定量质控样品、无菌缓冲液、无菌取样瓶等耗材购自爱德士公司;平皿计数法使用的营养琼脂购自青岛海博生物技术有限公司;试验使用经计量部门校准合格的国产隔水式恒温生物培养箱,温控精度为±0.5 ℃。
1.2 试验步骤
1.2.1 高浓度NSI菌落总数定量质控样品制备
从-10 ℃ 以下的冰柜中取出NSI菌落总数定量质控样品,常温状态下平衡15 min后,转移至100 mL无菌缓冲液中,水平摇匀,制备成高浓度NSI菌落总数定量质控样品。待样品完全溶解后,需在30 min内完成检测。
1.2.2 低浓度NSI菌落总数定量质控样品制备
将1.2.1小节的高浓度NSI菌落总数定量质控样品充分混匀后,吸取10 mL转移至100 mL无菌取样瓶中,用无菌水稀释至刻度线,制备成低浓度NSI菌落总数定量质控样品。
1.2.3 实际样品采集
采集北京地区出厂水、滤池出水及水源水各10组实际水样,采集过程参照《生活饮用水标准检验方法 水样的采集与保存》(GB/T 5750.2—2006)[11]中样品采集及保存要求,并在4 h内完成检测。
1.2.4 SimPlate法测定水中菌落总数
量取1 mL待测样品及9 mL无菌水加入SimPlate法培养基中,充分混匀,转移至84孔分配盘中,水平旋转分配盘使待测样品均匀分配于每个样品孔中,多余液体由盘内海绵吸收,倒置放入36 ℃ 培养箱中培养48 h后,在366 nm紫外灯下统计蓝色荧光孔数,对照MPN表查询菌落总数检测结果。
1.2.5 EasyDisc法测定水中菌落总数
量取1 mL待测样品加入EasyDisc法平皿中,水平混匀,使样品均匀分布于EasyDisc法平皿中,常温下静置20 min,使样品与培养基充分接触,正置放入36 ℃ 培养箱中培养48 h后,统计菌落总数检测结果。
1.2.6 平皿计数法测定水中菌落总数
平皿计数法试验过程参照《生活饮用水标准检验方法 微生物指标》(GB/T 5750.12—2006)[12]中1.1小节平皿计数法进行检测。
2 试验结果分析
2.1 高浓度NSI菌落总数定量质控样品检测结果分析
将同一高浓度NSI菌落总数定量质控样品以3种方法平行检测10次。其检测结果表明,3种方法检测结果的合格率均为100%。为进一步评价3种方法的准确性和稳定性,计算10组检测结果与真值的相对误差及检测结果的相对标准偏差,可得RSD(平皿计数法)=9.63%,RSD(SimPlate法)=5.69%,RSD(EasyDisc法)=6.07%,如表1、图1所示。结果表明,SimPlate法与EasyDisc法检测结果与真值的相对误差及相对标准偏差均小于平皿计数法。由此可知,SimPlate法与EasyDisc法检测高浓度NSI菌落总数定量质控样品时的准确性及稳定性优于平皿计数法。

表1 3种方法检测高浓度NSI菌落总数定量质控样品的检测结果Tab.1 Detection Results of High Concentration NSI Total Number of Colonies QC Samples by Three Methods

图1 3种方法检测高浓度NSI菌落总数定量质控样品检测结果的相对标准偏差Fig.1 Relative Standard Deviation of High Concentration NSI Total Number of Colonies QC Samples by Three Methods
2.2 低浓度NSI菌落总数定量质控样品检测结果分析
为验证3种方法检测低浓度样品的准确性及稳定性,分别以3种方法平行检测同一低浓度NSI菌落总数定量质控样品10次,最终检测结果为检测结果×稀释倍数。其最终检测结果表明,3种方法检测结果的合格率均为100%。为进一步评价3种方法检测低浓度样品的准确性及稳定性,计算10组检测结果与真值的相对误差及检测结果的相对标准偏差,可得RSD(平皿计数法)=12.37%,RSD(SimPlate法)=8.13%,RSD(EasyDisc法)=8.72%,如表2、图2所示。结果表明,检测低浓度NSI菌落总数定量质控样品时,SimPlate法与EasyDisc法检测结果与真值的相对误差及相对标准偏差均小于平皿计数法,其准确性及稳定性仍优于平皿计数法。
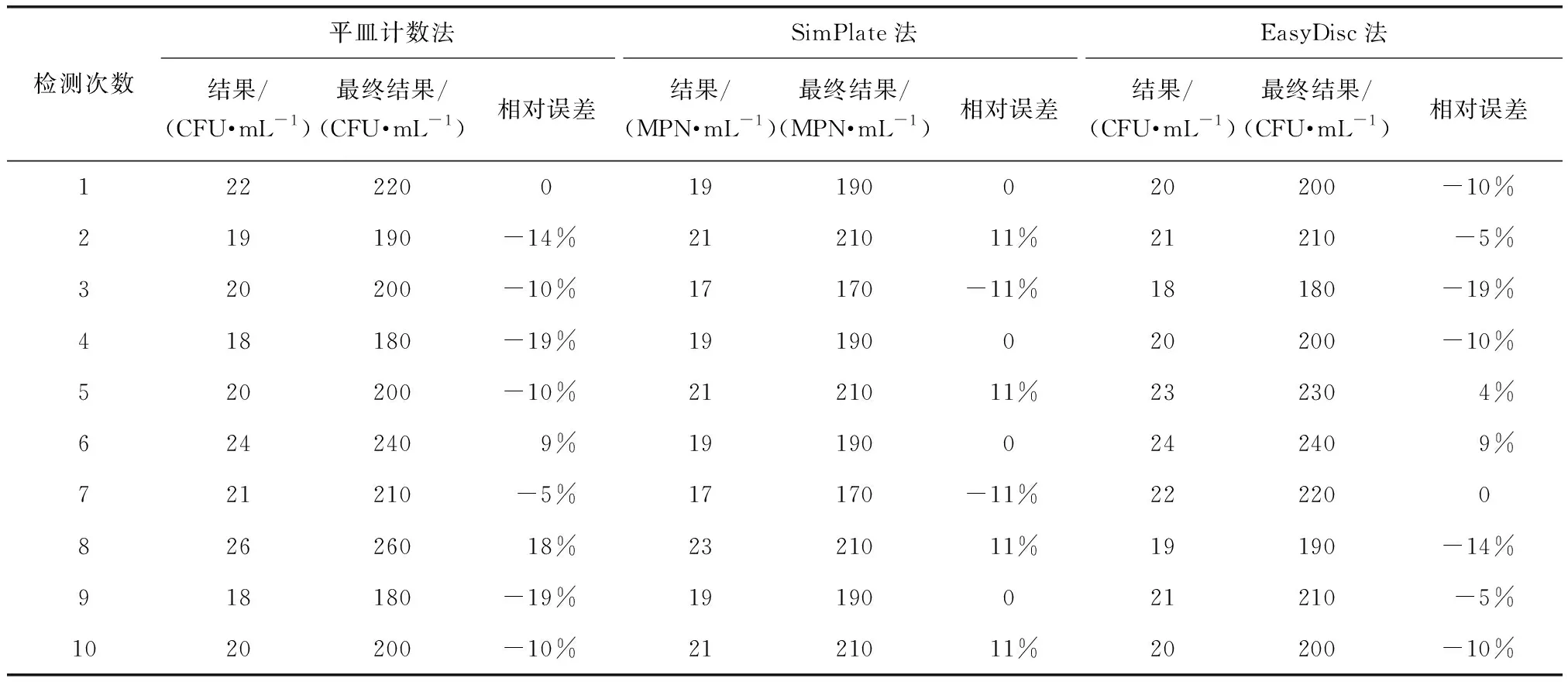
表2 3种方法检测低浓度NSI菌落总数定量质控样品的检测结果Tab.2 Detection Results of Low Concentration NSI Total Number of Colonies QC Samples by Three Methods

图2 3种方法检测低浓度NSI菌落总数定量质控样品检测结果的相对标准偏差Fig.2 Relative Standard Deviation of Low Concentration NSI Total Number of Colonies QC Samples by Three Methods
2.3 实际样品检测结果分析
选取北京地区出厂水、滤池出水及水源水各10组,分别以3种方法检测选取的30组实际样品。其中样品序号21~30为水源水样品,稀释10倍后进行检测,最终检测结果=检测结果×稀释倍数,3种方法的检测结果如表3所示。为进一步探究3种方法在检测实际样品时是否存在差异性,将3种方法检测结果做对数处理满足正态分布后,运用软件SPSS 软件进行t检验分析,结果如表4所示。平皿计数法与SimPlate法、EasyDisc法的泊松相关系数分别为0.945、0.981,属极强相关性;t检验结果分别为P=0.366(>0.05)、P=0.798(>0.05),表明平皿计数法与SimPlate法、EasyDisc法的检测结果高度一致,无统计学差异。可认为3种方法均可有效检测水中菌落总数。
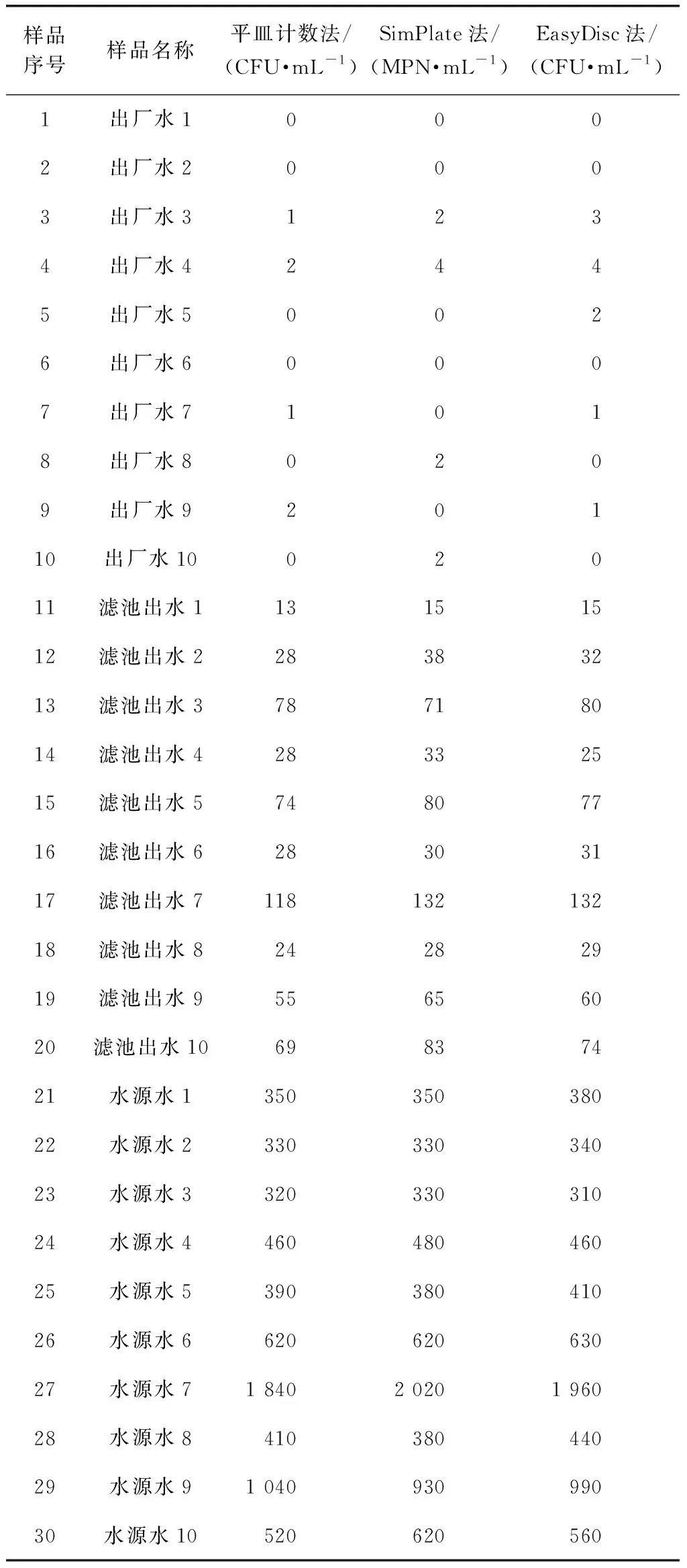
表3 北京地区实际样品的3种方法检测结果Tab.3 Detection Results of Actual Samples in Beijing by Three Methods

表4 3种方法实际样品检测结果的t检验Tab.4 t-Test of Results of Actual Sample by Three Methods
2.4 阴性样品检测结果分析
各选取3组灭菌生理盐水、无菌纯水和无菌缓冲液,在非无菌环境下分别以3种方法进行检测,其检测结果如表5所示。在非无菌环境下,平皿计数法检测阴性样品时部分阴性样品有菌落检出;SimPlate法和EasyDisc法检测阴性样品时所有阴性样品均未检出。由此表明,SimPlate法和EasyDisc法可以在非无菌条件下进行试验,降低了水中菌落总数检测项目对实验室无菌环境的要求。

表5 阴性样品的3种方法检测结果Tab.5 Detection Results of Negative Samples by Three Methods
3 讨论
3.1 NSI菌落总数定量质控样品检测结果分析
检测20组高浓度和低浓度质控样品时,平皿计数法共有12组检测结果相对误差不低于10%,大于SimPlate法及EasyDisc法。造成此类结果的原因是平皿计数法配制培养基的操作步骤(称量、溶解、调节pH、高压灭菌、保存及复溶等)过于繁琐,易引入外来污染,且营养琼脂生成的菌落颜色较浅,不易观察,易造成人为计数误差;而SimPlate法及EasyDisc法无需配制培养基,特制的培养基与细菌代谢产物发生反应,生成易观察的反应产物,减少了外来污染,降低了试验及人为误差。
平皿计数法、SimPlate法及EasyDisc法在检测高浓度和低浓度质控样品时其检测结果与真值相对误差的标准偏差分别为9.27%、5.75%及5.86%和11.64%、8.30%及8.21%。由上述计算结果可知SimPlate法和EasyDisc法检测结果的真值相对误差相较于平皿计数法的真值相对误差更小,表明SimPlate酶底物法和EasyDisc法的检测结果更接近真值,准确度更高,性能更加稳定,更适用于水中菌落总数的检测。
3.2 实际样品及阴性样品检测
对于出厂水、滤池出水及水源水等实际样品,SimPlate法及EasyDisc法与平皿计数法的泊松相关系数分别为0.945和0.981,表明两种检测方法皆与平皿计数法具有极强相关性;同时t检验结果分别为P=0.366(>0.05)、P=0.798(>0.05),也表明SimPlate法及EasyDisc法与平皿计数法的检测结果无统计学差异,均可有效检测水中菌落总数。在非无菌环境下SimPlate法和EasyDisc法检测阴性样品时阴性样品均未检出,表明SimPlate法和EasyDisc法无需在专业无菌室环境操作,既满足实验室对水中菌落总数的检测需求,也降低了实验室维护无菌环境的成本。
3.3 SimPlate法和EasyDisc法优缺点
SimPlate法和EasyDisc法特异性培养基可与细菌发生相关反应,使SimPlate法和EasyDisc法假阴性概率大幅下降。相较于平皿计数法,SimPlate法结果判读方式更简单,不受菌落蔓延等意外因素的影响,适用于水源水的菌落总数检测;而EasyDisc法的47 mm平皿减少占用培养箱空间,适用于大批量样品及应急样品的菌落总数检测。但EasyDisc法计数值是0~300 CFU/mL,不太适宜用于原水检测,当菌落数较大时,容易发生菌落蔓延的情况,SimPlate法的操作步骤相对复杂,不利于大批量使用,且两种方法价格相比平皿法价格较贵。
4 结论
(1)常用检测水中菌落总数的传统平皿计数法具有一定的局限性,如配制培养基操作繁琐、对整体实验室的无菌环境及人员能力要求较高等。而SimPlate法和EasyDisc法无需配制培养基,试验操作过程简便,更适合实验室日常检测。
(2)实验室使用SimPlate法和EasyDisc法检测水中菌落总数,其高浓度与低浓度定量质控样品的检测结果准确性及稳定性均优于传统的平皿计数法,实际样品的检测结果与平皿计数法具有极强相关性,无统计学差异,检测结果准确可靠。
(3)阴性样品的检测结果表明,SimPlate法和EasyDisc法无需在专业的无菌环境下操作,降低了实验室维护无菌室的成本,适用范围更广,满足实验室对水中菌落总数的检测需求。
