硼对豌豆根尖细胞壁组分对铝吸附解吸的影响
2022-11-10冯英明罗功荣玄祖迎李学文麦靖文
冯英明,罗功荣,曲 梅,玄祖迎,李学文,麦靖文,喻 敏*
(1 佛山科学技术学院国际膜生物学与环境研究中心 / 食品科学与工程学院园艺系,广东佛山 528200;2 佛山市林业科学研究所,广东佛山 528000)
酸性土壤占全世界潜在可耕地的50%,而铝毒被普遍认为是酸性土壤上限制作物生产的主要因素之一[1-2]。植物在遭受铝离子胁迫的情况下会导致根尖生长受到抑制,而植物在缺硼条件下也会产生影响根尖生长的类似症状,如植物根系变短、根尖明显膨大等[3-4]。细胞壁是植物防御外界环境胁迫影响的第一道屏障,研究表明,细胞壁是铝的主要结合部位,铝进入根系后大部分都会结合在细胞壁上[5-7]。植物细胞壁的组成成分主要是果胶、纤维素以及半纤维素。其中果胶是以D-半乳糖醛酸为主的一类多聚糖混合物,按照提取方法和性质不同可分为螯合态果胶 (果胶1)和碱溶态果胶 (果胶2)[8],前者与后者相比具有分子量低、甲酯化程度高等特点[9]。半纤维素是位于纤维素和果胶之间的一类含多种糖基的多聚糖混合物,结构复杂,起到连接纤维素和果胶的作用。纤维素则是由葡萄糖组成的大分子多糖混合物,具有化学惰性。研究表明,植物在遭受铝离子胁迫时能够改变植物根尖尤其是伸长区细胞的细胞壁物质组成比例、含量以及细胞壁的结构[10-11]。
大量研究表明,硼能缓解植物中的铝毒,但机制尚需要进一步明确[12-15]。基于硼在植物体内主要是以硼酸盐多糖络合物的形式与细胞壁结合,而细胞壁是铝的主要结合部位,因此细胞壁结构和组成的改变则成为研究的热点。Matoh[16]研究表明,植物细胞壁果胶上2个鼠李半乳糖醛酸聚糖 (RG-Ⅱ)可以和一个硼分子交联形成硼酸糖二聚体 (RG-Ⅱ-B-RGII或dRG-Ⅱ-B),由于RG-Ⅱ是共价地插入到高聚半乳糖醛酸链,因此进一步导致了相互交叉连接而形成的果胶网络结构[17-18]。李梅等[19]研究表明,硼处理后会影响果胶对铝的吸附解吸,推测低浓度硼处理后,硼与果胶结合屏蔽了果胶与铝离子的结合位点,是硼缓解植物铝毒的机制之一;但在相对较高浓度范围内,随着硼酸浓度的升高,果胶对铝的吸附量降低到一定程度后,反而不断增加,且最终超过了不加硼处理的吸附量,因此认为硼酸也可以通过增强果胶吸附铝离子的能力,将铝离子固定在细胞壁上,防止铝离子进入细胞内干扰正常的生理生化反应。但在植物细胞壁中,硼对铝的吸附解吸究竟起着什么样的作用?还需要进一步明确。
因此,为了探究细胞壁组分对铝的吸附解吸特征及硼的影响,基于硼酸和3-硝基苯硼酸 (3-NBA)可以与相邻的两个碳上同侧分别连接着一个羟基的多羟基化合物发生络合 (酯化)反应形成络合物[20],本研究在低硼水平下培养豌豆6天,提取豌豆根尖1 cm细胞壁并分离组分,对细胞壁的果胶1、果胶2、纤维素、半纤维素进行铝的吸附解吸试验,分析各组分对铝吸附解吸能力的差异。同时,分别在pH 3.5和pH 4.5条件下,进行不加硼、加硼酸及3-NBA处理,比较细胞壁各组分对铝离子吸附解吸能力的差异,进一步探究硼缓解植物铝毒的机制。
1 材料与方法
1.1 试验材料
供试豌豆 (Pisum sativum)种子材料为中豌6号种子,通过7.5%的次氯酸钠浸泡30 min后,再用无菌的超纯水清洗5~6次,挑除膨胀、漂浮、软化等不良种子。之后用0.5 mmol/L CaCl2溶液在24℃的黑暗条件下浸泡10 h后转入雾培箱,再用0.5 mmol/L CaCl2雾培40 h (每5 min喷雾30 s)。挑选根长2~3 cm的豌豆在硼 (H3BO3)浓度为 0.6 μmol/L的Hoagland培养液中培养,此时溶液中的含硼浓度既不严重抑制豌豆根的正常生长,又能将细胞壁特别是细胞壁果胶中的硼含量维持在较低水平。水培6天后切取根尖1 cm根段,并放入冰乙醇中进行低温保存。
1.2 试验方法
1.2.1 根尖细胞壁提取和各组分的分离提纯 参考Heim 等[21]、Hoson 等[22]、Brigham 等[23]的方法 (略作修改),提取根尖细胞壁。每个离心管收集约2 g根尖,用液氮研磨至均匀状态后,再用冰乙醇冲洗2次 (冰乙醇每次的用量为每g根鲜重10 mL)。先用20 mL预冷 (4℃)磷酸缓冲液 (0.5 mol/L,pH 7.0)淋洗,之后再离心15 min (4500×g),并重复3次后除去上清液。沉淀用20 mL缓冲溶液进行淋洗2次,用20 mL无菌超纯水淋洗1次 (试剂用量每次均为10 mL/g)后离心。在沉淀中加进20 mL预冷 (-20℃)丙酮,室温条件下进行振荡浸提30 min,离心10 min (4500×g),从而除去脂肪以及叶绿素等物质,淋洗要重复2次。再将沉淀加入20 mL 15 g/L SDS (十二烷基磺酸钠,pH 6.5)在室温下进行振荡浸提30 min,离心10 min (4500×g),从而除去酚类以及蛋白质等物质,淋洗要重复2次。之后用30 mL α-淀粉酶(10 mg/L)去除淀粉多糖 (37℃,3 h)后,并用20 mL的蒸馏水淋洗残余的物质,淋洗要重复2次,沉淀物即是提取的细胞壁,在真空冷冻干燥机中将细胞壁冻干备用。
根尖细胞壁各组分的分离提纯参考Heim等[21]、Hoson等[22]的方法并略作修改。称取60℃下烘干的细胞壁0.1 g,用玛瑙研钵研碎,放入10 mL离心管中,先加入10 mL咪唑溶液 (0.5 mol/L,pH 7.0),25℃的条件下振荡提取24 h后,再离心10 min(10000×g),收集上清液并重复3次,之后合并上清液并量取体积,得到果胶1 (螯合态果胶)。然后向沉淀中加入10 mL Na2CO3溶液 [50 mmol/L,含20 mmol/L 反式-1,2-环已二胺四乙酸 (CDTA)],提取果胶2 (碱溶性果胶),方法与提取果胶1同。去果胶后的细胞壁,在25℃的条件下向沉淀中加入10 mL KOH溶液 (4 mol/L,含0.1% NaBH4)浸提2次 (每次12 h),离心 (10000×g)后的上清液即为半纤维素,用冰乙酸中和至pH 5.0,用分子量为1000 的透析袋进行透析并量取体积。沉淀物继续用8 mL 0.03 mol/L冰乙酸和酒精淋洗,60℃下烘干至恒重,即为纤维素。
1.2.2 细胞壁各组分性质的测定 细胞壁各组分的总糖含量用苯酚硫酸法[24-25]测定。果胶提取液在3 mol/L H2SO4作用下,沸水浴中水解1 h (果胶1提取液0.2 mL,加入2 mL 3 mol/L H2SO4水解;果胶2提取液1 mL,加入2 mL 3 mol/L H2SO4水解,吸取1mL水解液进行测定);半纤维素提取液置于沸水浴中水解1 h (样品水解后吸0.2 mL提取液进行测定),纤维素用72% (w/w)的H2SO4(样品0.1~1 mg/mL) 5℃下消化1 h,用去离子水稀释到10倍体积 (或样品水解后吸0.2 mL提取液进行测定)。将各组分提取液置于25 mL比色管中,加水至2 mL,加入苯酚溶液1 mL,浓H2SO410 mL,沸水浴中放置2 min后冷却至室温,测定吸光度 (485 nm)。以葡萄糖为标准物,制备标准曲线。
采用苯二酚比色法测定果胶的糖醛酸含量[26],并参考Heim等[21]、Hoson等[22]的方法略作修改。取0.2 mL果胶待测液,加入1.2 mL浓H2SO4(含12.5 mmol/L Na2B4O7),迅速放在冰水中。用旋涡混匀器进行混匀,经沸水浴5 min后放入冰水中冷却。然后加入20 μL 0.15%邻苯二酚溶液 (0.5% NaOH溶解),用旋涡混匀器混匀后,放置黑暗处准确反应30 min,测定吸光度 (520 nm)。以D-半乳糖醛酸 (分子量为212.16)为标准物,制备标准曲线。
3-脱氧-D-甘露-2-辛酮糖酸 (KDO)采用硫代巴比妥酸比色法测定[27]。吸取0.2 mL果胶待测液,加入0.1 mL H2SO4(2.1 mol/L),在100℃条件下水解30 min,冷却后离心 (4800×g),吸取0.5 mL上清液放于4 mL的离心管,加入0.25 mL 的高碘酸溶液 (0.04 mol/L),漩涡震荡后,室温下于黑暗处反应20 min,然后加入含2% Na2SO3的0.5 mol/L 盐酸溶液,漩涡震荡后,显棕色,室温下继续加至棕色消失。然后加入0.5 mL 0.6% 硫代巴比妥酸 (TBA)混匀,100℃水浴15 min后,立即加入1 mL的二甲基亚砜 (DMSO),混匀后在室温下冷却,测定吸光度 (548 nm)。以KDO (分子量为255.22)为标准物,制备标准曲线。
果胶甲基酯化度测定:取100 μL的果胶待测液或100 μL的提取液 (不加样品作空白对照),加入50 μL NaOH (1.5 mol/L),25℃ 恒温处理 30 min 后,加入 55 μL H2SO4(0.75 mol/L)。依次加入 200 μL Tris-HCl (200 mmol/L,pH 7.5),80 μL MBTH (3 mg/mL,用水溶解),20 μL 醇氧化酶 (0.01 units/μL,AO),混合物在30℃条件下培养20 min,之后加入400 μL硫酸铁铵和氨基磺酸的混合溶液 (5 mg/mL)。20 min后,在室温条件下加水到2 mL测定吸光度(620 nm)。以甲醛为标准物,制备标准曲线。果胶甲基酯化度 (the degree of methylation,DM)为甲醛浓度与糖醛酸浓度的比值。
1.2.3 pH 3.5与pH 4.5条件下根尖细胞壁各组分对铝的吸附解吸测定 分别吸取5 mL果胶1、果胶2、半纤维素、纤维素溶液 (经测定,4种成分浓度依次为0.475、1.612、4.296、7.556 g/L)于透析袋中,在250 mL 0.5 mmol/L CaCl2溶液中 (pH 3.5/4.5)平衡24 h。
吸附试验:取出透析袋并清洗后,分别浸泡在含有0.5 mmol/L CaCl2,pH 3.5、pH 4.5的200 μmol/L AlCl3溶液中 (250 mL)吸附24 h。取出透析袋,并测定底液铝含量,以计算铝吸附量。
解吸试验:将吸附试验后的透析袋再放入250 mL的0.5 mmol/L CaCl2(pH 3.5/4.5)溶液中,25℃条件下解吸24 h,取出透析袋,测定解吸液的铝浓度,并计算铝的解吸量。
铝含量的测定采用邻苯二酚紫比色法[28],并稍作修改,控制待测液的最终pH在6.1~6.2,并使溶液中Ca2+等的浓度小于0.2 mmol/L,否则将对测定结果产生影响。最终测定步骤如下:取2 mL待测液于10 mL离心管中,加入200 μL 0.0375%邻苯二酚紫显色液后,再加入1.8 mL咪唑缓冲液 (pH 6.2),摇匀,室温条件下显色20 min,测定吸光度 (584 nm)。
1.2.4 pH 3.5条件下不同硼处理对根尖细胞壁各组分对铝的吸附解吸测定 在含0.5 mmol/L CaCl2的吸附解析溶液 (pH 3.5)中,设计无硼、50 μmol/L H3BO3和50 μmol/L 3-NBA 3个处理,分别吸取5 mL果胶1、果胶2、半纤维素和纤维素提取液于透析袋中,加入250 mL上述处理溶液,浸泡 24 h。参照1.2.3中的铝吸附解吸方法进行试验,测定豌豆根尖细胞壁各组分在不同硼处理下对铝的吸附量及解吸量。
1.3 数据处理
试验结果均为3次独立试验的平均值,所得数据用Excel 2020和SAS 9.1进行处理。
2 结果与分析
2.1 细胞壁各组分性质的测定
通过提取和测定豌豆根尖1 cm根段细胞壁各组分的含量发现,豌豆根尖细胞壁中纤维素含量>半纤维素含量>果胶2含量>果胶1含量。其中,纤维素含量占细胞壁的51%,为主要成分;果胶1含量最少,约占4%;果胶2和半纤维素含量分别为细胞壁的 11.5% 和 28.5% (表1)。
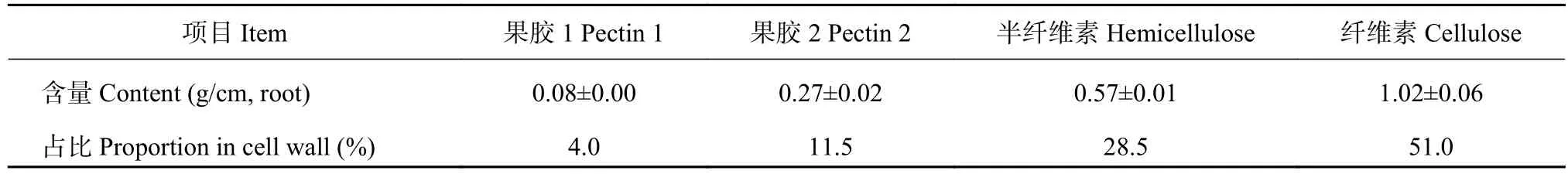
表1 细胞壁各组分含量及其在细胞壁中的占比Table 1 The content and percentage of cell wall components
在硼 (H3BO30.6 μmol/L)水培条件下,根尖提取细胞壁的果胶中,果胶2的糖醛酸和3-脱氧-D-甘露-2-辛酮糖酸 (KDO)含量均比果胶1高,前者高3.39倍,KDO含量高6.6倍,但果胶2和果胶1的甲基脂化度数值差异较小 (表2)。
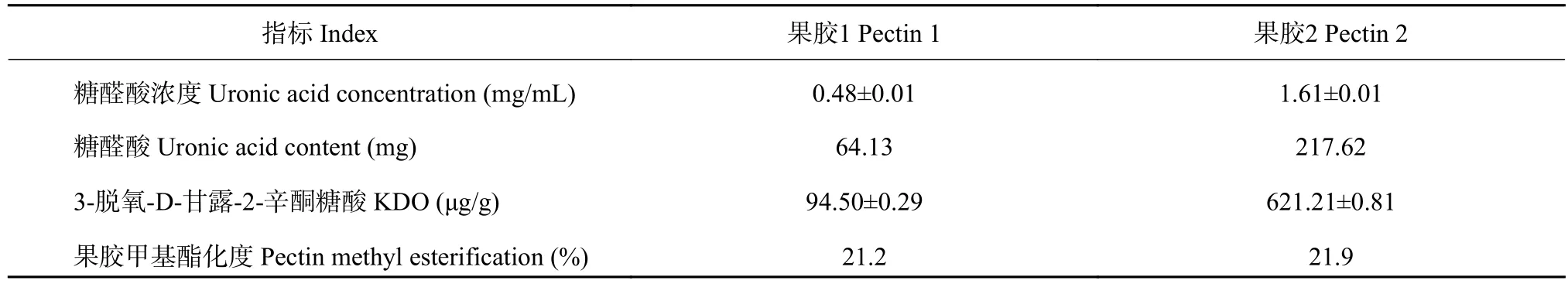
表2 低硼培养6天的豌豆根系中提取的果胶性质Table 2 Properties of pectin extracted from pea after 6 days of low B treatment
2.2 pH 3.5与pH 4.5条件下根尖细胞壁各组分对铝的吸附解吸
从表3可知,在pH 3.5和pH 4.5条件下,细胞壁各组分对铝的吸附量大小为:果胶2>果胶1>半纤维素>纤维素,各组分间的吸附量差异均达到显著水平。果胶尤其是果胶2对铝的吸附起主要作用,表明果胶为细胞壁上铝的吸附位点。
在pH 3.5和pH 4.5条件下,细胞壁组分对铝的解吸率差异显著,以果胶1最高,果胶2最低。pH 4.5条件下,果胶1和果胶2对铝的解吸量与其它组分差异显著,但半纤维素与纤维素对铝的解吸量差异不显著。pH 3.5条件下,不同细胞壁组分对铝的解吸量均呈现显著差异。在pH 3.5条件下,细胞壁各组分单位质量铝吸附量的差异均显著。pH 4.5条件下,果胶1和果胶2与其它组分对铝的单位质量吸附量差异显著,但半纤维素与纤维素之间没有达到显著差异。pH 3.5和pH 4.5条件下,果胶1和果胶2与其它组分对铝的单位质量解吸量的差异均达到显著,但半纤维素与纤维素之间没有达到显著差异。对铝的单位质量解吸量表现为:果胶1>果胶2>半纤维素和纤维素。
在pH 3.5条件下,解吸率由高到低依次为:果胶1>半纤维素>纤维素>果胶2;而pH 4.5时,解吸率由高到低依次为:果胶1>纤维素>半纤维素>果胶2。不同细胞壁组分对铝的吸附解吸存在明显差异(表3)。

表3 pH 3.5和pH 4.5条件下细胞壁组分对铝的吸附解吸量Table 3 The adsorption and desorption of aluminum by cell wall components under different pH
2.3 pH 3.5条件下硼处理根尖细胞壁各组分对铝的吸附解吸
在加硼酸和加3-硝基苯硼酸 (3-NBA)处理下,单位质量铝吸附量最高的均为果胶2,且显著高于吸附量排在其次的果胶1,加硼酸处理中果胶2的单位质量铝吸附量高达99.92 μg/mg,半纤维素和纤维素吸附量很少;果胶1的单位质量铝吸附量也显著高于半纤维素和纤维素,且加硼酸处理最高。
在CK和3-NBA处理条件下,铝解吸率最高均为果胶1,且与其它细胞壁组分的差异显著。加硼组处理铝解吸率最高的是纤维素,但与果胶1和半纤维素间的差异均未达到显著。3组处理中果胶2的解吸率均显著低于其他3种细胞壁组分 (表4)。
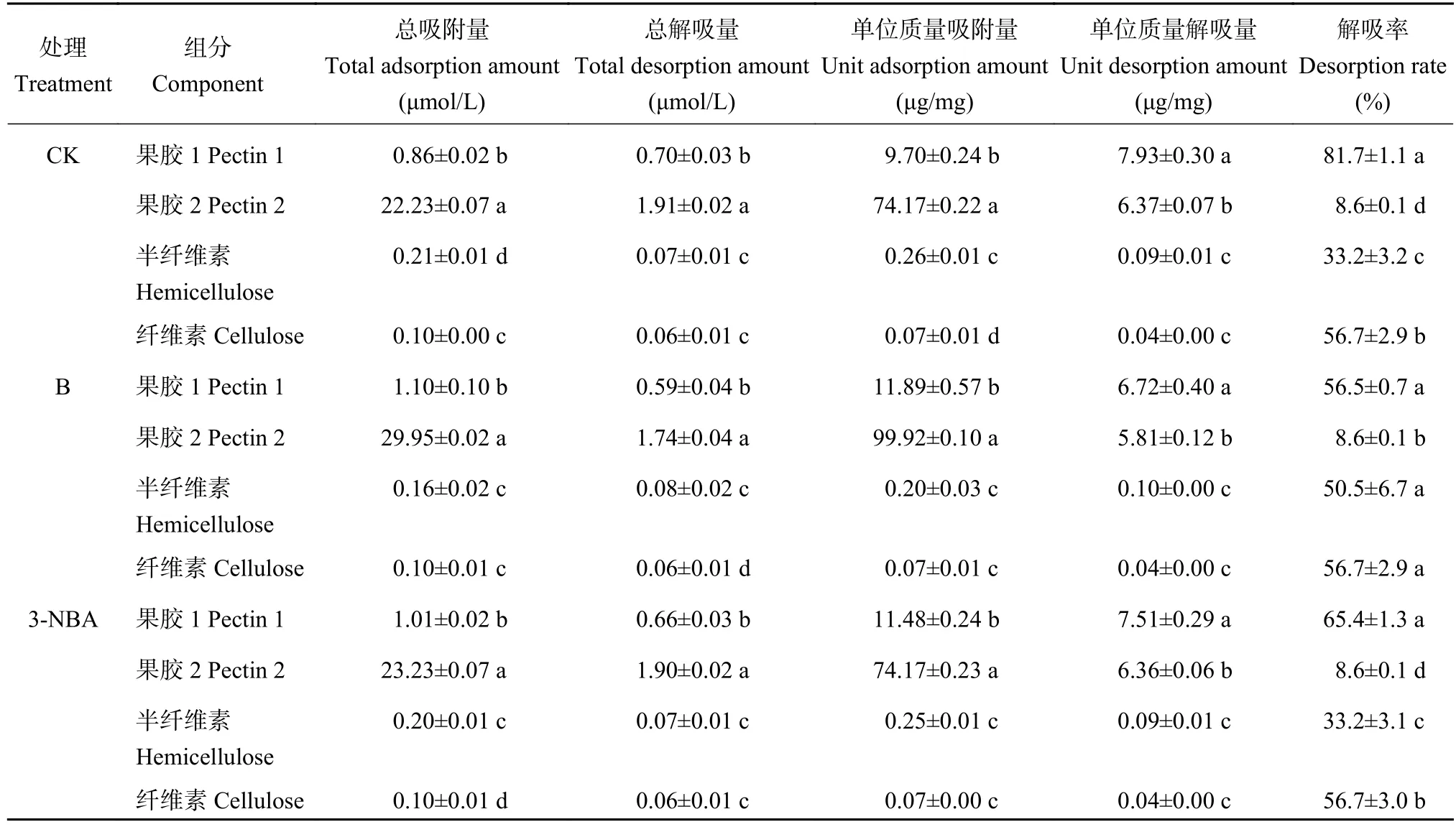
表4 不同处理下细胞壁组分对铝的吸附解吸Table 4 Adsorption and desorption of aluminum by cell wall component under different boron treatments
如图1所示,与对照相比,硼酸和3-NBA处理能显著提高果胶1对铝的单位质量吸附量。硼酸能显著提高果胶2对铝的单位质量吸附量。硼酸处理使果胶1对铝的单位质量吸附量提高了22.6%,使果胶2对铝的单位质量吸附量提高了34.7%。3-NBA处理使果胶1对铝的吸附量提高了17.4%,果胶2对铝的吸附量提高了4.5%。硼酸比3-NBA处理更能显著提高果胶对铝的单位质量吸附量。硼酸处理后果胶2相比果胶1铝的吸附能力增强明显。
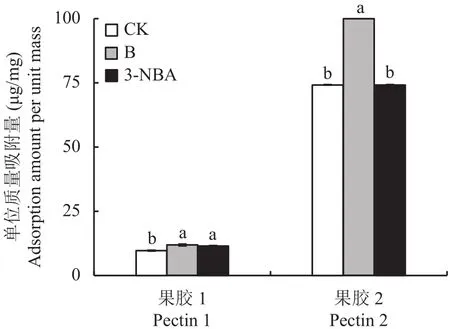
图1 不同硼处理下果胶的铝单位质量吸附量Fig.1 Aluminum adsorption per unit of pectin under different B treatments
如图2所示,与对照相比,硼酸和3-NBA处理均能显著降低果胶1的解吸率;对果胶2的解吸率则无显著影响;硼酸能显著提高半纤维素解吸率,3-NBA则无显著影响;硼酸和3-NBA对纤维素的解吸率几乎没有影响。
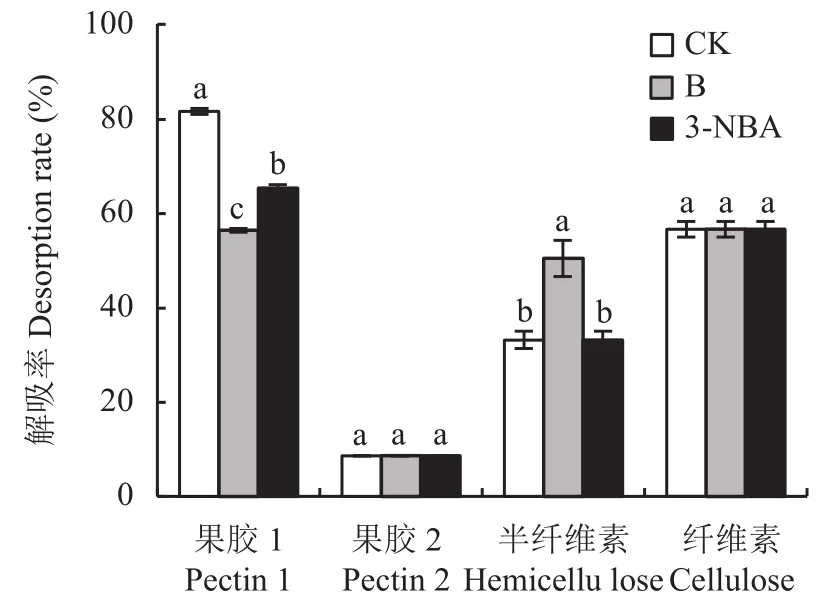
图2 不同硼处理下细胞壁各组分对铝的解吸率Fig.2 Aluminum desorption rate of each cell wall component under different B treatments
3 讨论
3.1 细胞壁各组分对铝吸附解吸的差异
从以上吸附和解吸试验结果可以看出,细胞壁各组分均能在一定程度上吸附铝,但细胞壁组分中果胶吸附铝的含量远高于半纤维素和纤维素,并且果胶2吸附铝的含量高于果胶1。植物细胞壁吸附铝的能力不仅取决于细胞壁果胶水平,还与细胞壁纤维素和半纤维素的多糖含量有着密切的关系[29]。果胶2的解吸率低于其他3种组分,与其他3种组分的差异均达到显著。综合对铝的吸附量和对铝的解吸率表明,铝主要积累在细胞壁的果胶上,特别是累积在果胶2上。这与其他学者发现的铝与细胞壁的结合是植物根系对铝毒胁迫响应的重要原因[30-31]相一致,本试验也进一步表明铝主要是与细胞壁果胶2结合。
3.2 不同pH条件下细胞壁各组分对铝的吸附解吸
pH 3.5条件下比pH 4.5条件下吸附铝的总量更多,高出52.6%,可能与不同pH下不同组分吸附铝的能力差异有关,pH 3.5较pH 4.5溶液中H+浓度高,可能促使部分与果胶结合较弱的阳离子解析,使果胶对铝的吸附增强,尤其是果胶2占细胞壁对铝吸附量的绝大部分。根系细胞壁对铝的吸附能力,主要取决于果胶中带负电荷的游离羧基的多少,这不仅与果胶含量相关,还与果胶的甲基酯化程度相关,当果胶甲基酯化程度较低时常含有较多的游离羧基[32]。
3.3 不同硼处理条件下细胞壁各组分对铝的吸附解吸量
不同硼处理均能提高果胶1和果胶2对铝的吸附量和单位质量吸附量。果胶2对铝单位质量吸附量的增加量大于果胶1的,而解吸率却远远低于果胶1,这与果胶3-脱氧-D-甘露-2-辛酮糖酸 (KDO)值有关。鼠李半乳糖醛酸聚糖-II (RG-II)是一类结构复杂的果胶多糖,普遍存在于高等植物初生细胞壁中,是由12种不同的糖基以不同的糖苷键连接形成[33]。一般每条单链RG-II中含有1个KDO和2个芹菜糖残基,其中芹菜糖被认为是硼与RG-II的结合位点,一般认为硼与果胶的结合量与果胶KDO的含量呈正相关。通过测定发现,果胶2的KDO值显著高于果胶1,因此在相同果胶质量条件下,硼与果胶2的结合量高于果胶1。由于硼与果胶结合使果胶中负电荷增加,铝容易结合在这些基团所带的负电荷上[34],从而使果胶的吸附量增加。硼处理后导致果胶1和果胶2的解吸量下降,可能由于硼处理后果胶1和果胶2吸附铝的能力更强,使Al3+不易从果胶上解离出来。
硼处理会降低半纤维素对铝的吸附量而提高其对铝的解吸量,表明硼酸可能与半纤维素发生络合反应[35]。由于半纤维素的成分复杂,可能也存在能与硼酸发生络合反应的糖基,且猜测硼处理使半纤维素对铝的吸附量降低而对铝的解吸量上升的原因,是类似于较低浓度硼酸处理果胶时,硼酸与果胶络合,屏蔽了与Al3+的结合位点,硼酸与半纤维素的结合也可能由于屏蔽了半纤维化与Al3+的结合位点,使半纤维素对铝的吸附量降低及对铝的解吸量上升[19]。
硼处理后纤维素对铝的吸附量及对铝的解吸量与对照没有显著差异,是因为纤维素不存在相连的两个碳原子上各连着一个羟基的结构,所以不能与硼酸发生络合反应。
3.4 硼酸与3-硝基苯硼酸 (3-NBA)处理对果胶铝吸附解吸影响的差异
相比3-NBA,硼酸能更有效的提高果胶1和果胶2对铝的吸附量和单位质量吸附量,更有效的降低果胶1和果胶2对铝的解吸量和单位质量解吸量,这表明硼酸在缓解植物铝毒方面比3-NBA更有效。
硼处理条件下,果胶1、果胶2和半纤维素对铝的吸附量和解吸量有显著影响,尤其硼处理后果胶2对铝吸附量的增加量远远高于果胶1和半纤维素,这表明果胶2是硼处理后使细胞壁对铝的吸附量和解吸量产生显著差异的主要原因。
在硼处理后,与对照比果胶2显著提高对铝的吸附量并降低对铝的解吸量,把铝固定在细胞壁的果胶2上,是硼酸缓解铝毒的重要机制之一。也可能存在其他的耐铝毒机制,有待继续研究。
4 结论
豌豆根尖细胞壁果胶2是根尖细胞壁主要的铝结合位点,硼与果胶2的结合可能是硼缓解铝毒的重要机制之一。具体表现为:1)豌豆根尖细胞壁各组分含量为:纤维素>半纤维素>果胶2>果胶1;2)硼能够与果胶1和果胶2发生络合反应,与半纤维素也可能发生络合反应,从而影响果胶1、果胶2和半纤维素对铝的吸附解吸;3)在铝胁迫下,根尖细胞壁中的果胶是主要的铝结合位点,尤其是果胶2结合最多;4)硼处理后显著影响并提高果胶2对铝的吸附量,但解吸量变化不显著,因此将铝固定在细胞壁的果胶2内,可能是硼酸缓解铝毒的重要机制之一;5) pH 3.5条件下,硼酸与3-硝基苯硼酸 (3-NBA)处理相比,更能有效地影响果胶对铝的吸附解吸。
