丛枝菌根真菌AMF提高植物抗逆性的组学技术研究进展
2022-11-10胡海玲马钰雯耿赫阳陈晓璇石聪聪王英男王竞红蔺吉祥
胡海玲,马钰雯,耿赫阳,陈晓璇,石聪聪,王英男,王竞红,蔺吉祥
(东北林业大学园林学院, 黑龙江哈尔滨 150040)
非生物胁迫是农业生产力下降的主要限制因素之一。根据2007年世界粮农组织的报告,全球只有约3.5%的土地没有受到任何环境制约的影响[1]。干旱、极端温度、重金属和土壤盐碱化等非生物胁迫都会限制植物的生长和最终生产力,植物也会通过在生理生化、分子细胞水平发生适应性变化来适应不利的生存环境。在全球范围内,由各种非生物胁迫引起的农业损失导致了作物生产力的大幅度下降[2]。因此,非生物胁迫已经成为制约植物生长发育、影响产量和质量的关键因素。
为了适应外界不断变化的自然环境,植物在长期自然选择和进化过程中形成了一套完整的抗逆体系。其中,植物与丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)的共生就是一种十分有效的策略。AMF是陆地生态系统中分布最为广泛的一类真菌,可以和80%以上的陆生植物建立互利共生体,提高植物对养分的吸收、转运和利用能力以及自身的耐逆性[3]。由于AMF属于专性活体营养的植物共生真菌,所以需要消耗植物光合产物来为其菌丝生长和孢子发育提供能量,以完成其生活史[4]。此外,AMF发达的根外菌丝可以深入到植物根系无法到达的土壤颗粒缝隙,并通过其扩展的菌丝网络来改善宿主植物对水分和矿物质养分的吸收[5],提高植物对非生物胁迫的抗性[6]。目前,关于AMF如何提高宿主植物适应外界逆境的深入机制还不太明确。作为一种绿色、健康、经济、高效提高植物抗逆性的新策略,AMF在保护环境及发展可持续农业方面的潜力不可忽视[3]。
之前对植物-微生物互作领域的研究清晰地表明,微生物共生在很大程度上直接影响植物对逆境胁迫的反应[7]。如AMF可以利用一系列生化和生理机制协同作用,为寄主植物提供更强的耐盐性[1]、耐旱性[8]等。为了深入研究植物表型或功能发生变化的机理,需要从诸多的生物大分子中筛选出相关联的或发挥重要作用的基因、蛋白质和代谢物等,这些生理和分子水平的变化就涉及到组学(omics)技术的应用。组学技术包括基因组学(genomics)、转录组学(transcriptomics)、蛋白质组学(proteomics)、代谢组学(metabolomics)、表型组学(phenomics)、微生物组学(microbiomics)等。组学技术可以揭示生命活动的规律,促进对复杂生物体的整体认识。得益于日趋发展的测序技术,以高通量、大规模、高灵敏度为特点的数据分析统计方法和组学技术的联合开始大量应用于植物胁迫应答的综合分析[9]。由于AMF的专性生物营养特性和复杂的遗传学机制[10],现有关于AMF提高植物抗逆性的研究多集中在生理生化方面,所涉及的分子基础尚不清楚。为了剖析更深层次的相互作用机制,并将分子水平的变化与对胁迫的耐受反应联系起来,形成了基于多组学方法的生物学数据[11]。其中转录组学、蛋白质组学、代谢组学是最常用的3种组学技术,它们有助于人们分别从转录水平、翻译水平、代谢水平上了解AMF提高植物应答非生物胁迫的机理。基于此,本文介绍了这3种组学在AMF提高植物应答非生物胁迫中的研究进展。
1 转录组学在AMF提高植物抗逆性领域的应用
转录组学是一门在整体水平上研究细胞中基因转录情况及转录调控规律的学科[12]。由于转录组的表达具有动态性,因此可以用来比较某一组织在不同生理条件以及不同状态下基因表达的差异。目前,转录组学被广泛应用于挖掘差异基因并分析、鉴定差异表达的基因及其功能。此外,分子生物学的快速发展推动了转录组学技术的进步,分子测序技术经历了第一代到第三代的发展,取得了长足进步,其通量和准确性也在不断提高。
目前常用的测序技术包括短读长测序、长读长测序和直接测序。其中短读长测序适合做基因定量,研究差异基因表达;长读长测序适合研究转录本结构信息,如异构体、可变剪切、基因融合等;RNA直接测序可以研究转录本结构信息和修饰信息,但是对RNA样本要求更高[13]。这3种测序技术的方法及优缺点决定了其在不同研究领域的应用。因此需要在了解各转录组测序技术特点的基础上进行选择[14]。表1为3种主要测序技术的比较。

表1 3种测序技术的比较[13]Table 1 Comparison of three sequencing technologies
利用转录组学可以比较在胁迫条件下接种AMF后植物不同组织或不同生理条件下基因水平的表达差异,从而研究生理功能相关的基因,最终揭示其机体和细胞应答的分子机制。AMF侵染植物后可以形成根外菌丝,从而诱导根长与根形态变化,进而提高菌根植物的水势[15]、水的利用效率(WUE)[16]以及植物体内的相对含水量(RWC),提高菌根植物的耐旱性。刘婷[17]对干旱条件下的杨树进行转录组分析发现,接种AMF的杨树(Populus)叶片水孔蛋白PIP家族基因PIP1-1、PIP1-2、PIP1-3、PIP1-4、PIP1-5和PIP2-3表达量分别上调了1.10、0.39、2.43、1.69、9.68和1.99倍;PIP2-1和PIP2-2表达量分别下调了0.42和0.27倍,且干旱条件下菌根植物的水分状况明显好于非菌根植物,其相对含水量和水分利用效率分别比非菌根植物高出10.2%和19.3%。AMF提高水的利用效率的原因可能是光合调节或提高脯氨酸的积累,降低了根部的水势,从而促进植物对水的吸收,提高植物的抗旱性[8]。例如,有研究利用qRT-PCR分析苹果(Malus×domestica)在干旱胁迫下接种与未接种AMF处理基因转录水平上的表达变化,发现在干旱胁迫下,接种AMF后苹果幼苗中脯氨酸合成关键酶基因(P5CS)的表达量增加了65.15%,水通道蛋白相关的胁迫响应基因(PIP1-3和PIP1-4)的表达量分别增加了103.67%和93.13%[18]。这表明在干旱条件下,AMF能够通过调控植物水孔蛋白基因表达来改善植物的水分状况,从而提高植物的耐旱性。
盐碱胁迫可以通过影响植物的营养生长和净同化率来抑制植物的生长[19],从而导致植物生物量下降。在盐胁迫条件下,植物根际Na+浓度升高会抑制对Ca2+的吸收,从而导致植物体内Ca2+/Na+值下降,最终导致植物导水性变差、细胞膨压下降、干扰Ca2+信号转导[5]。而在盐胁迫下,菌根植物会通过提高Ca2+吸收,以保持体内适合的Ca2+/Na+值。吴娜[20]通过对盐胁迫下接种AMF的青杨(Populus cathayana)进行转录组测序,发现AMF可以通过调节青杨根部PcSOS1和PcSOS3基因的相对表达量进而影响宿主植物根系细胞的Na+/H+逆向转运蛋白活性和内部离子流稳态,促进青杨根系对K+和Ca2+的吸收,降低对Na+的运输,增加雌株和雄株根部K+/Na+(6.99%和11.43%)和Ca2+/Na+(25.08%和36.79%),进而提高了青杨的耐盐性。也有研究对盐胁迫下接种AMF的水稻(Oryza sativa)进行转录组分析,发现盐胁迫下菌根共生体上调了OsSOS1、OsNHX3、OsHKT2;1和OsHKT1;5的表达,接种AMF的植株中Na+由根系向地上部分的分配低于未接种植株[21]。上述结果说明,AMF可通过增加盐胁迫下宿主植物对营养元素的吸收,并通过调控膜转运蛋白编码基因的表达来减少Na+的吸收和向地上部分的转运,促进宿主植物的离子平衡,提高宿主植物的耐盐性。盐胁迫还会造成植物生理干旱,影响植物吸水。植物吸收水分依赖于水孔蛋白(PIP),而AMF能调控植物水孔蛋白基因的表达[22]。Aroca等[23]发现 AMF可以上调植物根部的PIP1;1,PIP1;3和PIP2;1的表达量。但是Ouziad等[24]发现盐胁迫下,接种AMF的番茄中PIP1的表达量被下调。此外,张新璐[25]分析了AMF提高刺槐(Robinia pseudoacacia)耐盐胁迫的转录调控机制,发现ERF/AP2、WRKY、bHLH和MYB等转录因子可以调控刺槐根系对盐胁迫的适应性:与盐胁迫下未接种AMF的刺槐根系相比,接种AMF后有2970个差异基因上调表达,371个基因下调表达,这些差异基因主要参与了生物调节、刺激应答、转运等过程和氧化磷酸化、蛋白质加工等信号通路。
环境污染造成很多地区土壤中的重金属离子浓度超标,而重金属离子在土壤中过度积累会破坏土壤性质和微生物多样性,导致植物毒性、细胞损伤和生物量下降等[26],是制约植物生长发育的环境因素之一。接种AMF能够调控植物根系中与吸收有害元素相关的离子转运蛋白的合成,并通过降低重金属的生物富集因子和转运系数,从而抑制有害元素自土壤/根系向植物地上部的转运,降低了植物地上部与土壤/根系有害元素含量的比值,最终缓解植物对重金属胁迫的应激反应,提高植物的耐受性[27]。孙晨瑜[28]利用RNA-Seq 分析发现,在硒胁迫下,AMF共生显著下调了玉米根系吸收硒相关离子转运蛋白基因ZmPht2、ZmNIP2;1和ZmSultr1;3的表达,并且玉米地上部硒含量降低了20.80%~52.80%,根部硒含量降低了12.3%~36.8%。另外,有研究发现在砷胁迫下,与未接种AMF的对照组相比,接种AMF的蒺藜苜蓿(Medicago truncatula)下调了其根系皮层细胞膜中MtPht1;1和MtPht1;2基因的表达,并降低了地上部和根部的砷浓度[29]。这些研究表明了AMF与植物形成共生后能够降低植物体内的重金属含量,从而提高植物的耐受性。
以上研究表明,转录组学分析可以揭示在不同外界环境因子下AMF对植物关键基因表达的影响。从转录水平揭示逆境胁迫下整个基因组水平的表达情况,对增加胁迫适应和耐受相关的复杂调控网的理解、进行逆境基因组转录调控网络的构建具有重大的意义[30]。
2 蛋白质组学在AMF提高植物抗逆性领域的应用
蛋白质组学是以蛋白质组为研究对象,将基因组序列信息和在特定组织、细胞或细胞器中执行生命功能的蛋白质有机地联系起来,全面检测表达的蛋白质及在不同发育阶段、不同条件下表达的差异[31]。蛋白质组学研究技术主要有技术体系和生物信息体系两方面的内容[32]。技术体系中目前最常见的技术有MALDI TOF/TOF技术与 LC-MS/MS 技术、iTRAQ/TMT、SILAC、Label free、2D/DIGE[33]。其中iTRAQ/TMT (同位素相对定量和绝对定量)是一种强大的质谱技术,可以定量比较蛋白质丰度,因此应用比较广泛。iTRAQ/TMT具体的工作流程如图1所示。
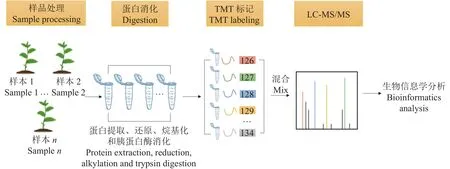
图1 iTRAQ/TMT工作流程图Fig.1 iTRAQ /TMT workflow chart
在应对非生物胁迫方面,蛋白质的合成和积累是植物的中心策略,蛋白质的数量和质量的变化比mRNA转录水平的变化更直接地反映了调控机制[34]。利用蛋白质组学技术对接种AMF后植物面临胁迫时其体内的蛋白表达和差异变化进行定性和定量研究,从而获得AMF对植物应答逆境时抗逆蛋白变化的影响,有利于解析AMF提高植物抗逆的生理生化和分子信号应答机制。例如,Gui等[35]采用ITRAQ蛋白质组学方法发现,与未接种AMF的蓝莓(Vaccinium corymbosum)相比,接种AMF的植株在干旱胁迫下保持了更高丰度的蛋白质,这些蛋白质参与了氨基酸代谢、抗氧化系统、信号转导和光合作用(包括光合作用生物体内的固碳、卟啉和叶绿素代谢以及类胡萝卜素的生物合成)。吴洁婷[36]利用iTRAQ及液相串联质谱(LC-MS/MS)技术分析发现,铜胁迫下接种AMF的芦苇(Phragmites australis)根系产生了459个差异蛋白,其中表达上调 200个,表达下调 259个,这些蛋白主要涉及呼吸链能量传递、营养元素主动运输及异常蛋白的修复及降解。此外,Wang 等[37]利用iTRAQ技术发现,与碱性胁迫下未接种AMF 的星星草(Puccinellia tenuiflora)相比,接种AMF后的星星草幼苗中共有598种蛋白质受到显著差异调节。以上研究结果表明,AMF接种可以显著提高蛋白质合成、活性氧清除和氮代谢,促进碱性胁迫下渗透物质的生物合成。
盐胁迫下,接种AMF的植物蛋白积累和代谢也有相关报道。常伟[3]应用非标记定量蛋白质组学(Label-free)技术对不同盐处理下的沙枣(Elaeagnus angustifolia)苗木根系进行蛋白质组测定,共发现241个菌根耐盐胁迫差异丰度共生蛋白,主要参与到细胞膜、脂代谢过程、单组织代谢过程、转移酶活性、催化活性等生物学功能,其中35个菌根耐盐胁迫差异丰度共生蛋白广泛参与了代谢、遗传信息处理、环境信息处理、细胞进程等6个代谢通路。陈计芳[38]利用双向电泳(2D-PAGE)、质谱(MS)以及生物信息学分析,比较了同一盐浓度胁迫下接种AMF和不接种AMF的小麦(Triticum aestivum)叶片蛋白质组的差异,共成功鉴定了12个蛋白点,这些蛋白的功能涉及到光合作用(占比62%)、糖代谢(占比12%)、能量代谢(占24%)及未知功能蛋白等方面;并发现未接种AMF的植物相关蛋白点呈下调表达趋势,而接种AMF的小麦中相关蛋白呈上调表达趋势,这说明接种AMF能够恢复这些蛋白的表达,并通过增强呼吸能量代谢或光合作用相关的酶蛋白来抵御和修复盐胁迫对其产生的伤害。
以上研究说明在蛋白质水平上研究逆境胁迫下植物基因的表达调控机制,有助于详细了解胁迫因子的伤害机制以及植物的适应机制,深入地揭示生命现象的本质,从而可以更为直接地找到与逆境相关的基因群,进而解释遗传和环境是如何通过相互作用控制细胞的功能,为进一步揭示植物响应胁迫机理提供新的认识[39]。
3 代谢组学在AMF提高植物抗逆性领域的应用
代谢组学(metabolomics)是一门旨在对生物体、组织或细胞特定时期下的全部小分子代谢产物进行定性和定量分析的新学科[40]。由于代谢组学的研究结果更接近生物的表型,所以代谢组学技术可以作为一种桥梁将基因型和表型联系在一起,形成“突变-基因-调控-表达-代谢-表型”的关系网络[41]。目前,代谢产物的分离鉴定技术主要有液相色谱(LC)、气相色谱(GC)、质谱联用、毛细管电泳(CE)、核磁共振(NMR)、毛细管电谱质谱联用等。由于每种技术都有其优势和不足,因此,在实际应用中往往将几种技术联合使用。常见的方法有核磁共振、气相色谱-质谱联用、液相色谱-质谱联用,其使用范围和优缺点如表2所示。

表2 常用的代谢组学技术的比较Table 2 Comparison of commonly used metabolomics techniques
植物代谢组学的发展促进了人们对代谢产物所在通路的认识,从而更好地理解代谢产物所在代谢途径中的底物、中间产物、最终产物和关键酶的变化,并阐明该途径中的调节机制[46]。已有大量研究表明,在胁迫条件下接种AMF可以通过改变宿主植物的相关次级代谢产物水平,从而增强植物抵御外界胁迫的能力。例如,有研究发现在低温胁迫下,对黄瓜(Cucumis sativus)接种AMF可以提高木质素、酚类、黄酮类等参与植物抗氧化系统、次级代谢酶活力等过程的中间代谢产物水平,从而提高黄瓜对冷害的耐受力[47]。这说明接种AMF可以通过影响胁迫下植物初级和次级代谢产物的水平以及根系非酶抗氧化剂的水平,从而提高植物对非生物胁迫的抗性。此外,Begum[48]还发现,接种AMF可显著提高烟草(Nicotiana tabacumL.)体内的酚类和黄酮含量及植株精油的含量和组成成分,皮脂原酶(LOX)和苯丙氨酸氨解酶(PAL)含量分别增加90%和125%,从而显著减轻干旱胁迫产生的氧化伤害。这说明接种 AMF 改善了烟草植株的次生代谢,从而增强了植物在防御干旱胁迫中的作用。而Dai等[49]利用代谢组学发现,干旱胁迫下丹参的代谢产物发生了变化,干旱胁迫下调了脯氨酸和丹参酮的含量,同时也改变了氨基酸、糖类以及多元醇类的代谢产物积累量,并且还发现因光照引起的干旱会促进莽草酸参与的多酚类的合成,而因空气干燥引起的干旱会抑制该代谢通路。
AMF还可以通过影响植物体内氨基酸与可溶性糖等渗透调节物质的含量与组成,来帮助宿主进行渗透调节,从而抵御非生物胁迫。张良[50]通过LCMS分析盐胁迫下星星草在接种AMF后最相关代谢产物的种类以及变化,发现该菌种能够明显提升星星草体内氨基酸和胺、碳水化合物和多元醇以及无机酸和有机酸这3大类代谢产物的含量,其中变化最明显的相关代谢产物包括氢吗啡酮上调21.38倍、乙基吗啡上调20.02倍、槲皮素31-甲基醚上调16.67倍和芹菜素7-0-新橙皮苷下调12.5倍,这些明显变化的代谢产物参与TCA的循环、氮元素代谢时所需ATP的合成以及细胞渗透平衡的维持,增强碱胁迫下星星草的耐碱能力。此外,还有研究使用液相色谱结合飞行时间质谱(LC/TOF-MS)对碱胁迫下接种或未接种AMF的星星草幼苗中的代谢物谱进行了分析,发现AMF接种显著提高了碱胁迫下氨基酸、有机酸、类黄酮和甾醇的含量,改善了渗透调节,维持了细胞膜的稳定性[51]。
以上研究结果表明,可以利用代谢组学技术对接种AMF的植物应答逆境胁迫时的代谢物变化进行定性和定量分析,从而揭示AMF提高植物抗逆性的分子机制。
4 总结与展望
转录组学、蛋白质组学和代谢组学的研究对象分别是mRNA、蛋白质和代谢产物,它们之间既有区别,又相互联系,是一个有机的整体。目前,对于丛枝菌根真菌诱导植物抗性的具体机制,还尚不明确。随着生物技术的不断发展,应用转录组学、蛋白质组学及代谢组学等测序技术,获得了接种和不接种AMF植株之间差异表达的基因、蛋白质以及代谢物。深入研究组学分析中所揭示的基因、蛋白质、代谢物质在植物不同组织中的功能,挖掘和鉴定植物在逆境条件下执行重要生理功能的重要调控途径及特异功能蛋白、关键基因以及代谢物等,可加深对AMF 提高植物抗逆性机制的了解。
采样时间、部位以及个体差异都会干扰转录组、蛋白组和代谢组测序后所获得的信息和表达,环境、生理状态以及操作方式等外界因素也会影响植物的生理代谢水平。因此,选择能准确表征某一状态的样本,保证研究体系的均一性,是准确评价植物生长的前提。这些方法包括选择均一的种子,标准化的AMF接种流程,胁迫环境(因子)的严格控制等。
在自然环境中生长的植物通常处在复合逆境中,多种胁迫可能存在交叉互作,且植物与逆境胁迫的互作是一个复杂的过程。因此,单一组学的应用限制了信息表达的完整性和深层次网络调控机理的精确性。随着测序技术和手段在速度、精度等方面的提高以及生物信息学的更新发展,单一组学的应用已经不能满足人们的需求,为了打破单一组学研究的瓶颈,AMF提高植物抗逆性组学的研究将朝着多组学结合的方向发展。将转录组学、蛋白质组学、代谢组学等各相关学科联合起来,不断深化各组学技术间的融合,实现各种数据的互补,使研究者能更加全面、整体地从不同层面研究植物所出现的基因转录、表达、翻译、修饰以及生理代谢等问题,从多角度全面探究植物相关研究的分子机理,这有助于更全面地理解植物相关生命活动的分子调控规律。
随着科学技术的发展以及植物学研究的不断深入,组学技术将会在AMF提高植物应答胁迫研究领域发挥更大的作用。
