南宁市石漠化地区山羊无浆体感染情况调查
2022-11-10周庆安杨铭芬梁勇俊
何 丹,周庆安,杨铭芬,梁勇俊,张 兵*
(1.南宁市动物疫病预防控制中心,广西 南宁 530001; 2.广西壮族自治区动物疫病预防控制中心,广西 南宁 530001)
0 引言
在很多动物中,都会出现无浆体病。该病会严重危害动物的健康状况,甚至导致动物的死亡[1]。因此,无浆体感染的危害极大。对于广大养殖户而言,需要高度重视这一疾病,以避免动物死亡所致的经济损失。
1 无浆体病原学概况
1.1 致病机理
在无浆体感染之后,动物体内的中性粒细胞会受到感染,并受到无浆体剪应力的影响,在穿过内皮细胞时出现异常改变,无法正常活化与分化[2]。同时,嗜吞噬细胞无浆体还可以对动物体内肌动蛋白磷酸化产生影响,导致多种症状的出现。
1.2 临床症状
在患病之后,无浆体感染山羊大多会表现出黄疸、贫血、发热等症状。受到疾病的影响,动物会表现出精神状态不佳,不爱活动,采食量下降等情况,体型不断消瘦[3-4]。这一情况下,也严重影响到动物的生长发育,给养殖户的经济收益造成严重损害。
1.3 病理变化
感染无浆体病原之后,患病动物kene出现消瘦、贫血等情况,经剖检可以观察到组织呈现出苍白、黄疸等情况[5]。同时,患病动物的多个脏器会出现异常改变[6]。例如,动物心脏会出现肿大现象,心肌色但且质地较软。脾脏也会呈现出肿大状态,被膜下还会出现分散分布的点状出血。
2 南宁市石漠化地区山羊无浆体感染情况调查
2.1 材料
2.1.1 样品来源
2019~2021年间在南宁市石漠化地区四个县区采集到的山羊血液样品1610份。其中武鸣区:700份,上林县:350份,隆安县:260份,马山县:300份。饲养模式包括舍饲和放牧两种,品种有黑山羊和杂交山羊。所采集到的血液样品,均置于EDTA—K抗凝管(2ml)中,并将其置冰箱中保存待检,冰箱温度设置为4℃。
2.1.2 试剂及仪器
此次调查所应用的主要试剂与实验仪器类型及其来源情况如表1所示:

表1 主要试剂与实验仪器类型及其来源情况
2.1.3 引物
主要表面蛋白4(major surfaceprotein4,MSP4)是无浆体属和种鉴定的重要基因[7]。本次检测参考自参考de la Fuente等[8]报道合成检测的山羊无浆体 MSP4基因的引物,上游引物 SF:5′-CCGGATCCTTAGCT GAACAGGAATCTTGC-3′;下游引物SR:5′-GGGAGCTCCTATGAATTACAGA GAATTGTTTAC-3′,预计扩增片段长度为870bp左右。引物由宝生物工程(大连)有限公司合成。
2.2 方法
2.2.1 DNA提取
使用磁珠法核酸提取试剂盒提取DNA,所有操作均按照试剂盒说明书步骤:
(1)预封装深孔板准备:取出预封装深孔板,颠倒混匀数次使磁珠重悬,轻甩孔板使试剂及磁珠均集中到孔板底部(也可使用孔板离心机,500rpm×1min 进行离心),使用前小心撕去铝箔封口膜,避免孔板振动,防止液体溅出。
(2)在试剂盒96孔板的第1、7列中分别加入20ul Protein K 和200ul全血样品(样品需平衡至室温),放入全自动核酸提取仪中自动运行程序:①裂解,混合时间2min,磁吸时间0s;②移磁珠,混合时间1min,磁吸时间60s;③结合,混合时间10min,磁吸时间20s;④洗涤3次,混合时间各5min,磁吸时间各20s;⑤洗脱,等待时间5min,混合时间10min,磁吸时间120s,裂解加热75℃;⑥弃磁珠,混合时间1min,磁吸时间0s。
(3)自动化程序结束后,将5、11列的DNA样品转移至干净的无核酸酶离心管中。
2.2.2 PCR扩增
取200μlPCR专用管,连同阳性对照管和阴性对照管,每管加上述 5.0 μl DNA模板,8.0μl RNase Free dH20,10.0μl 2×1 step Buffer,1.0μl PrimeScript 1 step Enzyme Mix,上、下游引物各 0.5μl,PCR体系为 25μl;置PCR仪,94℃预变性3min,PCR循环条件为95℃ 50s,56℃ 50s,72℃50s,共35个循环,72℃延伸 10min。
2.2.3 电泳及结果判定
取PCR产物7μl,于1%琼脂糖凝胶电泳,凝胶中含0.5μl /ml核酸替代染料,电泳缓冲液为0.5×TBE,80V 30分钟,电泳完后于长波紫外灯下观察拍照。阳性对照管和样品检测管出现870bp的特异性条带判为阳性。
2.2.4 统计学处理
完整收集实验获得的各项数据结果,整理无误后导入到统计学软件SPSS 19.0中进行处理。具体的阳性率均以百分比形式表示,数据组间比较实施卡方检验,差异显著的标准为P<0.05。
2.3 结果
2.3.1 PCR扩增结果
此次调查1610份山羊血液样品检出无浆体阳性30份,部分电泳图如下。
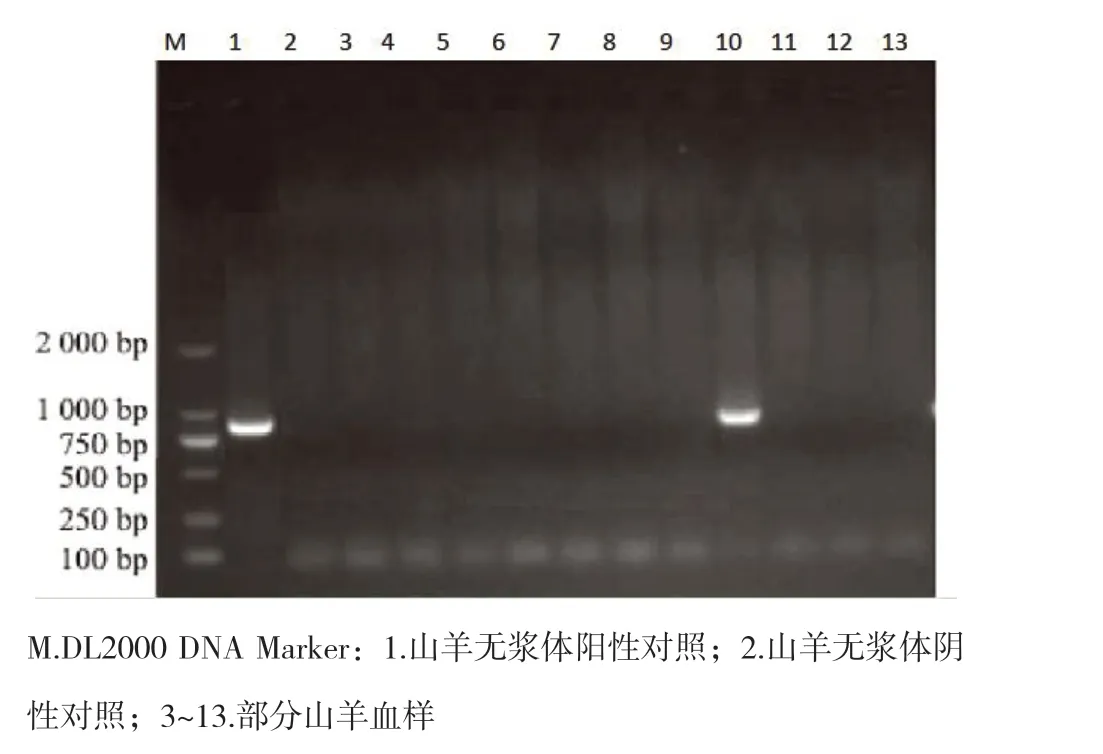
图1 山羊无浆体PCR扩增部分结果
2.3.2 放牧与舍饲模式下的山羊无浆体阳新率统计比较
统计并比较不同饲养模式下的山羊无浆体阳性率,可得放牧模式下的阳性率显著高于舍饲模式,(P<0.05)。详细结果见表2:
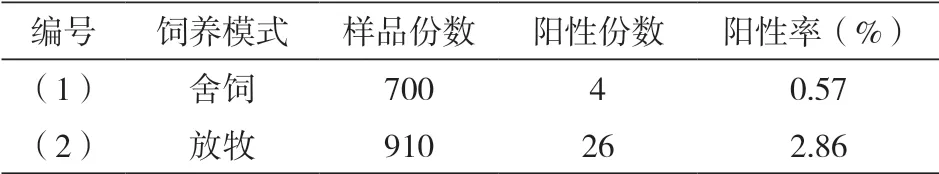
表2 放牧与舍饲模式下的山羊无浆体阳新率统计比较
2.3.3 黑山羊与杂交山羊的无浆体感染阳率比较
黑山羊的阳性率显著高于杂交山羊血液无浆体阳性率,(P<0.05)。见表3:

表3 黑山羊与杂交山羊的无浆体感染阳率比较
2.3.4 山羊无浆体感染情况
此次研究中,一共采集到1610份山羊血液样品,经检测,一共出现阳性样品数量为30份,总阳性率为1.86%,具体如下表4所示:
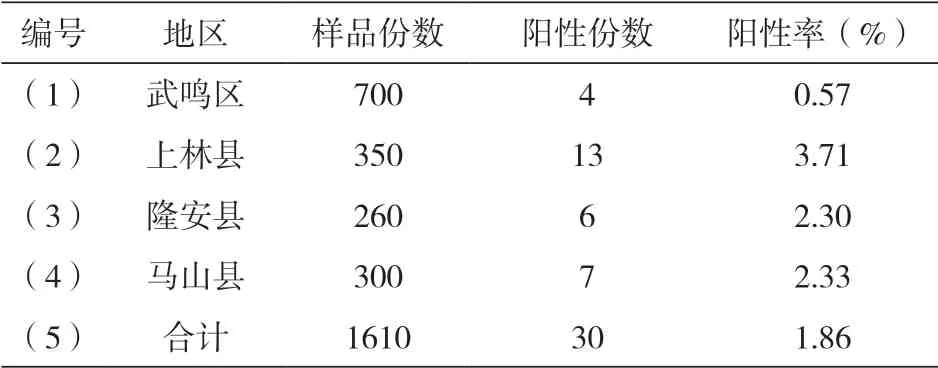
表4 山羊无浆体感染情况统计
3 讨论分析
3.1 无浆体感染在南宁市石漠化地区山羊中普遍存在,感染率较低
通过对所采集到的1610份山羊血液样品进行检测,共检30份无浆体阳性,总阳性率为1.86%,总体来看,处于相对较低的水平,但仍然存在一定的危害,需要予以关注。同时,武鸣区、上林县、隆安县、马山县的样品中均存在一定的阳性样本。这一情况表明,无浆体感染在南宁市石漠化地区山羊中普遍存在。
3.2 放牧山羊血液中无浆体阳性率显著高于舍饲羊
山羊的饲养方式方面,包括了舍饲和放牧两种类型。通过此次研究发现,统计并比较不同饲养模式下的山羊无浆体阳性率,可得放牧模式下的阳性率为6.00%,明显高于舍饲模式下的2.50%。分析相关原因,可能是因为无浆体感染的出现与硬蜱之间存在十分密切的联系。在养殖过程中,如果通过放牧方式进行喂养,山羊在采食和活动的过程中,更容易被硬蜱叮咬。同时,在放牧过程中,动物极易对各种病原进行传播,导致更多动物患病[9]。这一结果也提示,养殖户们应注意在放牧饲养的过程中,强化对环境的观察以及对山羊的管理,积极做好硬蜱防控工作,以有效控制无浆体感染[10]。
3.3 不同品种山羊无浆体感染率存在差异
目前,在南宁市石漠化地区所饲养的山羊中包含了不同类型的山羊品种,在此次研究中,选择对当地两种常见的山羊品种的血液样本进行检测。结果显示,黑山羊阳性率明显高于杂交山羊,可能与不同品种山羊在无浆体感染方面的易感性存在一定的差异等因素相关。
4 结语
在本次研究对南宁市石漠化地区山羊的无浆体感染情况开展了调查,初步掌握了南宁市石漠化地区的山羊无浆体感染现状,无浆体感染在南宁市石漠化地区山羊中普遍存在,感染率较低;放牧山羊血液中无浆体阳性率显著高于舍饲羊;不同品种山羊无浆体感染率存在差异。总之,无浆体感染对山羊养殖存在较大危害性,在山羊养殖过程中,还应当高度重视无浆体病这一疾病。并积极地开展相关的流行病学调查和分析等工作,全面掌握本地区的无浆体感染情况,有针对性地开展相应的预防和控制、治疗等工作,切实提升本地区的山羊养殖水平。
