COPD患者血清IL-38、sRAGE、TLR4、ANGPTL4变化及与疾病严重程度、预后的关系分析
2022-11-10陈佩,吴朔,徐溪,方圆
陈 佩,吴 朔,徐 溪,方 圆
空军军医大学第一附属医院,陕西西安 710032
慢性阻塞性肺疾病(COPD)是一种慢性阻塞性呼吸道疾病,其特征是不可逆的气流受限和持续的呼吸道症状[1]。COPD的主要临床症状为慢性咳嗽、咳痰、呼吸困难、喘息和胸闷等,我国40岁以上人群发病率高达8.2%,且呈上升趋势[2]。COPD的发病机制比较复杂,该病可引起上皮细胞坏死、支气管壁炎症细胞浸润、支气管闭塞,甚至扭曲变形等病理变化。相关研究发现,炎性反应是导致COPD患者病情加重、生活质量降低、预后不良的重要诱因。因此,寻找有效的生物标志物进行早期鉴定及预后评估具有重要的临床意义。白细胞介素(IL)-38是IL-1家族的新成员,其可通过抑制IL-6、IL-7、干扰素-γ(IFN-γ)等的表达进而参与炎性反应。最近一项研究发现,IL-38在肺部炎症性疾病具有潜在调控作用[3]。晚期糖基化终产物受体(RAGE)是一种多配体模式识别受体,其可通过与配体结合启动多种信号通路,进而参与机体免疫、防御、创伤愈合及炎性反应。相关研究发现,可溶性晚期糖基化终产物受体(sRAGE)信号在肺发育和结构中也起着关键作用[4]。sRAGE可与RAGE配体竞争性结合,进而抑制RAGE的信号转导。Toll样受体4(TLR4)是一种参与先天免疫和适应性免疫的模式识别受体,其可以通过诱导促炎细胞因子和趋化因子的合成和释放进而介导炎性反应[5]。血管生成素样蛋白4(ANGPTL4)是一种分泌型糖蛋白,在内皮损伤和炎性反应中起重要作用。吴明景等[6]发现,COPD患者血清ANGPTL4存在高表达。本研究通过比较COPD患者血清IL-38、sRAGE、TLR4、ANGPTL4变化,并分析上述指标与疾病严重程度、预后的关系,为其临床诊断和治疗提供参考,现报道如下。
1 资料与方法
1.1一般资料 选取2019年5月至2021年3月本院收治的136例COPD患者作为病例组。病例组按照慢性阻塞性肺疾病全球倡议(GOLD)分级分为Ⅰ~Ⅱ级55例,Ⅲ~Ⅳ级81例。纳入标准:(1)符合《慢性阻塞性肺疾病诊治指南(2021年修订版)》[7],并经过胸部X线检查未见感染病灶,肺纹理增粗不典型;(2)符合《世界医学协会赫尔辛基宣言》,患者及家属签署知情同意书;(3)临床资料完整;(4)年龄≥18岁。排除标准:(1)检测前1个月内接受过影响血清IL-38、sRAGE、TLR4、ANGPTL4表达的治疗手段;(2)合并肺部感染患者;(3)合并其他呼吸系统疾病患者;(4)合并心、肝、肾功能疾病患者;(5)合并恶性肿瘤患者;(6)处于妊娠期或哺乳期。另选取同期来本院体检的健康者88例作为对照组,排除标准:(1)临床资料不完整;(2)年龄<18岁;(3)处于妊娠期或哺乳期。根据不同疾病进展将病例组分为急性期加重期组(n=79)和稳定期组(n=57)。急性期加重期组男45例,女34例;年龄47~79岁,平均(67.20±7.88)岁;体重(22.63±2.15)kg/m2;病程2~7年,平均(4.22±0.97)年; GOLD分级:Ⅰ~Ⅱ级29例,Ⅲ~Ⅳ级50例。稳定期组男36例,女21例;年龄45~78岁,平均(65.15±8.06)岁;体重(23.94±2.44)kg/m2;病程2~8年,平均(4.53±1.01)年;GOLD分级:Ⅰ~Ⅱ级26例,Ⅲ~Ⅳ级31例。对照组男53例,女35例;年龄43~78岁,平均(65.72±8.25)岁;体重(22.94±2.40)kg/m2。病例组和对照组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2研究方法 研究对象入组时采集清晨空腹血糖3 mL,3 000 r/min离心15 min,分离上清液,置于-20 ℃冰箱保存。采用酶联免疫吸附法(ELISA)检测血清IL-38、sRAGE、TLR4、ANGPTL4水平,所用试剂盒均来自武汉菲恩生物科技有限公司。病例组进行出院后随访,记录病例组患者出院后1年的生存情况。
1.3观察指标 (1)分析急性加重期组、稳定期组和对照组血清IL-38、sRAGE、TLR4、ANGPTL4水平。(2)病例组不同GOLD分级患者血清IL-38、sRAGE、TLR4、ANGPTL4水平比较。(3)根据病例组患者预后情况分为生存组和死亡组,两组血清IL-38、sRAGE、TLR4、ANGPTL4水平进行比较。(4)分析IL-38、sRAGE、TLR4、ANGPTL4表达对COPD患者预后的诊断价值。(5)死亡组和生存组临床病理特征比较。(6)对COPD患者预后进行多因素Logistic回归分析。
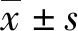
2 结 果
2.1各组血清IL-38、sRAGE、TLR4、ANGPTL4水平比较 急性加重期组患者血清IL-38、TLR4、ANGPTL4水平高于稳定期组、对照组,sRAGE水平低于稳定期组、对照组,差异有统计学意义(P<0.05),见表1。
2.2病例组不同GOLD分级患者血清IL-38、sRAGE、TLR4、ANGPTL4水平比较 病例组Ⅲ~Ⅳ级患者血清IL-38、TLR4、ANGPTL4水平高于Ⅰ~Ⅱ级患者,Ⅲ~Ⅳ级患者血清sRAGE水平低于Ⅰ~Ⅱ级患者,差异有统计学意义(P<0.05),见表2。
2.3死亡组和生存组血清IL-38、sRAGE、TLR4、ANGPTL4水平比较 死亡组患者血清IL-38、TLR4、ANGPTL4水平高于生存组,sRAGE水平低于生存组,差异有统计学意义(P<0.05),见表3。
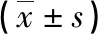
表1 病例组和对照组血清IL-38、sRAGE、TLR4、ANGPTL4水平比较
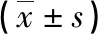
表2 不同严重程度COPD患者血清IL-38、sRAGE、TLR4、ANGPTL4水平比较
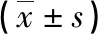
表3 死亡组和生存组血清IL-38、sRAGE、TLR4、ANGPTL4水平比较
2.4IL-38、sRAGE、TLR4、ANGPTL4表达对COPD患者预后的诊断价值 当约登指数最大值时取最佳截断值,结果显示,血清IL-38、sRAGE、TLR4、ANGPTL4诊断COPD患者预后的最佳截断值为61.52 ng/L、272.72 ng/L、4.24 ng/mL、1 172.50 ng/L,ROC曲线分析显示,IL-38、sRAGE、TLR4、ANGPTL4联合预测COPD患者预后的曲线下面积(AUC)为0.952高于IL-38(0.735)、sRAGE(0.812)、TLR4(0.783)、ANGPTL4(0.760)的AUC,差异有统计学意义(Z分别为4.076、3.612、3.776、3.997,P<0.05),见表4、图1。
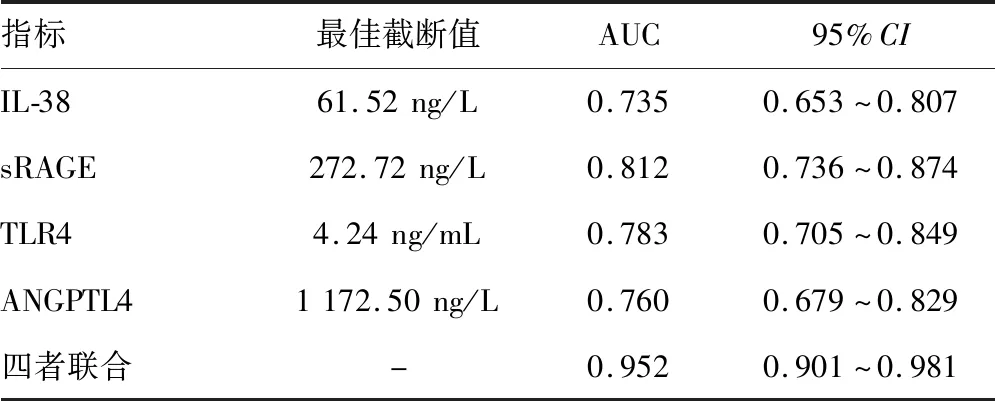
表4 IL-38、sRAGE、TLR4、ANGPTL4表达对COPD患者预后的诊断价值
2.5死亡组和生存组临床病理特征比较 死亡组和生存组在GOLD分级、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、IL-38表达、sRAGE表达、TLR4表达、ANGPTL4表达水平比较差异有统计学意义(P<0.05),而在性别、年龄、体重方面比较差异无统计学意义(P>0.05),见表5。
2.6COPD患者预后多因素分析 采用二元Logistic分析,GOLD分级、APACHEⅡ评分、IL-38表达>61.52 ng/L、sRAGE表达≤272.72 ng/L、TLR4表达>4.24 ng/mL、ANGPTL4表达>1 172.50 ng/L均为影响COPD患者预后的独立危险因素,见表6。
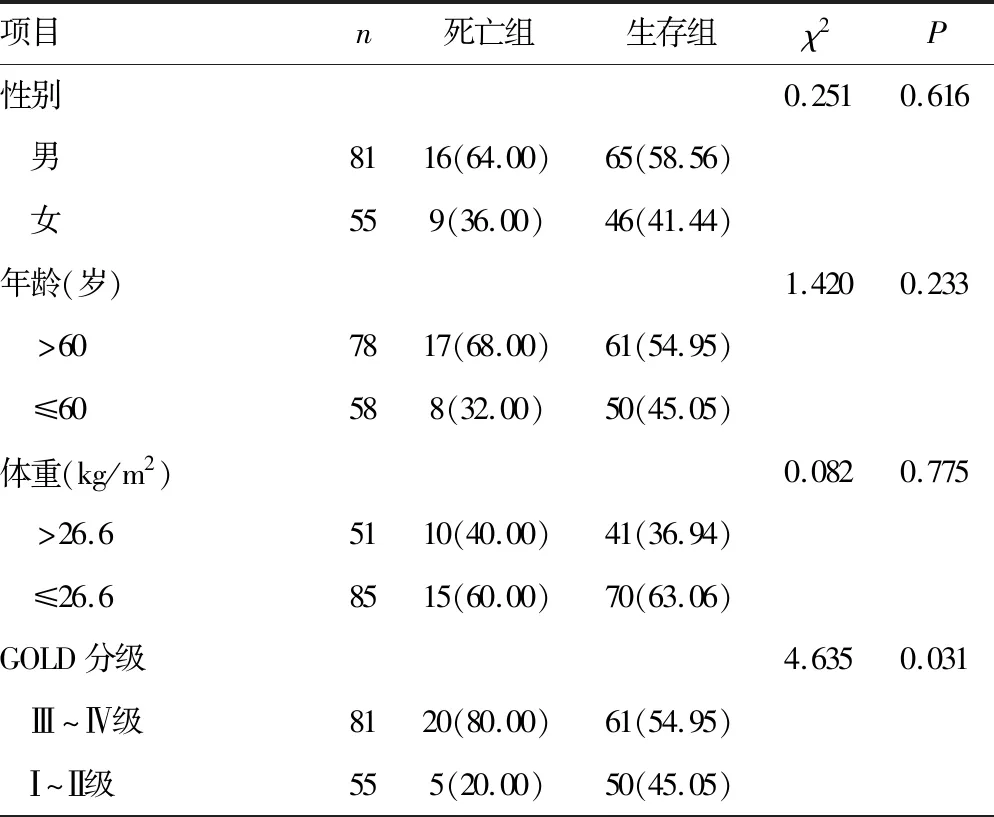
表5 两组临床病理特征比较[n(%)]
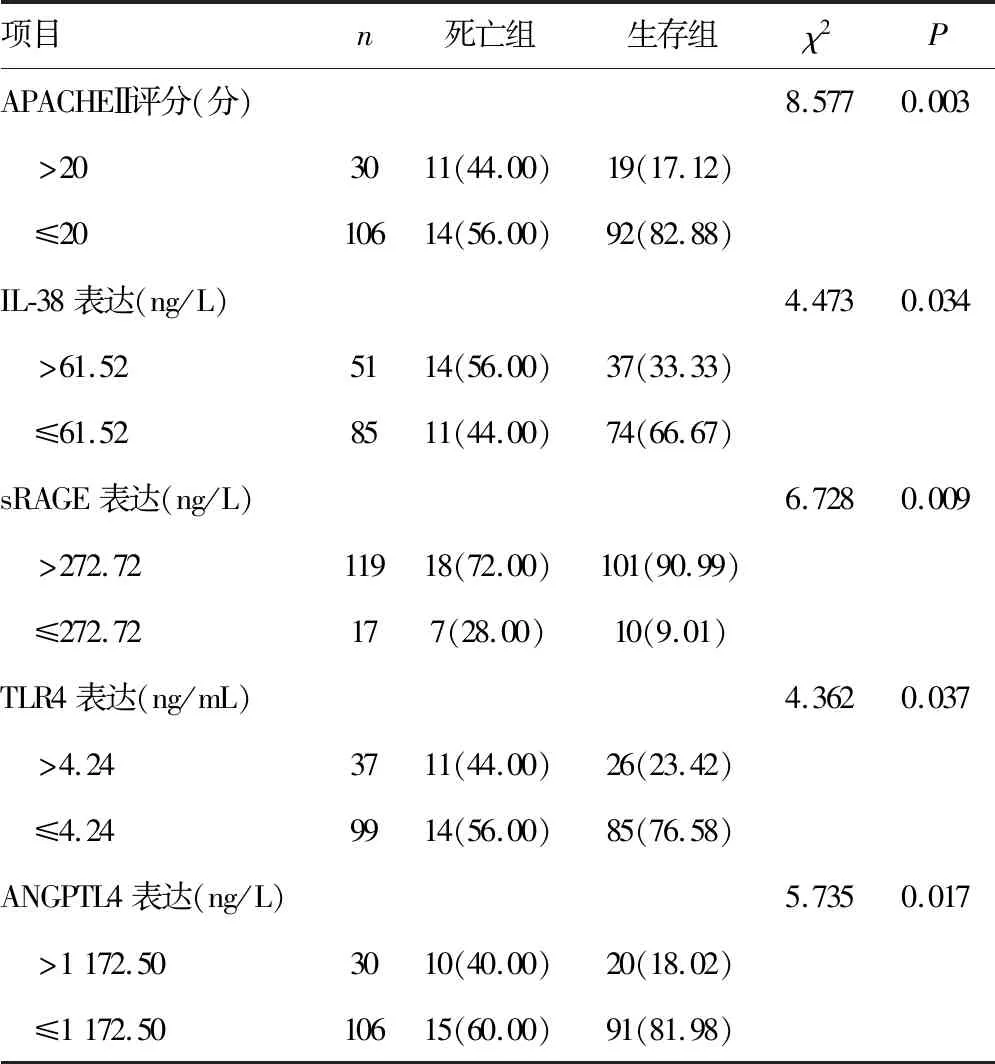
续表5 两组临床病理特征比较[n(%)]
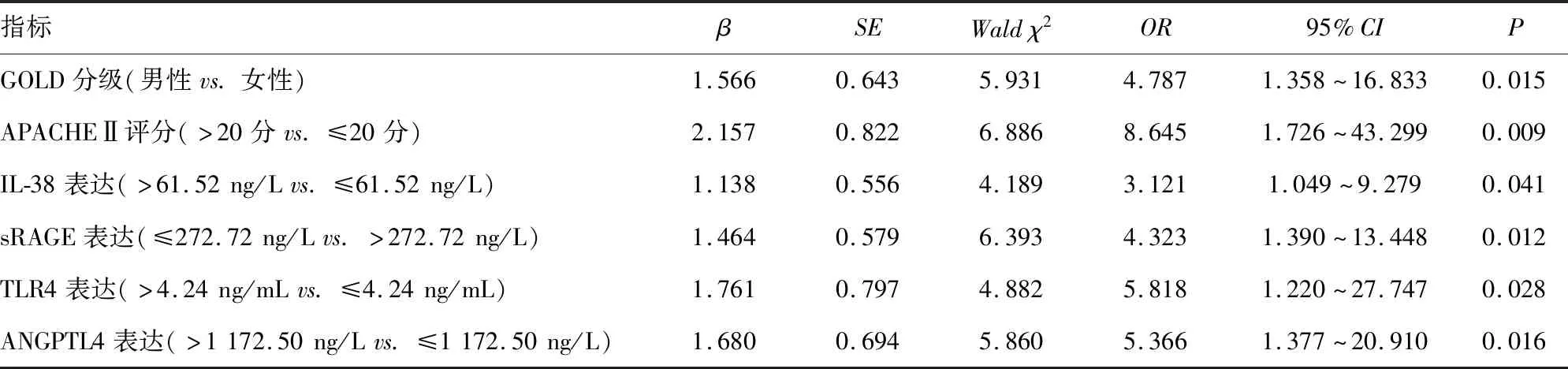
表6 COPD患者预后多因素分析
3 讨 论
COPD是一种复杂的异质性疾病,可引起慢性支气管炎和肺气肿。COPD与吸烟、感染、气候变化、职业粉尘、空气污染等多种因素有关,目前研究人员普遍认为炎性反应是COPD的主要发病机制。慢性炎症可刺激气道上皮细胞释放生长因子,促进气道周围平滑肌增生,进而导致气道重构[8]。
IL-38基因位于同一DNA链上白细胞介素-1受体拮抗剂(IL-1Ra)基因上游49479 bp处,其在多种慢性疾病中均表达升高。IL-38通过抑制促炎细胞因子的产生而发挥抗炎特性,其COPD急性加重期的诊断价值优于降钙素原,可以作为评价COPD的血清学标志。与对照组、稳定期组相比,急性加重期组血清IL-38水平升高,推测IL-38可能参与COPD的发生和发展。进一步研究表明,病例组Ⅲ~Ⅳ级患者血清IL-38水平高于Ⅰ~Ⅱ级患者,提示IL-38表达与病情严重程度密切相关。分析其原因可能是因为IL-8和IL-17等炎症因子可使中性粒细胞聚集在肺部,引发肺功能损伤,进而加重疾病病情。二元Logistic分析结果显示,IL-38表达>61.52 ng/L为COPD患者预后的独立危险因素,提示IL-38表达可作为预后评估。
RAGE主要由Ⅰ型肺泡上皮细胞表达,其可激活诱导核因子活化B细胞κ轻链增强子(NF-κB)介导的促炎反应并参与肺泡组织损伤。sRAGE是一种缺少跨膜结构域的RAGE,其可通过结合RAGE配体并抑制RAGE的同源二聚化,进而抑制下游炎症级联反应。本研究中,急性加重期组血清sRAGE水平低于稳定期组和对照组,提示sRAGE表达水平降低可能与COPD的发生相关。ZAIGHAM等[9]通过皮肤自发荧光测量皮肤中的晚期糖基化终产物(AGEs),发现AGE的积累与肺功能下降显著相关。病例组Ⅲ~Ⅳ级患者血清sRAGE水平低于Ⅰ~Ⅱ级患者;sRAGE表达≤272.72 ng/L为COPD患者预后的独立危险因素,提示sRAGE表达降低与病情严重程度密切相关,可用于COPD患者的预后评估。分析其原因,可能是因为sRAGE与COPD患者通气功能和弥散功能相关。最近一项研究表明,RAGE与其配体相互作用可促进CXC趋化因子配体10(CXCL10)、高迁移率族蛋白B1(HMGB1)等基因转录,而上调的HMGB1也可于RAGE结合,触发并放大炎性反应,进而引发持续性炎性反应和组织损伤,导致不良预后。
TLR4为Ⅰ类跨膜蛋白,主要分布于单核细胞/巨噬细胞、冠状动脉内皮细胞、肾小管上皮细胞和外周血管束等。TLR4可在细胞内与其特异性配体结合产生MyD88,激活NF-κB信号通路,进而诱导炎症级联反应。此外,TLR4通过结合脂多糖配体激活NF-κB通路,进而发挥调控炎性反应的作用。ZUO等[10]研究发现,TLR4/NF-κB信号转导通路参与了肺动脉高压的发病机制,TLR4/NF-κB水平表达可能反映肺动脉高压的严重程度。本研究中,与对照组、稳定期组相比,急性加重期组血清TLR4水平升高,推测TLR4可能参与COPD的发生和发展。进一步分析发现,病例组Ⅲ~Ⅳ级患者血清TLR4水平高于Ⅰ~Ⅱ级患者,提示TLR4表达与病情严重程度密切相关。本研究TLR4表达>4.24 ng/mL为COPD患者预后的独立危险因素,这与邹雯等[11]的研究结果一致,可能是因为TLR4可通过调节TLR4/MyD88/NF-κB信号通路,引发肺组织充血、水肿、炎症细胞浸润,造成肺组织病理性损伤,进而影响患者预后。
ANGPTL4是一种参与炎症过程的急性期蛋白,其在肝细胞、心肌细胞、巨噬细胞和脂肪细胞中均有表达,介导了脂质代谢、细胞迁移及多种炎症疾病过程。本研究中,与对照组、稳定期组相比,急性加重期组血清ANGPTL4水平升高,与以往的研究结果一致[12]。进一步分析发现,病例组Ⅲ~Ⅳ级患者血清ANGPTL4水平高于Ⅰ~Ⅱ级患者;ANGPTL4表达>1 172.50 ng/L为COPD患者预后的独立危险因素,提示ANGPTL4表达与病情严重程度相关,可用于预后评估。究其原因,可能是ANGPTL4可促进氧化应激、糖脂代谢,进一步加重机体炎性反应,导致病情加重。
本研究中,死亡组患者血清IL-38、TLR4、ANGPTL4水平高于生存组,sRAGE水平低于生存组(P<0.05),提示IL-38、sRAGE、TLR4、ANGPTL4可作为预后的标志物。进一步ROC曲线分析,IL-38、sRAGE、TLR4、ANGPTL4联合预测COPD患者预后的AUC高于单一指标,提示IL-38、sRAGE、TLR4、ANGPTL4联合预测的价值较高,可以通过联合检测诊断COPD患者预后。
综上所述,COPD患者血清IL-38、TLR4、ANGPTL4表达水平升高,sRAGE表达降低,四者与COPD病情严重程度密切相关,可用于预后评估。
