2018-2021年某院流感嗜血杆菌感染分布及耐药性*
2022-11-10周玉红刘瑞广余红岚
叶 蕊,周玉红,赵 雪,刘瑞广,宋 丹,余红岚,王 宇△
1.贵阳市第一人民医院检验科,贵州贵阳 550004;2.贵州医科大学公共卫生与健康学院,贵州贵阳 550025
流感嗜血杆菌(Hi)为革兰阴性杆菌,无芽孢、无鞭毛,呈长杆状、球杆状、丝状等多形性,定植于人的鼻咽部,是引起社区获得性感染的重要病原体,也是重要的条件致病菌。根据有无荚膜,可将Hi分为有荚膜(可分型)和无荚膜(不可分型)两类。可分型包括a~f等6种血清型;不可分型无荚膜,不与任何一种分型血清凝集,即不可分型Hi(NTHi)菌株。随着b型Hi(Hib)疫苗在全球范围内的推广应用,国内外相关流行病学监测数据均表明Hib感染下降明显,但非荚膜型Hi,尤其是NTHi正在悄然取代Hib逐渐成为重要的儿童下呼吸道感染的优势病原菌,并呈快速上升趋势[1-3]。研究显示婴幼儿、老年人是最高危人群,其中免疫力低下及有基础合并症的个体是最易感人群并与高病死率相关。因此,如何控制NTHi及其他血清型Hi的感染是重要的公共卫生问题。此外,随着各类抗菌药物的广泛使用,Hi对各类抗菌药物耐药率及产β-内酰胺酶率不断增加,Hi感染分布特点及耐药性因呈地域性的差异而备受关注。本研究对贵阳市第一人民医院(以下简称本院)Hi感染病例进行分析,以了解本院Hi的分型与分布、产β-内酰胺酶及耐药基因的关系,有助于正确分析Hi 的耐药机制,合理选择抗菌药物治疗,提高临床治疗效果。
1 材料与方法
1.1菌株来源 1 170株Hi菌株(剔除来自同一患者相同部位的分离菌株)分离自本院2018年1月至2021年12月儿童及成人住院患者的呼吸道标本,其中922株分离自痰液标本,229株分离自咽拭子标本,7株分离自肺泡灌洗液标本2株分离自血液。
1.2试验材料 血平板、巧克力平板、MH平板、HTM平板购于广州市迪景微生物科技有限公司;药敏纸片购于赛默飞世尔科技有限公司;β-内酰胺酶测试条购于重庆庞通医疗器械有限公司。Ⅴ因子、Ⅹ因子、Ⅴ+Ⅹ因子纸片购于温州市康泰生物科技有限公司。采用Hi标准株(ATCC 49247)、金黄色葡萄球菌标准株(ATCC 29213)、粪肠球菌(ATCC 29212)监测质控。
1.3仪器与试剂 恒温水浴锅、高速离心机、瞬时离心机、生物安全柜、PCR 扩增仪(杭州晶格公司)、电泳仪(北京君意公司)和凝胶成像系统(VILBER BIO IMAGING公司)、BD全自动细菌鉴定仪。细菌基因组DNA提取试剂盒(北京百泰克生物技术有限公司)、TaKaRa ExTaq 试剂盒 (日本 TaKaRa公司)、DL1000 标志物。
1.4引物合成 依据参考文献[4]和GenBank数据库中相关基因序列设计引物。包括Hi特异性外膜蛋白引物omp6、Fuck基因、荚膜bexA基因、β-内酰胺酶TEM-1,ROB-1基因等,用于Hi的鉴定、荚膜分型及氨苄西林耐药Hi基因分型。见表1。

表1 PCR引物序列
1.5方法
1.5.1标本分离及培养 标本接种严格遵循《临床检验操作规程》(第4版)进行操作。将合格送检标本分别接种于血平板及含有万古霉素的巧克力平板上,孵育条件:5% ~10% CO2,35~37 ℃培养18~24 h,挑取巧克力平板上呈优势生长的透明或半透明、湿润、光滑、易乳化的疑似菌落,革兰染色,镜检为革兰阴性短小杆菌。
1.5.2菌株鉴定 用接种环挑取经18~24 h培养的新鲜菌落于5 mL无菌水内,调制成0.5麦氏度菌悬液,用无菌棉拭子浸湿0.5麦氏菌液均匀涂布于MH平板表面,粘贴Ⅴ因子、Ⅹ因子、Ⅴ+Ⅹ因子纸片后置于5%~10%CO2、35~37 ℃培养18~24 h后观察结果。若Ⅴ因子、Ⅹ因子边缘无细菌生长,Ⅴ+Ⅹ因子纸片边缘可见细菌明显生长则初步鉴定为Hi。
1.5.3药敏试验 采用世界卫生组织推荐的纸片扩散法(K-B法),挑取单个菌落配置成0.5麦氏度的菌悬液,用无菌棉拭子浸湿0.5麦氏菌液均匀涂布于Hi药敏试验平板(HTM药敏平板)上,粘贴药敏纸片后置于5%~10%CO2,35~37 ℃环境培养18~24 h,测量抑菌圈直径,遵循美国临床实验室标准化协会(CLSI)2021版标准进行判读。并采用卫生部临检中心的Hi(ATCC 49247)作为质控菌株。
1.5.4β-内酰胺酶测定 采用头孢硝噻吩纸片法进行测定。纸片用无菌水润湿后,蘸取Hi菌落,10 min 内纸片由黄色变红色即为产β-内酰胺酶,为阳性,不变色为阴性。用金黄色葡萄球菌(ATCC 29213)、粪肠球菌(ATCC 29212)作为质控菌株。
1.5.5菌株DNA模板制备 采用DNA提取试剂盒(购自北京百泰克生物技术有限公司)提取DNA模板。保存于-20 ℃冰箱备用。
1.5.6PCR检测 采用TaKaRa ExTaq试剂盒(日本TaKaRa公司),反应体系参照说明书。扩增条件:94 ℃预变性5 min;94 ℃ 30 s、50 ℃ 30 s、72 ℃ 30 s,30个循环;72 ℃延伸10 min(以Omp6为例,其余基因引物退火温度见表1)。用无菌去离子水作阴性对照。
1.5.7琼脂糖凝胶电泳 取5 μL扩增产物,上样于1.5%琼脂糖凝胶加样槽中,同时留1个空孔加入5 μL 1 000 bp相对分子质量标准,恒压100 V 25 min,于凝胶成像系统下观察扩增条带,根据凝胶电泳结果判断:P6基因和Fuck基因均阳性则为Hi;P6基因阳性,Fuck基因阳性,bexA基因阴性则为NTHi;P6基因阳性,Fuck基因阳性,bexA基因阳性则为荚膜型Hi。
1.5.8产物测序 将条带明亮的PCR产物送至昆明擎科生物公司测序,测序结果在GenBank 数据库中网上查询比较,进行 Blast比对分析。
1.6统计学处理 采用WHONET5.6对所分离菌进行药敏分析,统计各抗菌药物敏感率、耐药率的情况,应用SPSS22.0统计软件及Excel软件对数据进行统计和分析,计数资料以率表示,组间比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1Hi的PCR鉴定与分型 本研究收集的Hi菌株经PCR鉴定分型检测后均为NTHi。P6、Fuck基因,PCR产物凝胶电泳图见图1,均未检出bexA基因。
2.2Hi分布及抗菌药物耐药性分析 收集的1 170株Hi菌株共来自19个科室,主要来自儿科及呼吸内科,各占67.44%(789/1 170)、9.6%(101/1 170),其余来自其他各个科室(耳鼻喉科、全科、肾内科等)。2018-2021年2岁以下儿童Hi分离率为54.44%(637/1 170),≥60岁以上老年人Hi分离率为17.18%(201/1 170)。将所有病例分为儿童组(≤14岁)及成人组(>14岁),并进行各年度及2018-2021年耐药率的分析。2018年成人组与儿童组阿奇霉素、左氧氟沙星耐药率比较差异有统计学意义(P<0.05),2020年成人组与儿童组氨苄西林、头孢呋辛、左氧氟沙星耐药率比较差异有统计学意义(P<0.05)。见表2~6。
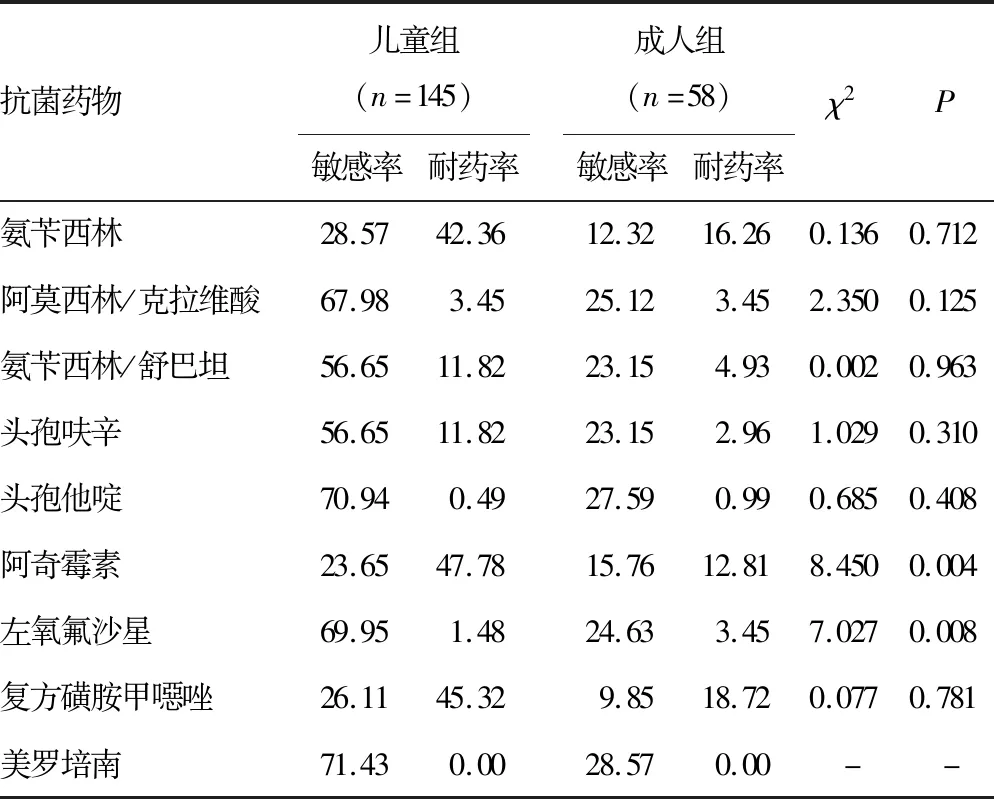
表2 2018年Hi对抗菌药物的耐药率(%)
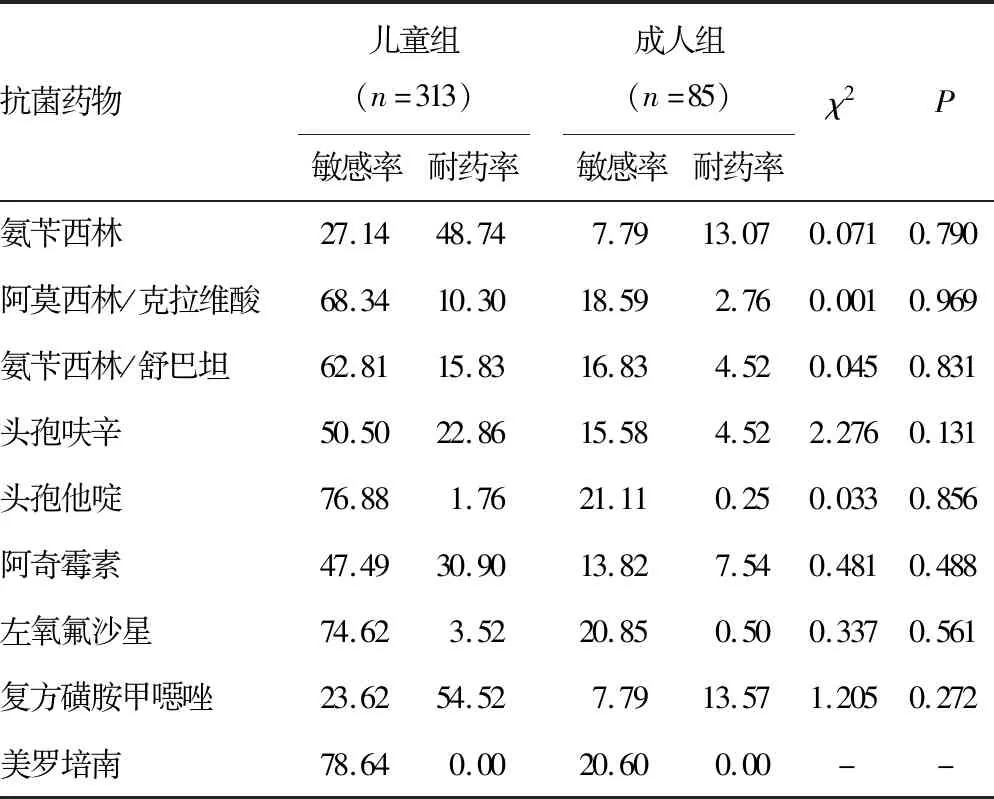
表3 2019年Hi对抗菌药物的耐药率(%)
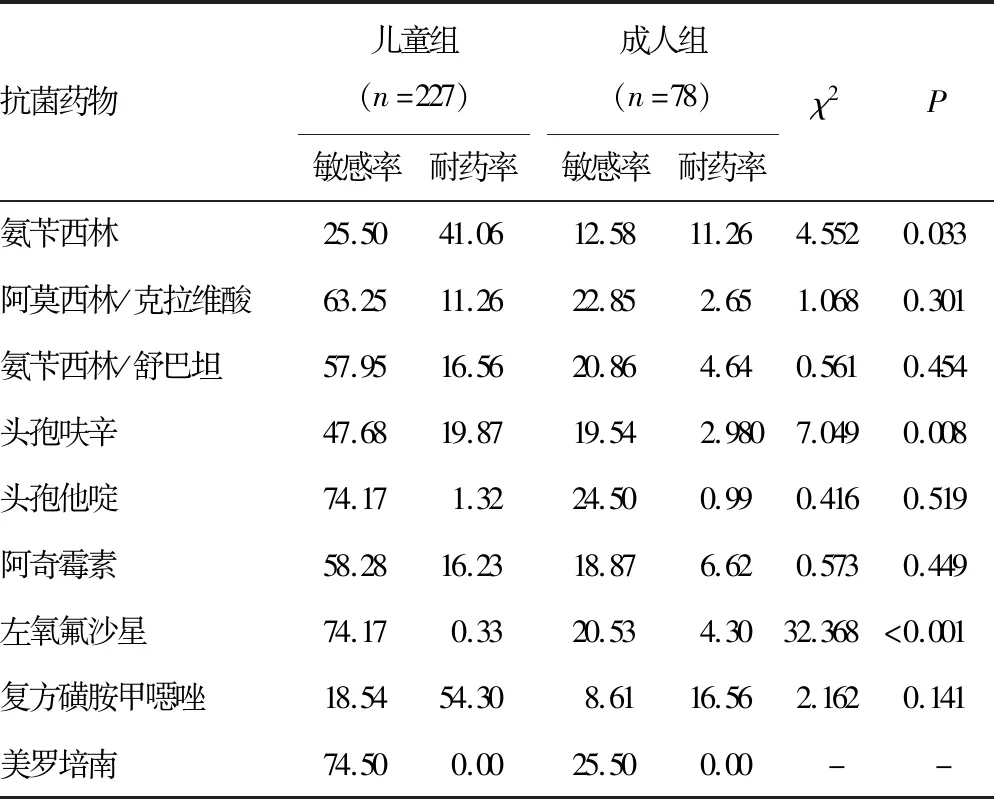
表4 2020年Hi对抗菌药物的耐药率(%)
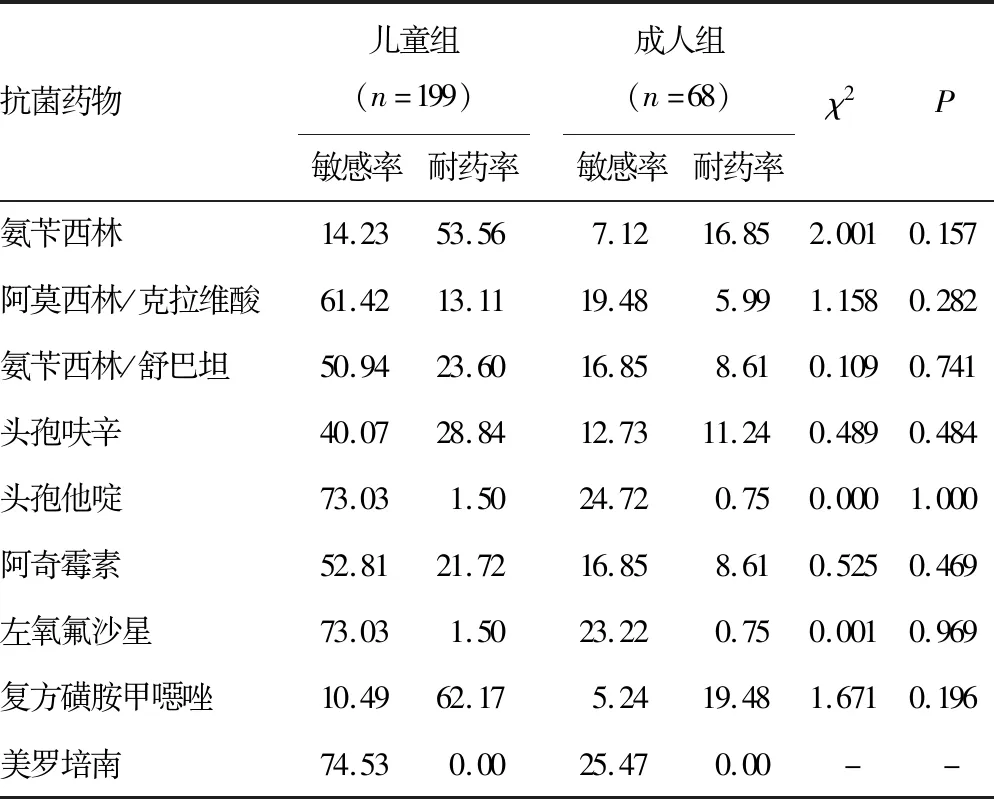
表5 2021年Hi对抗菌药物的耐药率(%)
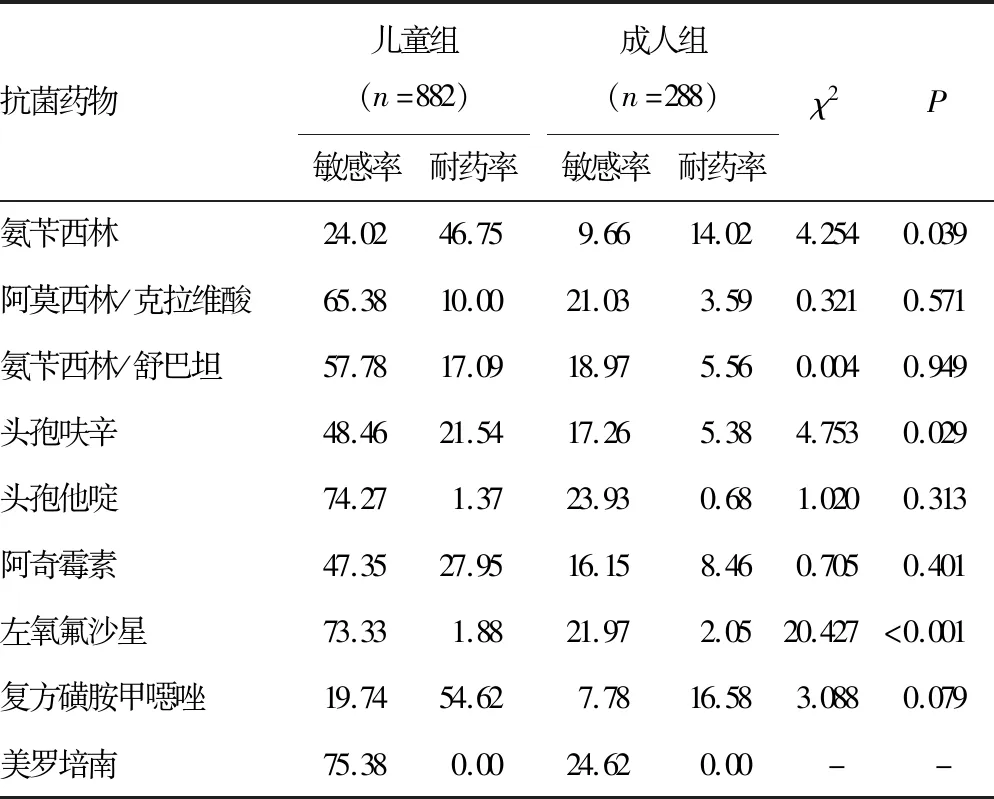
表6 2018-2021年Hi对抗菌药物的耐药率(%)
2.3菌株β-内酰胺酶及其耐药基因检测 2018-2021年547株氨苄西林耐药菌株经头孢硝噻吩纸片法检出426株β-内酰胺酶阳性菌株,经PCR及琼脂凝胶电泳检测耐药基因型均为TEM-1型,未检出ROB-1基因型。见表7。PCR产物凝胶电泳图见图2。
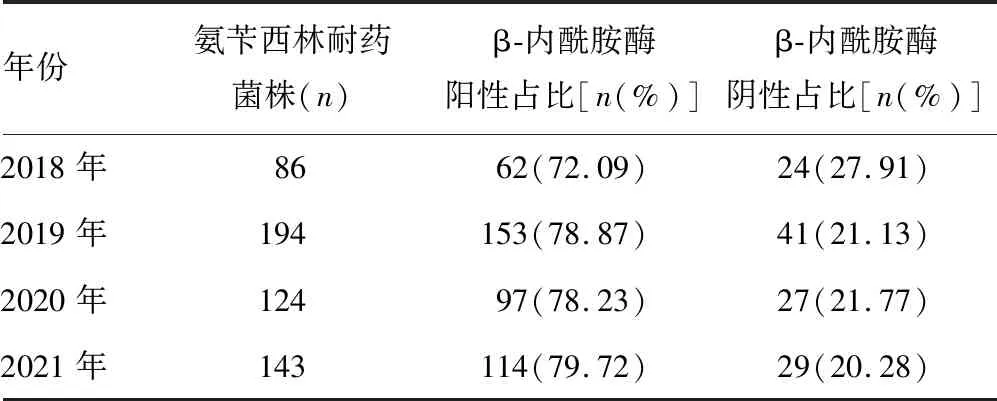
表7 2018-2021年Hi β-内酰胺酶的检出率对比
3 讨 论
Hi常引起社区获得性呼吸道感染、肺炎、支气管炎、急性中耳炎、细菌性脑膜炎等疾病;严重者可引起化脓性脑膜炎和败血症等全身感染[5];主要感染免疫力相对低下的人群,如围产儿、婴幼儿、老年人等[2];感染以冬春季节高发[6-7];Hib是引起儿童Hi疾病的主要原因[8],但随着Hib疫苗的推广应用,Hib的感染极大减少,而其他血清型及NTHi的感染呈逐年上升趋势[9]。
本次研究的1 170株Hi,主要分布于儿科,以患肺炎为主。检出Hi的标本包括痰、咽拭子、分泌物、肺泡灌洗液、血液等,其中以痰标本常见,占78.80%(922/1 170)。这与TORUMKUNEY等[10]检出标本类型研究一致,这可能与呼吸道感染常见咳痰症状,痰液获得性高相关。2018-2021年2岁以下儿童Hi分离率为54.44%(637/1 170),≥60岁以上老年人Hi分离率为17.18%(201/1 170)。2岁以下儿童占比超过50%,可能与该年龄段儿童的免疫系统不健全,缺乏对Hi的抵抗力有关;老年人感染的原因是机体免疫力、生理功能等随着年龄的增长不断衰退,同时伴随各系统基础疾病的原因等导致感染率增加[11]。
本研究收集的Hi菌株经PCR鉴定分型检测后均为NTHi,均未检出bexA基因,这与ELDERE 等[2]、王姜琳等[12]研究结果一致。通过2018-2021年儿童与成人药敏结果对比可见2018年儿童的阿奇霉素耐药率和2018-2021年儿童的左氧氟沙星耐药率和2018年、2020年成人的左氧氟沙星耐药率与我国细菌耐药性监测数据比较,均高于全国水平,其余抗菌药物均低于其监测结果[13-17]。针对2018年儿童组阿奇霉素较高耐药率的情况,临床依据耐药监测结果调整用药习惯,2019-2021年儿童组阿奇霉素耐药率有了明显的降低。因为临床对于儿童及成人两个年龄群在入院肺炎诊治时用药习惯不同,呈现出对于氨苄西林、头孢呋辛、左氧氟沙星等抗菌药物耐药率比较差异有统计学意义(P<0.05)。本研究2018-2021年氨苄西林及头孢呋辛儿童组与成人组的耐药率均为波动性变化,这与2018-2021年全国细菌耐药监测数据变化一致[13-17]。2020年氨苄西林及头孢呋辛儿童组与成人组的耐药率均呈现小幅度降低,但2018年与2021年比较两种抗菌药物的耐药率明显上升。本研究2018-2021年儿童组左氧氟沙星耐药率均高于每年度细菌耐药监测数据,耐药率增高幅度以2019年较为明显,考虑喹诺酮类抗菌药物的作用机制,需谨慎使用该药物。对于该药物的抑菌环边缘值结果需确保菌种纯度,必要时进行结果复核。本研究2018年与2021年耐药率比较可见儿童组及成人组的阿莫西林/克拉维酸、氨苄西林/舒巴坦、复方磺胺甲噁唑等抗菌药物的耐药率均呈上升趋势,儿童组及成人组均对三代头孢菌素、美罗培南等抗菌药物敏感性较高。可能是因为地区不同,耐药率有所差异,但耐药趋势一致。
氨苄西林作为Hi感染的首选用药,随着广泛的使用,耐药率也逐渐上升,根据细菌耐药监测数据显示2018—2021年其耐药率从57.2%上升至72.9%,上升幅度明显。氨苄西林的耐药通过两种作用机制,其中β-内酰胺酶的产生是主要的机制,它通常由TEM-1基因和罕见的ROB-1基因编码[18]。第2种机制是细菌细胞壁上青霉素结合蛋白 3(PBP3) 的 ftsI 基因氨基酸位点置换使空间构象发生改变,导致细菌与 β-内酰胺类抗菌药物亲和力下降,并影响氨基青霉素、β-内酰胺酶抑制类抗菌药物和第一、二代头孢的抗菌药物活性[19]。本研究547株氨苄西林耐药菌株经头孢硝噻吩纸片法,检出426株β-内酰胺酶阳性菌株,阳性率77.88%(426/547);耐药基因型均为TEM-1型,未检出ROB-1基因型,这与王姜琳等[12]、秦惠宏等[20]报道一致。β-内酰胺酶阴性氨苄西林耐药菌株(BLNAR)的检出,是否是导致本院β-内酰胺酶阳性,以及第一、二代头孢菌素和氨苄西林耐药率高的原因还有待进一步研究,应引起重视。本次β-内酰胺酶检出率较全国细菌耐药监测数据高,可能是由于各地区用药习惯不同而导致,氨苄西林已不适用于Hi感染首选治疗。
研究发现,定植于下呼吸道的NTHi可释放高度炎症抗原,如脂寡糖等,长期不被消除会引起宿主的慢性复发性感染,反复抗菌药物治疗又增加耐药菌株[21]。目前,一些国家都因Hib结合疫苗的接种降低了Hib感染率[22-23],而我国一些地区Hib结合疫苗的联合接种率仅为54.9%[24],面对NTHi及其他血清型Hi感染的增加,有必要将Hib疫苗纳入国家免疫Ⅰ类计划,并及时实施标准化的监测方案和分型方法来监测NTHi极为重要。本研究进一步提示本院针对Hi感染应进一步加强检测并进行分型研究,积极普及疫苗接种,以及结合药敏实验结果合理选用抗菌药物,减少耐药菌株的产生。
