不同温度和含水率条件下CH4 和CO2吸附热力学特性的分子模拟
2022-11-09李子文白岩松蔚宏进高亚斌
李子文,白岩松,蔚宏进,高亚斌
(太原理工大学安全与应急管理工程学院,山西太原 030024)
煤层气主要以吸附态赋存在煤层中[1],CO2驱替增产煤层气技术不仅可以实现煤层气增产,还可以将CO2封存在煤层中,实现碳减排,其基础是CO2和CH4的竞争吸附,而吸附过程通常会伴随着热力学特性的变化[2]。国内外众多学者针对CH4和CO2在煤中的吸附特性进行了研究。Wang 等[3]通过实验和模拟研究了N2和CO2对CH4的驱替作用,结果表明N2驱替CH4所需的时间比CO2长,使用CO2驱替CH4效果更好;于洪观等[4]、张松航等[5]通过对CH4和CO2等温吸附实验研究,并对实验数据进行预测,表明煤对CH4/CO2混合气体的吸附量介于纯CH4和CO2吸附量之间,总吸附量随混合气中CO2比例的增加而增加;Weniger 等[6],Weishauptova 等[7]研究了水分对CH4和CO2吸附的影响,证明了水分的存在不利于煤吸附气体;Busch 等[8],Charriere 等[9]研究发现虽然含水率增加时气体吸附量会降低,但当含水率达到饱和后,气体吸附量则不再增加;MERKEL等[10]通过对不同煤阶的煤样进行CH4和CO2吸附实验,表明随着煤阶和含水量的增加,CO2相对CH4的吸附选择性降低;周来等[11]利用煤表面自由能变化值和等量吸附热揭示了CO2在煤层中的优先吸附性,并且发现了CO2在煤基质表面存在多分子层吸附。目前对CH4和CO2在煤中的吸附特性研究多是实验研究[12-13],吸附过程中的热力学特性研究较少,对分子间的相互作用研究不够深入,尤其缺少不同含水率对CH4和CO2吸附的热力学特性研究。因此,利用分子模拟,对单组分和双组分注入CH4,CO2进行对比,并进行热力学特性分析,研究不同温度、不同含水率对气体吸附的影响。
1 煤分子结构建立和模拟方案
1.1 煤结构模型及参数
以文献[14]中马兰8 号煤的大分子结构为基础进行模拟研究,结构参数为:分子式C179H126O10N2S,分子量为2494,C 素含量为86.13%,H 元素含量为5.05%,O 元素含量为6.42%,N 元素含量为1.12%,S元素含量为1.28%。
使用Material studio 2019 的Forcite 模块对煤分子结构进行分子力学和分子动力学优化。分子力学优化具体参数设置:任务项选择Geometry Optimization,力场选用COMPASS,电荷计算选择Charge using QEq。分子动力学优化具体参数设置:任务项选择Anneal,退火循环总数为10 次,初始温度300 K,最高温度500 K,采用NVT 系综,模拟时间10 ps,控温方法选Nose,力场设置同上。优化后的模型如图1。
1.2 不同含水率模型
使用MS 的Amorphous Cell 模块添加2 个煤分子建立晶胞,密度为1.3 g/cm3,进行分子力学和动力学优化,在(-101)方向上切开晶胞,然后用Build layers 分别添加3 nm 的真空层,再建立2×2×1 的超胞,得到3 nm 孔径大小的狭缝模型。使用Sorption模块Locate 任务项,1%、3%、5%含水率吸附的水分子数量分别为25、38、63 moleculars/u.c。建立的含水率分别为1%、3%、5%的煤分子模型如图2。
1.3 模拟方案
采用巨正则系综蒙特卡洛方法(Grand Canonical Ensemble Monte Carlo,GCMC) 模拟CH4和CO2在不同温度、不同含水率的煤分子中的吸附情况。使用MS 的Sorption 模块,任务项选Adsorption Isotherm,力场选择COMPASS,模拟温度分别为298、308、318 K,压力为0.01~10 MPa。对不同温度进行模拟时,吸附剂为3%的含水模型,在对不同含水率进行模拟时,温度固定在318 K,吸附剂为不同含水率的煤结构模型,吸附质均为等比例经过几何优化的CH4和CO2分子。
GCMC 模拟可以得到单个晶胞内吸附的气体分子个数,用式(1)换算为试验常用的吸附量:
式中:V 为吸附量,mmol/g;N 为单个晶胞内吸附的气体分子个数,moleculars/u.c;NA为阿伏伽德罗常数,6.02×1023;M 为晶胞单元质量,g。
2 温度对CH4 和CO2 吸附热力学特性的影响
2.1 多组分气体吸附量和吸附热特性
不同温度下(298、308、318 K)双组分吸附CH4/CO2的密度分布如图3。利用Langmuir 方程对等温吸附数据进行拟合,通过模拟得到的不同温度条件下双组分吸附CH4、CO2的不同温度下CH4/CO2等温吸附曲线如图4。
式中:a 为饱和吸附参数,mmol/g;b 为吸附平衡参数,MPa-1;p 为压力,MPa。
由模拟结果可以看出,在0~10 MPa 压力范围内,随着温度升高,煤对CH4/CO2的吸附量有所下降,随着压力的增大,CH4、CO2的吸附量先快速增大后逐渐变缓直到饱和。相同温压条件下,CO2的吸附量要远大于CH4的吸附量。通过单、双组分吸附量的对比分析,可以发现双组分吸附时CH4的吸附量很少,说明在注入CO2后,CO2会和CH4产生竞争吸附,且CO2在煤中的吸附能力更强,在竞争中处于优势地位。从图3 中可以看出,当温度为298 K 时,CO2更多吸附在壁面上,CH4则在自由空间中更多,308 K 时,吸附量有所减少,当温度升高至318 K时,可以明显看到CH4在壁面上的吸附比例有所增加,说明温度升高不利于CO2驱替CH4。
不同温度下单组分注入CH4/CO2和双组分等比例注入CH4/CO2的平均等量吸附热情况如图5。
从图5 中可以看出:无论单、双组分注入CH4和CO2,二者的吸附热均随着温度的增加而降低。Ruthven[15]指出,由于煤表面的各相异性,会使得吸附热降低,当吸附量增加时,气体分子之间的作用力逐渐增强,吸附热会增加,然而二者的吸附热并没有增大,说明随着温度升高,越来越多的分子处于自由态,分子间的相互作用变小。CO2相较CH4分子,吸附热更高,何志敏等[16]指出CO2分子在微孔中释放的能量和热量比CH4分子大,说明煤对CO2的吸附能力要强于CH4。
2.2 多组分气体吸附势能特性
POLANYI[17]提出了吸附势能理论,建立了吸附势能和压力的关系式:
式中:ε 为吸附势能,J/(mol);R 为理想气体常数,取8.314 J/(mol·K);T 为温度,K;ps为温度T 对应的气体饱和蒸汽压,MPa。
DUBININ[18]通过对大量吸附测试数据进行统计分析建立了ps的计算公式:
式中:pc为临界压力,CH4临界压力取4.60 MPa,CO2临界压力取7.38 MPa;Tc为临界温度,CO4临界温度取190.38 K,CO2临界温度取303.98 K。
程宏飞等[19]建立了吸附量与吸附势能关系,并简化为经验公式:
式中:m,n 均为常数。
利用该公式对模拟数据进行拟合,得到的不同温度下吸附量和吸附势能的关系曲线如图6。
从图6 可以看出:CH4和CO2的吸附势能随着温度的升高不断降低。Polanyi 吸附势能理论[17]指出,气体分子会被吸附剂表面存在的引力场吸附,说明随着温度的升高,被这个引力吸附的气体分子越来越少。相同条件下,CO2分子的吸附势能比CH4大,说明煤表面更容易吸附CO2分子。双组分吸附时,随着温度的升高,CO2的吸附势能降低幅度比CH4明显,说明高温不利于CO2驱替CH4。
2.3 多组分气体吸附熵特性
熵可以衡量一个系统的混乱程度,通过Gibb-Helmholtz 方程[20]可以计算吸附熵△S:
式中:△H 为吸附焓;△G 为吉布斯自由能。
将计算后的△H 和△G 代入式(6)可以得到不同温度对应的吸附熵,不同温度下吸附量与吸附熵关系曲线如图7。
由图7 可以看出:CH4和CO2的吸附熵随着温度的升高而增大,吸附熵越大,系统越混乱,越来越多的气体处于自由状态,证明了温度越高对CH4和CO2的吸附越不利。相同条件下,CO2的吸附熵比CH4要小,证明了煤对CO2的吸附能力比CH4强。
3 含水率对CH4 和CO2 吸附热力学特性的影响
3.1 多组分气体吸附量和吸附热特性
不同含水率下CH4/CO2等温吸附曲线如图8,利用Langmuir 方程对其进行拟合,不同含水率Langmuir方程拟合参数见表1。
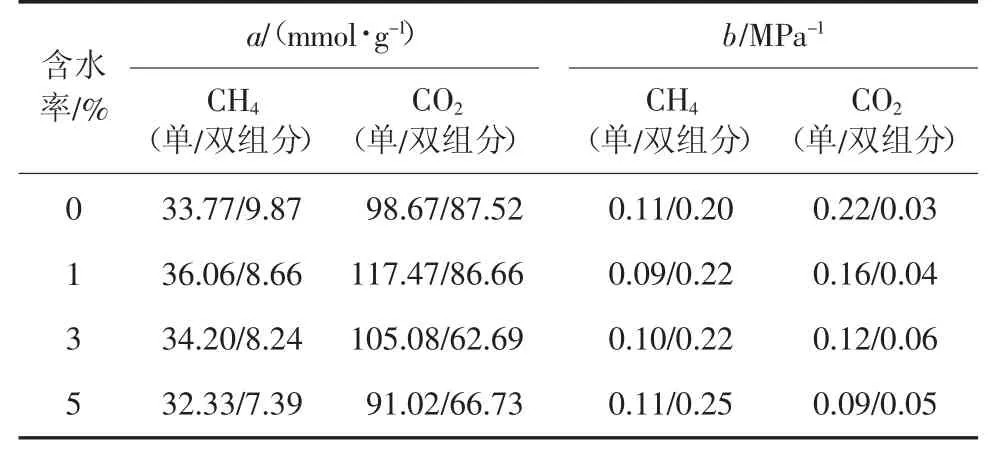
表1 不同含水率Langmuir 方程拟合参数Table 1 Fitting parameters of Langmuir equation at different moisture content
由图8 可知,注入压力较小时,单组分CH4和CO2的吸附量随含水率的增加而降低,当CH4和CO2的注入压力分别超过9 MPa 和6 MPa 时,1%含水率的吸附量超越了0%,同样在拟合数据中也可以看出,CH4和CO2的饱和吸附量在含水率为1%时是高于0%的,超过1%后则随着的含水率增加逐渐减少,从吸附量变化的压力节点来看,水对CO2吸附的影响要强于CH4;多组分注入时,CH4的吸附量随着含水率的增加在不断降低,CO2的吸附量虽然在初期随着含水率的增加而增加,但幅度很小,且随着压力越来越大,其吸附量开始随着含水率的增加而降低,从拟合数据来看,CH4的饱和吸附量随着含水率增加从9.87 mmol/g 降到了7.39 mmol/g,降幅不大,而CO2的饱和吸附量从87.52 mmol/g 最低降到62.69 mmol/g,之后又略微上升到66.73 mmol/g,虽然最后吸附量略微上升,但从整体降幅来看,比CH4要明显的多,因此说明水分子的存在是不利于CO2驱替CH4的。
不同含水率条件下单组分注入CH4/CO2和双组分等比例注入CH4/CO2的平均等量吸附热情况如图9。
单组分注入时,含水率从0%到3%,CH4的平均吸附热不断降低,到5%后又有所上升,由于水分子较少时,会与CH4产生竞争吸附,且煤对水的吸附能力强于CH4,所以吸附热会降低,当水分子越来越多后,水分子与水分子间因凝聚会形成不同多面体的团簇且CH4分子可能与水分子生成水合分子[21],从而使得吸附热增加。含水率从0%到5%,CO2的平均吸附热不断上升,虽然吸附量从1%到5%是减少的,但由于水分子在煤中的吸附优势,高能吸附位被水分子占据,形成水团簇,随着压力的增加,CO2覆盖低能吸附位,且部分与水团簇结合形成碳酸,水团簇和碳酸的形成会产生热量[21],从而使得吸附热增加而吸附量却没有增加。双组分注入时,CH4的平均吸附热随着含水率增加不断降低,在含水率达到5%时也没有上升,而CO2的吸附热则不断升高,说明水分子没有和CH4生成水合分子而是和CO2进行反应,同样证明了水对CO2影响要强于CH4。
3.2 多组分气体吸附势能特性
不同含水率条件下单组分注入CH4/CO2和双组分等比例注入CH4/CO2吸附势能随吸附量变化曲线如图10。
单组分注入时,CH4和CO2吸附势能在吸附初期随含水率变化规律不明显,但随着吸附量越来越多,呈现含水率越高吸附势能越低的规律。多组分注入时,CH4吸附势能随着含水率的增加而降低,而CO2吸附势能在吸附量较少时随着含水率的增加而增加,当吸附量越来越多后,含水率高的CO2吸附势能有所下降,其规律和吸附量的变化规律一致,说明水分子的存在不利于CO2驱替CH4。
3.3 多组分气体吸附熵特性
不同含水率条件下单组分注入CH4,CO2和双组分等比例注入CH4,CO2的吸附熵随吸附量的变化曲线如图11。
单组分注入时,CH4的吸附熵随含水率变化趋势并不明显,CO2的吸附熵则随着含水率的增加而降低,其中0%到3%的降幅很小,3%到5%的降幅相对较大,通过CH4和CO2的对比可以看出水对CO2的影响要强于CH4。双组分注入时,CH4和CO2的吸附熵均随着含水率的增加而降低,说明水分子的存在使得整个系统更加稳定,不利于CH4的产出。
4 结 论
1)CH4,CO2的吸附量和温度、含水率呈负相关关系。双组分注入时,随着温度的升高,CH4在壁面上的吸附比例有所增加,随着含水率的增加,CO2的饱和吸附量降低更加明显,温度升高和水分子的存在均不利于CO2驱替CH4。
2)CH4,CO2的平均吸附热和温度呈负相关关系,CO2的平均吸附热和含水率呈正相关关系。通过对不同含水率单、双组分平均吸附热的对比分析,说明水更倾向于和CO2进行反应。
3)CH4,CO2的吸附势整体和温度、含水率呈负相关关系,其中压力较低时,CO2的吸附势和含水率呈正相关关系。CH4,CO2的吸附熵和温度呈正相关关系,和含水率整体呈负相关关系,通过对不同含水率吸附熵的对比,发现水分子对CO2的影响要强于CH4。
