牛活体采卵和体外胚胎生产技术的应用现状和展望
2022-11-08邱金龙史延李爽张坤
邱金龙,史延,李爽,张坤
(浙江大学动物科学学院哺乳动物分子胚胎学实验室,杭州 310058)
自20 世纪80 年代活体采卵(ovum pick-up,OPU)/体外胚胎生产(in vitroembryo production,IVP)技术应用相继在牛上获得成功后,大量的研究和实践致力于改进这2 项技术,使得这2 项技术更加成熟和完善。如今,OPU结合IVP已经成为牛快速扩繁的最主要技术手段。在商业化运营的胚胎移植公司,通过OPU/IVP技术手段可以实现每头供体母牛每年生产80~100 头犊牛,牛的繁殖效率得到极大提高[1]。
在过去的30多年间,虽然牛OPU/IVP的技术方案在不断完善,但是大量研究表明,OPU/IVP 技术依旧有许多需要改进和提高的地方。因此,本文将概述近年来OPU/IVP 技术在牛胚胎生产中取得的研究进展,从方法和机制方面阐述影响OPU/IVP技术整体效率的因素、OPU/IVP的技术缺陷以及优化OPU/IVP技术体系的措施,并对OPU/IVP技术在未来中国市场的应用前景进行展望。
1 OPU/IVP 技术发展现状
相较于超数排卵和体内胚胎生产(in vivoderived,IVD)等技术,OPU/IVP 技术是相对新型的辅助生殖技术。OPU/IVP技术具有效率高、运用灵活以及对供体影响小的特点,因此在胚胎商业化生产中OPU/IVP技术正逐步取代IVD技术,成为种牛扩繁的最主要技术手段。由于OPU/IVP的绝大部分操作都是在体外完成的,因此OPU/IVP技术还可以应用在超数排卵效果不理想和患有输卵管堵塞等疾病的不孕不育个体上,从而实现对优秀遗传资源的拯救。同时,OPU/IVP技术结合胚胎冷冻技术被广泛运用在种质资源保护和远距离运输中。在我国,OPU/IVP技术已经被运用到地方优秀种质资源的改良和保护中。除此之外,在基础科研工作中,破解牛生殖生物学机制的相关研究也依赖于OPU/IVP技术[2]。
国际胚胎技术协会(International Embryo Technology Society,IETS)发布的牛胚胎生产和移植数据[3]显示:2016—2020年全球范围内(不包含中国、印度和日本)通过OPU技术获得的牛卵母细胞的数量远高于屠宰场来源的牛卵母细胞的数量,而且从2016年开始,屠宰场来源的牛卵母细胞呈明显的下降趋势;2017—2019年全球每年由OPU技术生产的牛卵母细胞数均超过了300万枚(图1)。IETS统计的数据[3]还显示:牛胚胎移植在所有的家畜中所占的比例最高,在2011—2020 年的10 年里,全球范围内(不包含中国、印度和日本)每年生产的牛胚胎总数超过了100万枚;2016年之前通过体内生产技术获得的胚胎是牛胚胎移植的主要来源,之后呈现出逐年下降的趋势;而通过IVP技术生产的胚胎自2012年以来逐年上升,并在2016年超过IVD技术生产的胚胎量,而这一差距在2017 年之后呈现出逐渐增大的趋势(图2)。由此可见,通过IVP技术生产的牛胚胎在全球范围内已经成了商业化牛胚胎移植的主要来源。
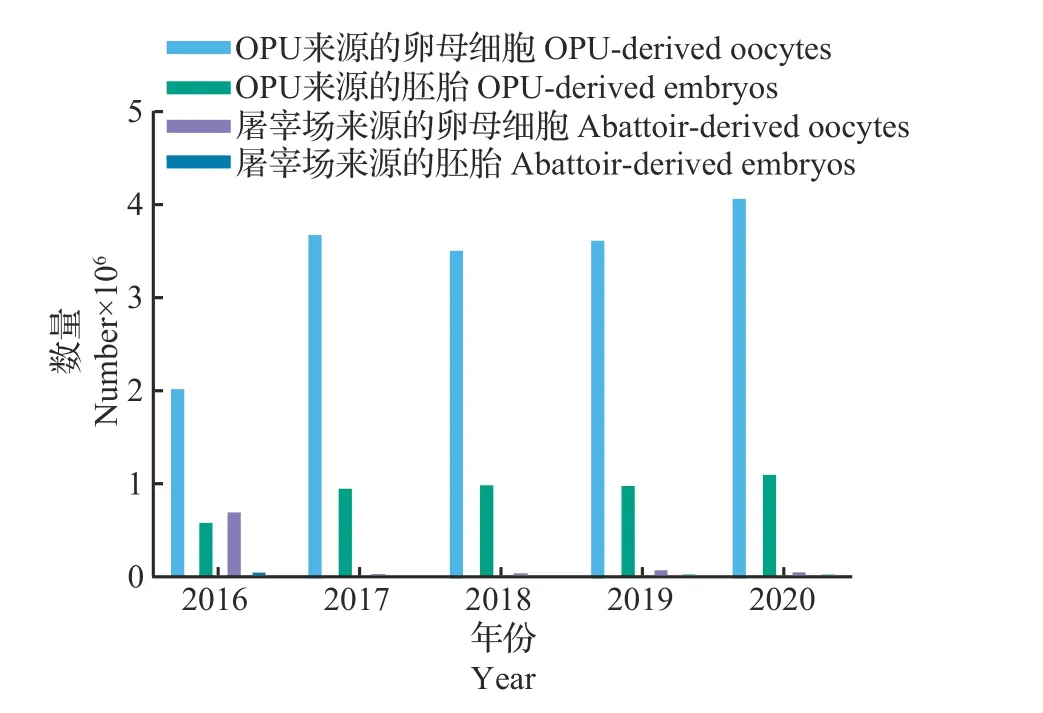
图1 IETS统计的2016—2020年全球范围内(不包含中国、印度和日本)通过OPU技术生产的牛卵母细胞及其生产的胚胎数量和屠宰场来源的牛卵母细胞及其生产的胚胎数量Fig.1 Numbers of bovine OPU-derived oocytes, OPU-derived embryos, abattoir-derived oocytes and abattoir-derived embryos in the world (not including China, India and Japan)from 2016 to 2020
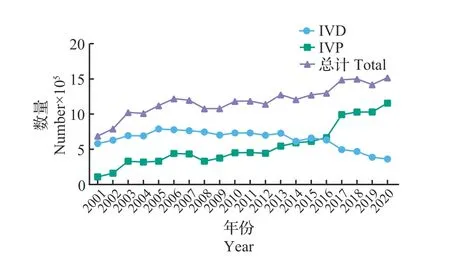
图2 IETS统计的2001—2020年全球范围内(不包含中国、印度和日本)牛IVD胚胎、IVP胚胎以及总胚胎数量Fig.2 Numbers of total bovine embryos, IVD embryos and IVP embryos in the world (not including China, India and Japan)from 2001 to 2020
2 影响OPU/IVP 的因素
牛体外胚胎的生产流程是从卵细胞的采集开始,随后经过卵母细胞的体外成熟(in vitromature,IVM)、体外受精(in vitrofertilization,IVF)以及受精卵的体外培养(in vitroculture,IVC)发育成可供移植的胚胎(图3)。由于体外胚胎生产过程完全是人为操作的,与自然繁殖过程有显著差别,因此体外胚胎生产过程中的每一步操作都可能对胚胎发育产生影响。
2.1 影响OPU 的因素
采卵方法对OPU 的效率有重要影响。卵母细胞的采集方法主要有手术法采卵、盲采法采卵、腹腔镜/内窥镜法采卵和超声波辅助法采卵。相较于另外3 种采卵方法,超声波辅助法采卵因其操作方便、对供体母牛刺激小、采卵数量多、效率高等优势,在商业化胚胎生产中被广泛推广使用。研究发现,利用超声波辅助法采卵可实现每头奶牛单次采卵10~20枚,而且卵丘卵母细胞复合体的回收率可达到60%~80%,远高于其他活体采卵方法[4]。
图3显示了利用超声波辅助采卵法收集牛卵母细胞的过程。借助于超声波信号的指示,将采卵针插入牛卵巢上充满液体的卵泡中,卵泡中含有卵母细胞,卵泡的内容物被抽出并通过过滤器进入收集管。随后,收集管被带进实验室,在显微镜下对卵母细胞进行清洗和筛选,取出卵母细胞进行计数和分级,筛选出的优质卵母细胞转入培养皿中进行成熟培养。卵母细胞成熟以后,在培养皿中进行体外受精。受精卵母细胞在培养皿中继续进行培养,最终部分受精卵可发育成可供移植的胚胎。因此,理论上影响胚胎生产流程的因素都会对体外胚胎的生产效率产生影响,研究清楚OPU/IVP的影响因素对提高体外胚胎的生产效率至关重要。
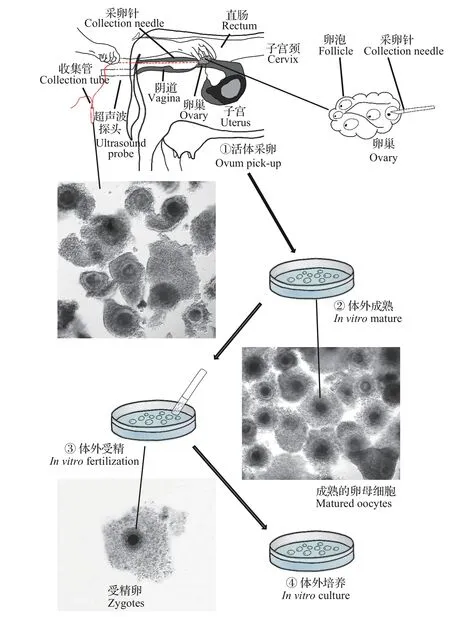
图3 牛的OPU/IVP流程Fig.3 Procedure of bovine OPU/IVP
OPU 的生产效率主要受到采卵的技术因素和供体牛的生理因素影响。技术因素主要包括采卵设备是否先进、采卵技师的操作熟练程度,生理因素包括供体牛的年龄、身体状态、发情周期、采卵频率、激素、优势卵泡等。技术性的影响因素可以通过购置先进的设备以及雇佣熟练的采卵技师来消除,而牛生理因素的影响则需要通过更多的科学研究来规避。
研究显示,牛的年龄会对采卵的数量和质量产生影响(表1)。犊牛在8 周龄左右就可以用于开展活体采卵,但是这个时期卵的质量要低一些。随着犊牛年龄的增长,卵泡数量明显增加,卵的数量和质量也会逐渐提高。但对于成年牛来说,随着年龄的增长,卵母细胞的数量和质量反而会有所下降。在采卵前24 h进行激素促排卵,卵的数量和质量都会得到明显提升[4-5]。牛发情周期的特点决定了采卵的时间间隔,奶牛的一个发情周期主要有3 个卵泡发育波,一般分布在发情后第3—4、9—10、15—16 天。在不同的卵泡发育波里,卵泡的发育数量和质量有很大差别。研究发现,在发情后第3—4 天进行采卵可以获得最多的卵母细胞[6]。MACHATKOVA 等研究发现由于优势卵泡在OPU后约3 d 出现,每次OPU 后3~4 d 的间隔可以防止优势卵泡对较小卵泡的卵母细胞的发育潜能产生负面影响[7]。与每周1 次OPU 相比,每周2 次OPU可以获得更多的卵母细胞,并且生产的胚胎质量更高[8]。
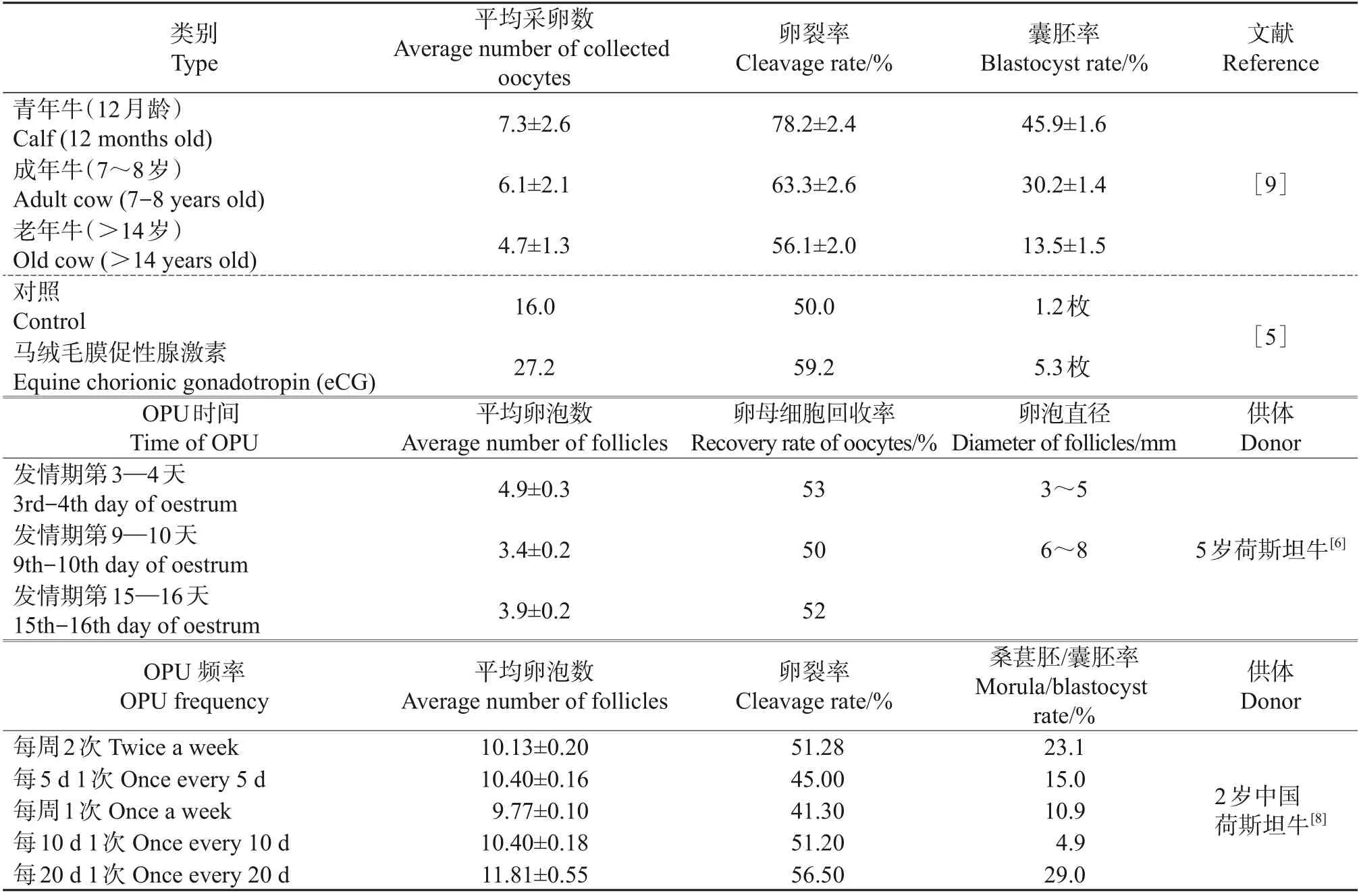
表1 部分牛的OPU实验Table 1 Some of bovine OPU experiments
2.2 影响IVP 的因素
IVP 是牛胚胎生产中最复杂的一步,图4 显示了牛卵母细胞体外受精后胚胎的发育过程,即受精卵阶段、2 细胞阶段、4 细胞阶段、8 细胞阶段、16 细胞阶段、32细胞阶段、囊胚阶段以及孵化囊胚阶段。以成熟的牛卵母细胞与精子结合那一刻为0 d 算起,受精卵经过7~8 d 可以发育成可供移植的囊胚,经过8~9 d可发育到孵化囊胚阶段。通过OPU收集的卵母细胞需要经过22~24 h 的体外培养(IVC)才能够成熟。成熟的卵母细胞经过体外受精(IVF)形成受精卵,受精卵在体外需要经过7~8 d才能发育成可供移植的胚胎[10]。从图4 可以看出,整个IVP过程都在体外进行,相较于母体环境,体外培养环境是次优的,因此理论上IVP 过程的每一步操作都会对胚胎发育产生影响。
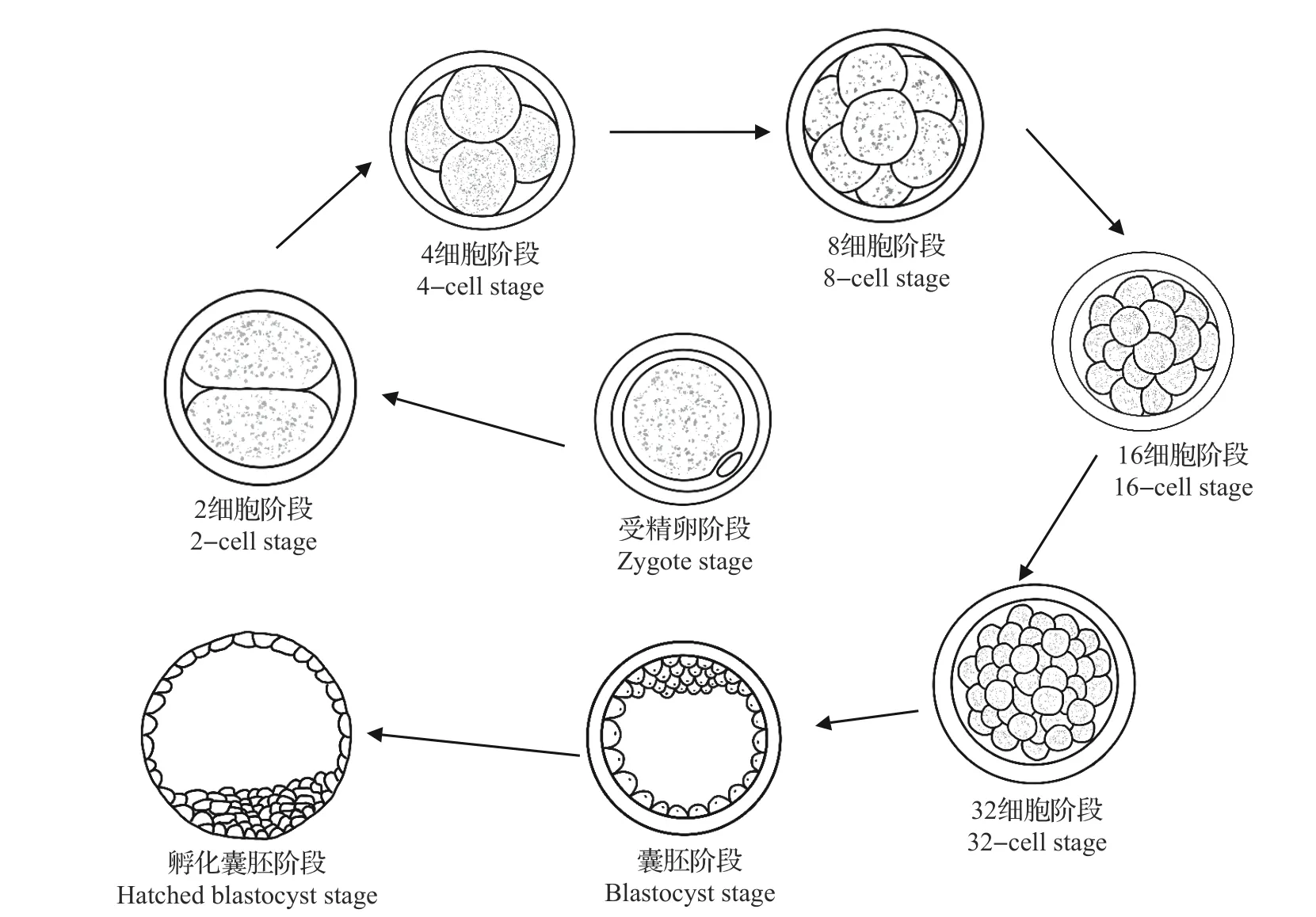
图4 体外生产的牛胚胎发育过程Fig.4 Developmental procedure of bovine embryos produced in vitro
卵母细胞体外成熟(IVM)是IVP的第一步,卵母细胞成熟的质量直接决定着后续IVP的成败。任何细胞的生长都离不开充足的营养物质、适宜的温度和合理的气相(氧气和二氧化碳浓度)环境。牛卵母细胞IVM需要非常全面的营养供给,目前最常用的培养基是TCM199 培养基(组织培养基)。此外,培养基中需要添加比例均衡的营养因子比如胎牛血清、卵泡刺激素、黄体生成素、雌二醇和表皮生长因子等,否则卵母细胞的成熟和发育将会受到影响[11]。温度和二氧化碳对卵母细胞的成熟也非常重要,温度和二氧化碳含量过高或者过低都会抑制卵母细胞成熟(表2),通常在牛卵母细胞成熟的环境中,温度应该控制在38~39 ℃,二氧化碳含量控制在5%[10]。
体外受精(IVF)是紧随IVM的另一个关键步骤,完全成熟的卵母细胞才能有较高的受精率,因此上述影响卵母细胞成熟的因素都会对受精效率产生影响。精子的质量和浓度也是决定受精质量的关键因素。在开展商业化的OPU/IVP技术实践时,通常先将公牛精液在屠宰场来源的卵母细胞上进行受精测试,以确定精液的最佳受精浓度。此外,精液的处理方式、受精环境以及外源因子也会对受精效率产生影响[12]。
体外培养(IVC)是整个IVP 过程中的最后一步,也是整个IVP 阶段最复杂的一步。影响体外胚胎发育的因素有很多,目前关于影响胚胎IVC的因素也还有很多未解之谜。受精卵自身的质量是影响体外胚胎发育的直接因素,研究发现有卵丘细胞的卵母细胞受精后的囊胚率要远比裸卵受精后的囊胚率高,而且卵丘细胞越完整囊胚率越高。另外,培养体系也是关系体外胚胎发育质量的关键因素之一。最常用的IVC体系是用TCM199培养基或合成输卵管液(synthetic oviduct fluid, SOF)培养基与各种类型的细胞如输卵管细胞、水牛鼠肝细胞、Vero细胞、颗粒细胞或条件培养基进行共培养。近年来,多数共培养体系已被放弃,取而代之的是低氧无细胞培养体系。IVC体系在过去几年中已经有了显著的改进,市场上已有多种商业化的培养基。除此之外,其他环境因素如培养的环境温度、气相(氧气和二氧化碳浓度)都会对体外胚胎的发育有影响(表2)。研究发现,温度为38.5~39.0 ℃,氮气含量控制在90%,二氧化碳和氧气含量均为5%的培养环境更有利于牛胚胎的发育[13]。
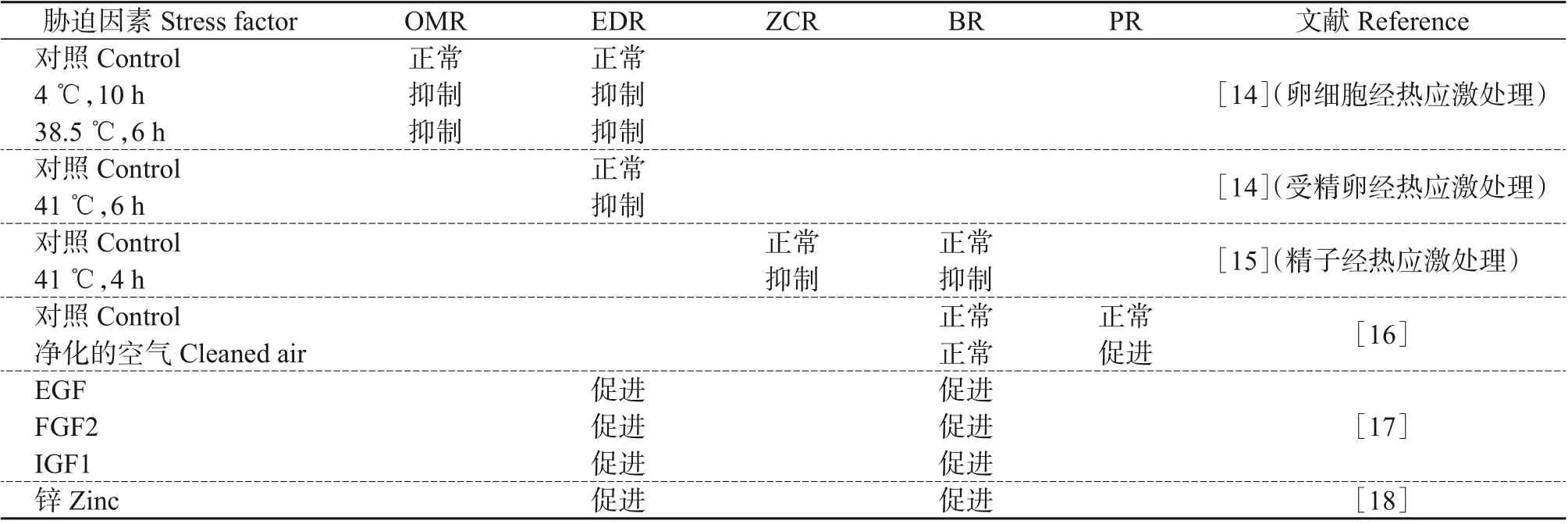
表2 部分牛的IVP实验Table 2 Some of bovine IVP experiments
3 OPU/IVP 技术面临的问题
3.1 生产效率低
虽然相比传统的辅助生殖技术如人工授精(artificial insemination,AI)、超数排卵和胚胎移植(multiple ovulation and embryo transfer, MOET)技术等,OPU/IVP技术繁殖效率高很多(每年AI技术平均繁殖1头,MOET技术繁殖20~25头,OPU/IVP技术繁殖80~100头),但是OPU/IVP技术的成功率仍然不够高。表3对比了不同生殖技术对每100枚未成熟的卵母细胞进行移植的成功率。从中可知,相比AI技术和MOET技术,OPU/IVP技术在受精率、囊胚率、妊娠率以及最后产犊的数目上都要低很多。

表3 不同生殖技术的相对成功率Table 3 Relative success rates of different reproductive technologies
3.2 胚胎质量低
OPU/IVP 技术的另一个问题是胚胎的妊娠率低,与超数排卵产生的胚胎相比,植入IVP 胚胎的牛妊娠率要低10%~40%。研究表明,只有约27%的IVP 胚胎受体牛能生产出存活小牛,其中约60%的IVP 胚胎的妊娠失败发生在胚胎植入后30~40 d。EALY等[22]总结了胚胎妊娠失败的原因,发现1/3 的妊娠失败是由受体牛相关的因素引起的,其余2/3 的妊娠失败则是由胚胎自身的因素引起,其中胚胎的发育异常是妊娠失败的主要原因之一。研究发现,IVP 的胚胎延长慢,胎盘直径变小,卵黄囊发育受阻。同时IVP胚胎也会出现边缘双核细胞和子叶发育异常以及胎盘血管形成异常等问题,从而大大增加了犊牛出生综合征发生的风险。
目前,对于上述IVP 胚胎发育异常的原因还没有明确的定论,但是有研究指出,OPU 过程中的卵巢刺激、卵泡抽吸,以及IVP 过程中的卵母细胞成熟、精子处理和胚胎培养这一系列外部的操作都会对胚胎产生刺激,从而引起胚胎不可逆的表观遗传紊乱和基因表达异常,最终导致IVP 胚胎在发育上出现各种问题[23]。通过对比体内胚胎生产(IVD)胚胎发现,IVP胚胎代谢更加旺盛,消耗的葡萄糖和氧气以及产生的乳酸都比IVD胚胎高[24]。IVP胚胎的超微结构也发生了一些变化,体外发育的囊胚与滋养层细胞之间的连接复合体发育不良,滋养层细胞上的顶端微绒毛发育不健全,并含有大量脂滴,而且透明带更薄[25]。此外,在人的胚胎中,染色质非整倍体是胚胎着床困难和自然流产的重要原因[26]。在非整倍体细胞中,染色质不稳定性(chromosome instability, CIN)的发生率达70%~90%,这表明染色质不稳定性与早期胚胎的死亡率密切相关。而CIN 的发生率在牛IVP 胚胎中明显高于IVD 胚胎[27]。通过OPU/IVP 技术生产的牛也面临着同样的问题。SIQUEIRA 等[28]研究发现IVP 生产的小牛在90~180 日龄的死亡率更高,而且IVP 生产的奶牛在第一次泌乳时产生的牛奶量以及牛奶中的脂肪和蛋白质含量更少。
4 提高OPU/IVP技术生产效率的途径
4.1 提高卵母细胞的数量和质量
提高活体采卵中卵母细胞的数目和质量,可以从根本上解决OPU/IVP 技术生产效率低的问题。研究结果显示,7~10 月龄的小母牛体内抗米勒管激素(anti-Müllerian hormone,AMH)的浓度与活体采卵的卵泡数量呈正相关(r=0.647)[29],因此可以通过检测AMH的浓度筛选出卵泡数量多的母牛进行活体采卵,从而提高卵母细胞的数量。实现卵泡发育波与促卵泡素(follicle stimulating hormone,FSH)刺激同步化可以显著提升卵母细胞质量和胚胎发育优良率。研究表明,在活体采卵之前对荷斯坦奶牛进行促卵泡素刺激,可以有效提高中等尺寸大小(直径6~10 mm)卵母细胞的比例[30]。在实际生产中OPU 卵母细胞需运输到实验室进行体外成熟(IVM)和后续的生产操作,因此长距离运输会影响卵母细胞成熟的效率和后续胚胎发育的潜能。最新研究显示,在运输中将卵母细胞存储在脱离了CO2的卵母细胞成熟液中,可以明显提高卵母细胞的成熟率和胚胎的发育率[31]。
在整个体外胚胎生产过程中,卵母细胞成熟后的质量关乎到胚胎发育的质量。GILCHRIST 等研究发现在体内成熟过程中,卵母细胞内的环腺苷单磷酸(cyclic adenosine monophosphate, cAMP)含量会短暂激增,但是这一变化在IVM 过程并没有发生,因此在IVM过程中添加cAMP可以提高受精率和囊胚率[32]。颗粒细胞对于卵母细胞的成熟至关重要,去除颗粒细胞,会使卵母细胞成熟率下降55.5%[33]。最近研究发现,Mx1 和STC1 可以作为衡量卵母细胞质量的分子标记,因此可以通过筛选带有Mx1和STC1标记的卵母细胞来筛选出高质量的成熟卵母细胞,从而提高生产效率[34]。此外,卵母细胞成熟液或胚胎培养液中补充胞外囊泡也可以提高卵母细胞成熟率和囊胚发育率[35]。
4.2 选择优质精子
精子携带着胚胎发育的另一半DNA,它与胚胎发育密切相关。精子的活力对于体外受精(IVF)极为重要。研究显示,相比于冻精,5 ℃下冷藏24 h的精子在牛胚胎发育中有更好的效果[36]。同等活力的精子,因其父本来源不同,对胚胎发育的影响也参差不齐。因此,如何衡量精子的品质显得尤为重要。最新研究发现,精子转录组分析显示,线粒体转录因子B2(transcription factor B2 of mitochondria,TFB2M)和体细胞细胞色素C(cytochrome C of somatopiasm,CYCS)在高受胎率的公牛精子中表达显著上调[34]。此外,TFB2M敲低也会显著减少囊胚的发育率,这都暗示着它可以作为筛选优良精子的分子标记[37]。
4.3 优化IVP 技术体系
胚胎培养是整个IVP 环节中最复杂的一环,大量的研究针对胚胎培养液进行了优化,以期模拟体内胚胎相似的生存环境。胚胎培养过程中,添加雌性生殖液体(输卵管和子宫分泌物)可以提高胚胎的发育质量,出生犊牛的异常率也显著降低[38]。此外,最近研究发现,通过包埋技术可以模拟出胚胎在子宫发育过程中的漂浮状态,这种更接近母体的状况可以提高胚胎的发育能力和质量[39]。培养过程中添加生长因子如白介素6(interleukin-6,IL-6)等也可以显著增大囊胚内的细胞数目,从而显著提高囊胚发育质量[40]。
5 小结与展望
OPU/IVP 技术具有快速扩繁的显著优势,它可以在短时间内获得大量的可供移植的胚胎,相较于传统的体内胚胎移植技术,通过IVP 技术产生的胚胎数目和母牛妊娠率都要高出3 倍多[19],从而实现了充分利用优质母牛的遗传资源的目的。此外,全基因选择育种与OPU/IVP 繁殖技术相结合可以进一步减少奶牛的世代间隔,便于生产高遗传性状的犊牛[41]。因此,在未来的牛繁殖管理过程中,OPU/IVP技术将发挥重要作用。
当然,OPU/IVP 技术仍然存在很多缺点和不足。在未来发展中,OPU/IVP技术需要克服的主要障碍是生产效率低、成本高及妊娠和犊牛的异常问题。如果OPU/IVP技术的效率提高一倍,则每个胚胎的培养成本将会减半。高妊娠率必然需要选择最佳时间、最佳发情阶段和最佳质量的胚胎[42]。前沿技术如高通量深度测序和代谢组学的发展,将有助于高质量卵母细胞和胚胎所需的条件的优化。此外,培养基配方的改进和动态化培养系统的实施也将创造出更加贴近母体子宫的内环境,从而尽可能地减少胚胎发育异常情况的出现[43]。
在未来,中国是乳制品和牛肉产品量增长最快的市场,但是目前中国的牛养殖水平与发达国家还存在一定差距,优良种畜主要依赖于国外进口,而且OPU/IVP 技术在中国的应用也仅仅处于起步阶段。为了减少对海外市场的依赖,提高牛养殖的整体水平,中国需要建立起自己的优良种畜繁殖体系。OPU/IVP 技术是目前较成熟的繁殖技术,因此,为了扩大优质种畜的规模,中国需要一批熟练操作OPU/IVP 技术的技术人员。繁殖效率是制约养殖规模的重要因素,因此OPU/IVP技术作为主要的繁殖技术在中国未来牛养殖产业市场潜力巨大。
