脊椎动物神经管背-腹图式形成中形态素的调控作用综述
2022-11-08刘聪徐鹏飞
刘聪,徐鹏飞
(浙江大学医学院,杭州 310058)
早在19 世纪末,Hans DRIESCH 发现从海胆胚胎中分离的2 个细胞可以发育成尺寸较小但结构完整的海胆胚胎,由此认为在早期发育的胚胎中存在能够指定每个细胞位置的坐标系统。1969 年,WOLPERT 构建了“法国国旗”模型,首次提出了胚胎发育过程中存在位置信息的概念[1],同时,该模型从分子水平上揭示了一种介导细胞位置调控和图式形成的信号,这种信号(形态素)能够通过给予位置信息来调控细胞命运,并进一步驱动大范围的形态发生。目前的研究对形态素已经有了一定的了解:形态素从局部组织分泌,通过扩散等方式形成浓度梯度,细胞响应不同浓度的形态素并被诱导表达相应的下游基因,从而进一步调控细胞命运的决定及其空间排布;同时,形态素下游的信号也可进一步通过调控细胞增殖、分化和迁移等过程来调控不同细胞群之间边界的形成。
脊椎动物中枢神经系统的前体——神经管的形成是一个复杂而有序的发育过程,需要正确的细胞命运诱导和空间位置调控。科学家们已经证实许多形态素参与调控神经管的发育,包括参与神经管前-后图式形成的维甲酸(retinoic acid,RA)、成纤维细胞生长因子(fibroblast growth factor, FGF)、生长分化因子(growth differentiation factor,GDF),以及参与神经管背-腹图式细胞分化和位置决定的Wingless-Int(Wnt)、骨形成蛋白(bone morphogenetic protein,BMP)和音猬因子(Sonic hedgehog,Shh)[2](图1)。
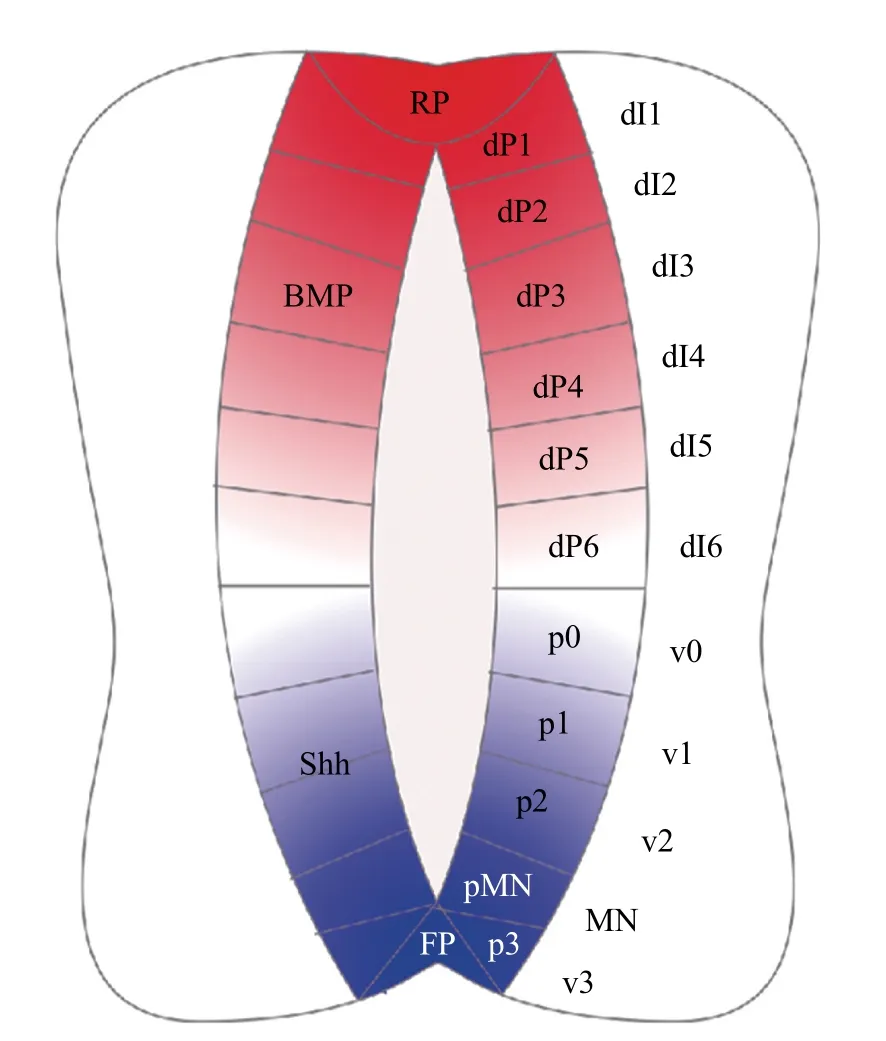
图1 脊椎动物神经管背-腹图式Fig.1 Dorsal-ventral pattern of vertebrate neural tube
Shh信号源自脊索并参与早期胚胎发育和身体图式的形成。实验证明,Shh信号负责调控神经管腹侧的细胞图式,抑制Shh信号会导致鸡、斑马鱼和小鼠胚胎中严重的神经管背-腹图式缺陷[3-4]。另外,体外实验表明,当神经前体细胞暴露于不同浓度的Shh蛋白中时,神经管腹侧细胞特异性基因的表达会显著增加[5]。BMP信号在早期胚胎发育中也发挥重要作用,它与其自身拮抗基因相互作用,将胚胎的3个胚层细分为具有不同发育命运的区域。在神经管发育过程中,不同浓度的BMP信号会沿着背腹轴诱导神经管不同区域细胞命运的形成。抑制BMP 信号会导致鸡和斑马鱼胚胎神经管背侧细胞图式的严重缺陷[6],BMP信号(如BMP4/7)或其受体的过表达则会导致大量的背侧神经祖细胞产生[7]。
近年来,类器官培养技术的兴起进一步推动了对脊椎动物神经管形成中BMP和Shh这2种信号的研究。类器官作为一种在体外由全能/多能干细胞培养的三维细胞组织,具有相应体内器官的主要特征和一定的功能,其为探索形态素浓度梯度在胚胎发育中的作用提供了理想的体外模型。2019 年,LORENZ 实验室通过模拟Shh 信号浓度梯度,成功诱导产生了多种前脑细胞类型,这些细胞具有与体内前脑图式类似的空间分布,在一定程度上形成了前脑的背-腹和前-后图式[8],为探究前脑发育提供了优秀的体外模型。
在本综述中,我们主要从BMP和Shh配体的产生及浓度梯度的形成、信号转导和细胞应答、图式建成的调控机制这3 部分出发,讨论BMP 和Shh 信号作为形态素在脊椎动物神经管发育中的作用。尽管这3 部分在神经管发育过程中紧密相连,不能单独考虑,但我们希望这种划分能够为脊椎动物神经管发育中BMP 和Shh 信号的系统研究提供方便的框架。同时,我们也总结了近年来利用形态素构建神经管类器官的一些研究工作。
1 神经管发育中BMP 信号和Shh 信号反向平行浓度梯度的形成
神经管来源于早期胚胎的神经板或神经上皮。在胚胎发育的原肠胚阶段,BMP配体浓度梯度呈现为腹侧较高而背侧较低。这种从腹侧至背侧的BMP 浓度梯度的建立依赖于胚胎中表达于背侧的BMP 抑制蛋白的作用,主要为背组织者(dorsal organizer)分泌的Noggin[9]、Chordin[10]和Follistatin[11]等。背侧BMP 信号的抑制使得神经外胚层从原始外胚层中特化产生[12],然后在原肠运动过程中细胞向背中线汇聚,导致外胚层增厚并产生神经管的前体——神经板,随后神经板通过称为神经发生(neurulation)的形态重塑过程形成神经管。
脊椎动物中两栖类、鸟类和哺乳类等的神经管形成方式可分为2 种类型:一种是初级神经发生(primary neurulation),产生体轴前部的神经管,在未来发育为中枢神经系统的脑;另一种是次级神经发生(secondary neurulation),作为体轴后部神经管的形成方式,在未来发育为中枢神经系统的脊髓[13]。
初级神经发生包括神经板的折叠以及在中线处的融合(图2A~C,H)。神经板在原肠运动的汇聚作用下弯曲折叠形成神经褶(neural fold)[13],这种形态的发生依赖于神经板上的特殊结构——铰链点:一种是中线铰链点(median hinge point,MHP),位于神经板的腹侧中线,是存在于底板的一组特定细胞,可使神经板从中线处弯曲而产生具有V 形横截面的神经沟(neural groove);另一种是成对的背外侧铰链点(dorsolateral hinge point, DLHP),位于神经板两侧,依赖于DLHPs的折叠,神经板形成纵向沟,且神经板两侧末端在背中线处彼此相对。随后,神经褶的边缘在中线处汇合并融合,形成封闭的中空神经管[13]。
次级神经发生形成未来中枢神经系统的脊柱尾部到骶骨中部的部分(图2A,D,E,H)。次级神经发生与初级神经发生差异较大,前者不是通过神经板折叠的方式形成,而是神经板细胞在原肠运动的汇聚作用下向中间聚集,并排列成与初级神经管相连的实心柱状结构——髓索,而与初级神经管相连的中央管腔的形成依赖于髓索中多个小腔的进一步扩大和随后的融合[13]。
然而,在斑马鱼等硬骨鱼(teleost fish)中,其神经管的形成不同于上述2 种神经发生方式,而是采用一种类似于次级神经发生的方式(图2A,F~H)。首先,神经板细胞在原肠运动的汇聚作用下向背中线聚集并内化,形成实心的神经龙骨(neural keel)。然后,神经龙骨进一步发育为坚固的神经条(neural rod);而神经管中央空腔的形成依赖于神经条中线两侧的神经管细胞顶端特化以及随后沿着中线的对称分裂。最后,神经管前部发育为脑,后部发育为脊髓,从而形成完整的中枢神经系统[14]。
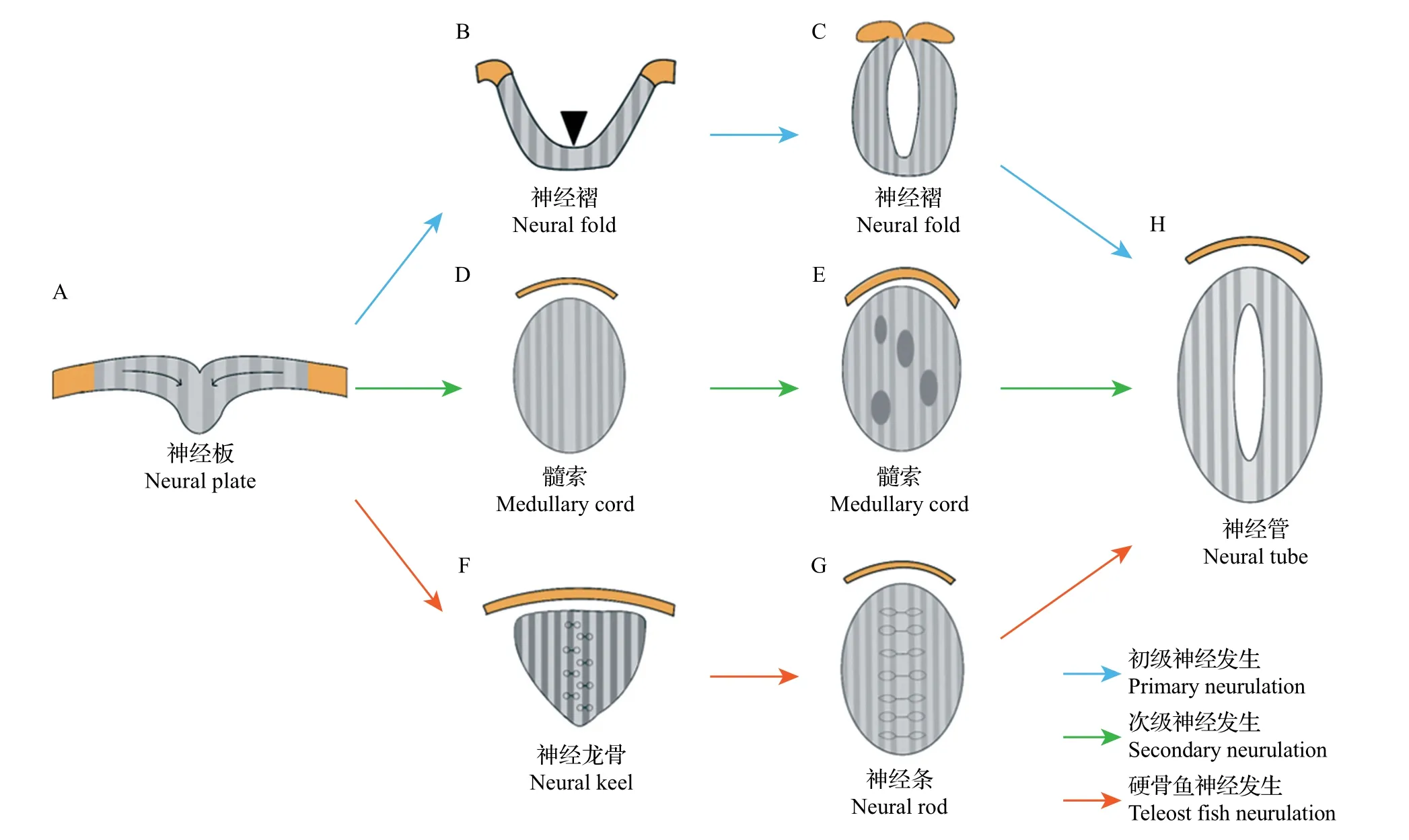
图2 神经管的形成过程Fig.2 Formation process of neural tube
这3种神经发生方式最初都是由原肠胚时期的汇聚延伸运动驱动的。在这种强烈的细胞迁移过程中,最初胚胎中从腹侧到背侧(从高到低)的BMP浓度梯度转变为神经管中从背侧到腹侧(从高到低)的浓度梯度[13-14](图3)。而在神经管形成过程中,Shh从腹侧脊索中分泌出来并扩散,建立了神经管中从腹侧至背侧的浓度梯度。BMP和Shh这2种形态素在神经管中形成了反向平行的浓度梯度,并进一步对神经管的背-腹图式进行诱导。在神经管形成之后,顶板和底板作为神经管中新的信号源,分泌形态素并维持其浓度梯度,沿着背-腹轴将神经祖细胞诱导划分为11个区域(图1),包括6个背侧祖细胞域(dP1~dP6)和5 个腹侧祖细胞域(p0~p3和pMN),且分别进一步分化为相应的背侧中间神经元群(dI1~dI6)和腹侧中间神经元群(v0~v3 和MN)[15]。
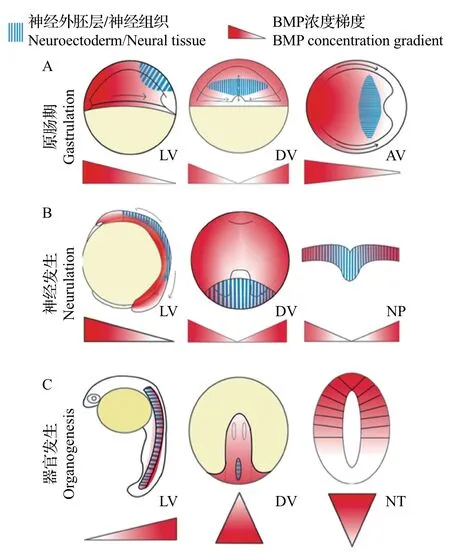
图3 斑马鱼早期发育中BMP浓度梯度转换过程Fig.3 BMP concentration gradient shifting process during the zebrafish early development
2 BMP 信号与神经管背侧细胞命运
BMP 是转化生长因子-β(transforming growth factor-β,TGF-β)家族的成员之一,在胚胎发育(如细胞增殖、分化和迁移等过程)中起着重要作用[16]。有关证据表明,BMP信号参与了从神经外胚层产生阶段开始的整个神经管的形成过程,以及对神经祖细胞和下级神经元的分化和空间排布的调控[17]。以下部分将重点总结BMP 信号在脊椎动物神经管图式形成中的作用及调控机制。
2.1 BMP 信号的产生
在神经管中,BMP配体由位于神经管背中线的顶板分泌产生,并通过扩散形成浓度梯度。顶板作为BMP配体的信号源,形成于神经板的折叠闭合过程。随着神经板的折叠,神经板边界(神经外胚层和非神经外胚层之间的较宽区域)移动到神经管的背侧[18](图4),同时,顶板祖细胞也向神经板边界迁移,到达未来神经管最背侧中线位置。神经板边界具有较高水平的BMP 活性[19],在这种细胞运动中,顶板祖细胞暴露于活性水平更高的BMP信号中,从而分化为成熟的顶板细胞[18,20]。较高浓度的BMP信号诱导顶板细胞表达Hairy 1蛋白,该蛋白可以通过抑制Foxd3(神经嵴细胞标记物)的表达来巩固顶板的细胞命运,促进其退出细胞周期和上皮-间质转化[18,20]。
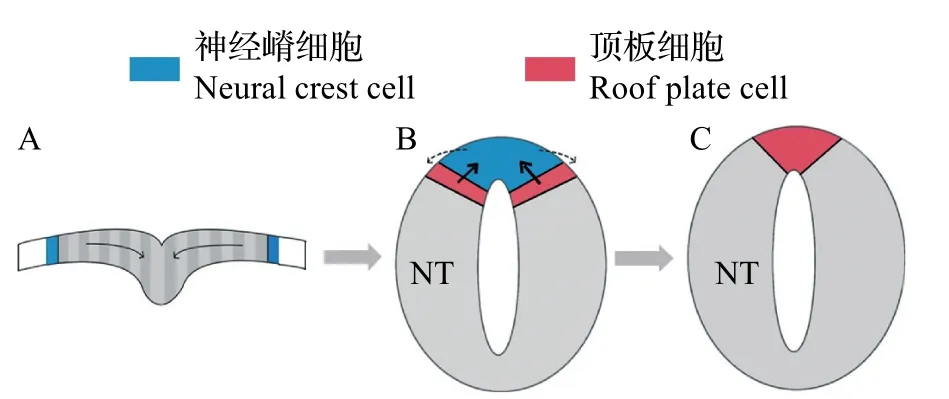
图4 神经管顶板的形成过程Fig.4 Formation process of roof plate in neural tube
2.2 BMP 信号转导和细胞应答
2.2.1 BMP 配体
在BMP 信号转导过程中,BMP 配体通过二硫键之间的共价键连接,以二聚体的形式发挥作用[21](图5)。细胞培养实验表明,BMP 的异二聚体比同二聚体具有更高的活性[22]。同时,分子遗传学研究表明,斑马鱼胚胎中同时存在BMP同二聚体和异二聚体,但只有Bmp2b/Bmp7a 异二聚体可以磷酸化TGF-β信号转导途径中的关键信使Smad1/5[22]。并且Bmp2b/Bmp7a 异二聚体可以通过与Alk3/6 和Alk2形成复合物来参与神经管背-腹图式的形成。
2.2.2 BMP 受体复合物
BMP 信号由胞外向胞内的转导依赖于细胞膜上的Ⅰ型和Ⅱ型受体复合物[23],这2 种类型的受体都包含作为配体结合位点的细胞外结构域和具有丝氨酸/苏氨酸激酶(serine/threonine kinase,STK)活性的细胞内结构域。在与BMP配体结合后,Ⅱ型受体会磷酸化Ⅰ型受体[23],而磷酸化的Ⅰ型受体可以激活细胞内的下游介体[16](图5)。
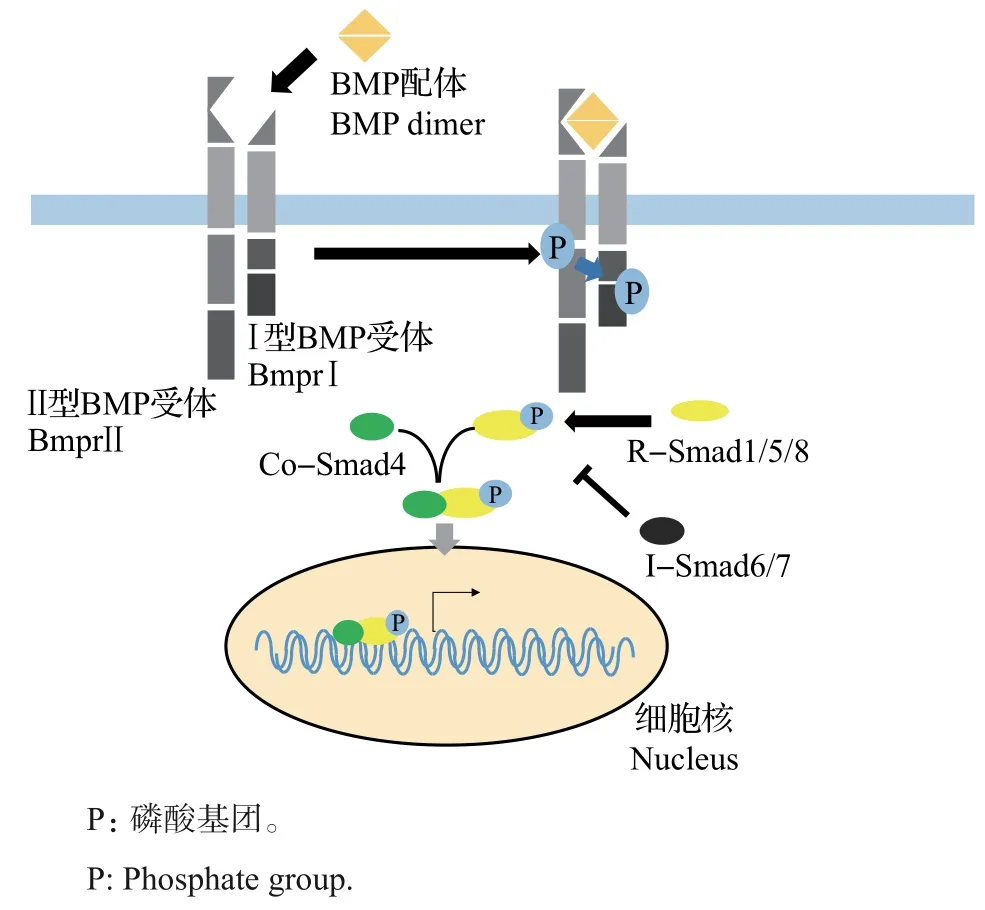
图5 BMP信号转导Fig.5 BMP signaling transduction
目前,已经鉴定出6种不同的BMP信号通路受体,包括Ⅰ型受体BmprⅠ(BmprⅠa 或BmprⅠb)和ActRⅠA,Ⅱ型受体BmprⅡ和ActRⅡ(ActRⅡA 或ActRⅡB)[24]。研究表明,在神经管发育中主要的功能性BMP受体复合物是BmprⅡ/BmprⅠ,在BmprⅠ突变体小鼠中存在dP1祖细胞域的缺失及dP2祖细胞域的明显减少[25],而过表达BmprⅠ则会导致鸡或小鼠背侧和中部神经元命运的增加及腹侧神经元命运的减少[26-27]。
2.2.3 Smads 蛋白
Smads蛋白作为BMP信号通路中的胞内组分,参与BMP 信号的胞内转导。目前,已经鉴定出的Smads蛋白共有3种,包括激活受体的Smads(receptor activated Smads,R-Smads)、抑制性Smads(inhibitory Smads,I-Smads)和辅助型Smads(common mediator Smads,Co-Smads)[23]。
R-Smads 蛋白作为胞内介体,负责进行细胞内信号转导,具有2 个结构域:N 端的MH1 结构域和C 端的MH2 结构域。作为R-Smads 在信号转导过程中行使功能的核心,这2 个结构域都非常保守。其中,MH1 结构域具有DNA 和蛋白质结合功能,MH2 结构域具有受体识别功能并能够被Ⅰ型受体磷酸化,从而协助Smads 复合物入核[16]。当RSmads 蛋白的C 端被磷酸化后,MH1-MH2 自抑制结构被破坏,暴露出核定位序列,随后与Co-Smad4结合并作为复合物迁移到核中,从而调控下游基因的表达[16](图5)。
特定于BMP信号通路的R-Smads包括Smad1、Smad5 和Smad8[28]。有实验发现,不同的R-Smads在神经管图式形成中具有不同的功能。在鸡胚胎中敲低Smad1 或Smad5 可以减少dI1~dI6 中间神经元的命运,其中最为明显的是dI1、dI3和dI5中间神经元[2],而使用短发夹RNA(short hairpin RNA,shRNA)敲降鸡胚胎中的Smad8 仅能减少dI1 中间神经元的命运[28]。在小鼠的功能丧失实验中,背部神经元命运需要Smad5,而Smad1 在dI1 轴突生长中起重要作用[28]。
I-Smads 在BMP 信号通路中起负调控作用[29](图5),已被鉴定出的I-Smads包括Smad6和Smad7。Smad6 被发现是几乎在所有脊椎动物中保守的I-Smads,能够竞争性地与磷酸化R-Smads结合,从而阻止其与Co-Smad4形成复合物。而Smad7能够通过与R-Smads竞争来激活BmprⅠ,从而抑制BMP信号向胞内转导。同时,Smad6 和Smad7 都可以与Smuf1 缀合以促进BMP 受体的降解[29]。实验发现,在神经管的不同神经元中表达的不同的I-Smad 似乎具有不同的功能:在鸡神经管发育过程中,Smad7在脊髓中部新分化的神经元中高表达,而Smad6在脊髓背部和中部的成熟神经元中高表达;在背侧激活Smad7能够抑制dI1和dI3中间神经元的分化,而Smad6的异位表达能够导致dI1轴突生长的缺陷[30]。
对于Co-Smads 在神经管发育方面的研究非常有限,仅有实验表明,通过小干扰RNA(small interfering RNA, siRNA)敲降雏鸡中的Smad4 会导致dI1和dI3中间神经元的缺失[6]。
2.3 BMP 调控背-腹图式形成的机制
2.3.1 BMP 浓度梯度模型
关于BMP 信号调控神经祖细胞产生具有空间性的命运决定和排布的机制,最被认可的观点是BMP作为一种形态素,其浓度梯度会影响背侧神经祖细胞命运的决定并调控3 种感觉神经元(dI1、dI2和dI3)的分化[4]。
在BMP 浓度梯度模型中,高水平的BMP 活性有利于背侧神经祖细胞命运的产生,而低水平的BMP活性则有利于靠近腹侧的神经祖细胞的命运决定。2002年,NISWANDER实验室的体内功能获得性实验结果支持了这一模型,他们在实验中成功利用不同浓度的BMP 信号分别诱导了dI1、dI2 和dI3神经元的产生[27]。大量实验结果也表明,正确的BMP浓度梯度是维持神经管背侧和腹侧神经元之间的平衡所必需的。在雏鸡或小鼠胚胎中过表达BmprⅠa和BmprⅠb会导致背侧和中间区域神经元数量的增加及腹侧神经元的缺失[26-27],而BmprⅠa 和BmprⅠb 的缺失则会导致背侧dI1 中间神经元的完全丧失及dI3 和dI4 中间神经元的增加[25]。Noggin作为BMP信号通路的抑制基因,能够在胞外竞争性地结合BMP 配体。Noggin的过表达会导致dI1 中间神经元的缺失和dI2~dI4 中间神经元的增加[6]。Follistatin作为另一种BMP 信号通路的抑制基因,其过表达能够导致dP1~dP3 祖细胞域命运的减少[31]。Bmp4/7 或激活的BmprⅠ转基因过表达则会导致dI1中间神经元的增加[7]。
2.3.2 BMP 配体诱导模型
不同物种中参与神经管背-腹图式形成的BMP配体是不同的,并且有实验发现,在鸡的神经组织外植体中,BMP4 转染的COS 细胞能够诱导dI1 神经元命运的产生,而用稀释的BMP4 条件培养基处理却不能有效地诱导dI3神经元的命运[32-33],表明低浓度的BMP4可能无法诱导dI3神经元。因此,研究人员提出了BMP配体诱导模型来解释神经管背-腹图式的形成。该模型认为不同的BMP 配体参与诱导不同神经祖细胞域的产生和空间排布,如BMP4和BMP7 在鸡神经管发育中发挥作用,而在小鼠神经管发育中则是BMP5、BMP6 和BMP7 发挥作用[32-33]。同样,在鸡胚胎中敲低BMP4仅导致dI1 神经元的减少,而敲除BMP7则明显减少了dI1、dI3和dI5 神经元的数量[17,34]。该机制可以通过显性负型Ⅰ型BMP受体实验来解释:通过电转激酶结构域截断形式的BmprⅠ发现,不同的BMP 配体可以激活不同的Ⅰ型受体并调节细胞周期,从而参与神经元分化的调控。小鼠中BMP6和雏鸡中BMP7诱导顶板的形成均是通过BmprⅠa发挥作用。在小鼠和雏鸡中,dP1 祖细胞都由BMP4 和BMP7 通过BmprⅠa或BmprⅠb 诱导,而dI1 神经元则只能由BMP4 诱导。雏鸡中dI2神经元只能由BMP4诱导,而dI3神经元可以由所有BMP配体诱导,但dI4~dI6在任何BMP配体作用下都未能被诱导,说明可能存在其他机制来诱导偏向于神经管中部的神经元命运[33]。
2.3.3 时间形态素诱导模型
一些研究发现,对于神经管这样一个复杂的三维组织,不仅BMP 信号的空间分布参与背-腹图式的形成,靶细胞在信号中的暴露时间也参与细胞命运的调节。在雏鸡神经板外植体诱导实验中,长时间的Bmp4信号暴露会导致较多的背祖细胞命运的产生,而在体内,在不同阶段抑制BMP 信号会导致不同的缺陷表型,早期抑制BMP 信号会导致整个dI1~dI3 神经元的缺失,而后期抑制则能够依次产生dI3和dI2神经元[35]。
3 Shh 信号与神经管腹侧细胞命运
Shh 是经典刺猬(hedgehog)信号中最重要的糖蛋白之一,在脊椎动物肢体、神经系统、胃肠道及心脏等各种重要系统、器官的发育过程中起着关键作用。此外,相关研究表明,Shh的激活也参与了肿瘤的转移以及血管的生成和存活[36]。在本综述中,总结了Shh在脊椎动物神经管发育中的作用及调控机制。
3.1 神经管中Shh 蛋白的表达
在脊椎动物神经管发育过程中,Shh 蛋白由位于神经管腹侧的脊索和底板分泌产生[37]。在原肠胚时期,Shh在中胚层处表达,随着中线处中胚层形成实心棒状的脊索,Shh 开始在脊索中表达[37]。在羊膜动物中,由脊索分泌的Shh 在神经管中诱导了底板的形成,且其是Shh 产生和分泌的第2 个中心[37]。然而在其他脊椎动物中,底板的形成机制似乎与脊索衍生的Shh信号的相关性较小[38]。
3.2 Shh 浓度梯度的形成
与其他形态素相似,Shh 信号浓度梯度的形成涉及3 个主要问题:1)如何以活性形式产生和分泌Shh 配体;2)Shh 配体如何在组织中扩散;3)过量的Shh 如何降解并从组织中去除。其中,每个过程都有特定的分子途径进行精确调控,并构成了复杂的Shh浓度梯度形成和维持系统。
3.2.1 Shh 的产生和扩散受脂化作用的影响
活性Shh 配体的产生是一个复杂的过程。Shh蛋白最初在分泌细胞中被翻译成45 kDa 的Shh 前体,随后经过蛋白酶的水解作用产生2个较短的肽,即19 kDa的N端区域(Shh-N)和26 kDa的C端区域(Shh-C)(图6),抑制这种蛋白酶水解切割能够使Shh信号失活[39]。在水解切割过程中,羧基末端会连接胆固醇,这是Shh-N的分泌、迁移和膜插入所必需的[39],缺乏胆固醇修饰的Shh会更快地在组织中扩散和渗透[40]。水解切割之后,Shh-N与Shh-C分离,酰基转移酶Skn会催化棕榈酰基与Shh-N的N末端结合[39],从而增强Shh信号的诱导能力[41]。非棕榈酰化形式的Shh活性较低[41],同时,这种修饰对于脊椎动物神经管的发育是必需的,因为Skn-/-小鼠胚胎表现出与Skn-/-小鼠相似的畸形——神经管中存在严重的背-腹图式混乱[41-42]。Shh的双重脂化作用(图6)确保了其在脊椎动物神经管发育过程中的扩散性和对远距离信号转导的活性[40-41],为诱导神经管腹侧细胞图式提供了支持。
3.2.2 Shh 的分泌依赖Disp1 跨膜蛋白的协助
脊索和底板细胞中活性Shh配体的分泌需要跨膜蛋白Disp1的协助(图6)。Disp1上存在固醇感应结构域(sterol-sensing domain,SSD),可以识别胆固醇修饰的Shh-N,从而促进其分泌以及在组织中的长距离信号转导[43]。在纯合的Disp1突变小鼠中,神经管的背-腹图式,尤其是腹侧部分被严重破坏,并且没有检测到呈活性状态的Shh配体[43]。然而也有实验检测出存在缺乏胆固醇修饰的Shh配体的非Disp1依赖性分泌途径[44],对此的解释是:Disp1可以促进具有长距离和高活性信号转导能力的活性Shh的组装,而在短距离信号转导中,非Disp1依赖的途径被激活,可调控神经管腹侧部分高浓度的Shh信号[40]。
3.2.3 硫酸乙酰肝素蛋白聚糖协助Shh 扩散
Shh沿着神经管背-腹轴的扩散受几种细胞外蛋白的调节,这些蛋白可以与Shh配体结合,从而限制双脂质修饰的Shh-N 的扩散,并改变其降解速率。硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)是细胞外基质的一种保守成分,被认为是调控Shh 扩散的胞外蛋白[45]。功能性HSPG 的形成依赖于由多种催化酶驱动的复杂翻译后修饰过程,硫酸酯酶1作为催化过程中的关键酶,能够催化HSPG的硫酸化,具有与高浓度的Shh蛋白和Nkx2.2(脊椎动物腹侧神经管中的保守标记基因)相同的表达模式[45]。
3.2.4 神经祖细胞上的膜蛋白协助Shh 浓度梯度的建立
在Shh 从神经管腹侧扩散到背侧的过程中,其与几种跨膜蛋白之间的相互作用被认为是协助其浓度梯度形成的不可忽略的因素(图6)。根据这些跨膜蛋白对Shh 信号转导的作用,可将其分为2 种类型:1)抑制性蛋白,包括Patch1 和Hhip1;2)促进性蛋白,包括Cdo、Boc(Cdo的同族)和Gas1[46-48]。
Patch1 在神经祖细胞膜上表达,是Shh 蛋白的受体,可通过螯合配体和促进配体降解的方式引起Shh信号的细胞自主性抑制[49]。随着Shh蛋白在组织中的扩散,螯合作用会逐渐降低Shh配体的利用率,导致受体细胞接收到的Shh配体减少,从而使其信号转导能力减弱[49]。当这些由Patch1 和Hhip1 介导的配体依赖性拮抗作用(ligand-dependent antagonism,LDA)被阻断时,呈现出p0~p2 神经祖细胞的缺失及p3 和pMN 神经祖细胞的增加[49]。在Shh 配体扩散过程中,内吞作用和降解作用在远离信号源的区域中增强,减弱了Shh信号的相对强度,与螯合作用一起维持Shh的浓度梯度[50]。
上述Shh信号的转导和浓度梯度形成的调控机制都是通过细胞自主途径进行的。然而,近年来的研究发现,Hhip1 存在通过硫酸乙酰肝素相互作用对Shh 信号转导进行调控的非细胞自主抑制途径[51]。这一发现表明,尽管Shh 在胚胎发育过程中的作用机制已被很好地理解,但仍可能存在其他调节Shh信号转导的新机制。
针对作用于Shh信号转导途径的3种促进性蛋白Cdo、Boc和Gas1,它们能够促进腹侧细胞命运的决定,协助Shh 对腹侧细胞图式形成的调控。Cdo最初是在神经管的腹侧中线外表达,并与底板特化有关,敲除小鼠的Cdo基因会导致底板细胞减少[48]。而Gas1基因的缺失会导致胚胎的神经管腹侧细胞图式的缺陷,并且这种缺陷在敲除Shh的胚胎中更为严重[47]。此外,Gas1-/-和Cdo-/-双突变小鼠胚胎的底板、p3或pMN祖细胞域的缺失表明这2种蛋白对神经管发育具有协同作用[47]。Cdo、Boc和Gas1基因突变小鼠已经证实了这3种膜蛋白在神经管腹侧细胞图式形成中的必要性[46-48],并表明这3种蛋白可能在功能上存在相互补偿作用[47-48]。同时,这3种蛋白的表达均受到Shh 信号的抑制作用,表明存在Shh信号的负反馈调节来为局部Shh浓度的波动提供补偿机制,从而为形成和维持腹-背浓度梯度提供了一定程度的稳定作用。此外,还发现了一些分子(如Scube2)参与调节Shh的扩散以及浓度梯度的形成[52],但关于其功能的研究仍然有限。一个非常有趣的发现是,Scube2 可以在Shh 分泌细胞的细胞膜上与硫酸乙酰肝素形成释放复合物,以协助Shh的分泌[52]。
由于有关Shh结合伴侣及其相应机制的大量研究都是基于肿瘤模型,因此,后续应更关注在神经管器官发生中验证Shh 信号的这些已知结论,以对Shh 信号进行更全面的探究。此外,动物模型实验和数学建模的结合将有助于对Shh浓度梯度的形成过程进行更好地概括。
3.3 Shh 信号的转导和细胞应答
当Shh信号在神经管中形成从腹侧到背侧的浓度梯度后,神经前体细胞可以感知并响应Shh信号,从而产生整齐排列的腹侧细胞图式。其中,信号转导和细胞应答的诱导是一个高度调节的过程,Shh配体的浓度和持续时间都可以参与神经前体细胞命运的调控。
3.3.1 细胞内信号转导的开关——Smo 蛋白
在信号转导的开始,胞外Shh 配体能够与受体细胞上的跨膜蛋白Patch1 结合,从而解除对另一个跨膜蛋白Smo 的抑制作用[53]。随后,Smo 的激活将细胞外Shh信号转导过程与其细胞内信号转导途径的激活联系起来(图6)。Smo激动剂和拮抗剂在神经细胞中的协同应用表明,Smo 的逐级激活(阶梯式)而不是渐进激活(连续式)可能是细胞对Shh 浓度梯度响应的重要机制[5]。
在脊椎动物中,纤毛对Shh细胞内信号转导具有重要作用[54]。在没有Shh信号的情况下,位于纤毛底部的Patch1受体会抑制Smo向胞内转运,从而阻止下游信号激活。而当活性Shh配体与Patch1结合后,Patch1 会发生内化和降解,从而解除对Smo 的抑制作用,并进一步在初级纤毛膜上积聚更多的Smo[54]。
为了更好地理解Shh的细胞内信号转导过程,仍需要对Smo激活后的下游机制做更多的研究。在过去的20年中,已经确定了位于Smo下游的几个关键成分[54]。Cos2(Costal 2)是果蝇中一种与微管相关的驱动蛋白样蛋白,可以直接与Smo的胞内结构域相互作用[55],在没有Shh信号的情况下,Cos2可以阻断Smo 下游的信号转导。此外,Cos2 还可以激活Gli(glioma-associated oncogene)家族锌指蛋白直系同源物Ci(cubitus interruptus),这是Shh转录激活功能所需的细胞质锌指蛋白[56]。但是,脊椎动物中的2 个Cos2直系同源基因Kif和Kif27似乎并不参与Shh信号转导。在哺乳动物细胞中使用shRNA进行的敲低实验进一步支持了这种差异[57],表明哺乳动物中Cos2相关蛋白的功能与Shh信号转导无关,这可能是因为脊椎动物的Smo含有与果蝇的Smo截然不同的Cos2相互作用的结构域。然而,在某些脊椎动物(如斑马鱼)中,通过对反义吗啉代(morpholino)寡核苷酸介导的Kif7(Cos2直系同源物)的敲低实验发现,Kif7-KD鱼系与野生型斑马鱼之间存在一定差异[58]。类似地,当通过抑制Gli 入核及调节基因表达时,Sufu(suppressor of fused)可以与Cos2 一起发挥作用,进一步抑制下游信号的转导[59]。
3.3.2 分级Gli 活性介导分级Shh 信号的转导
Shh信号通过Smo在细胞内进行转导后,能够催化不同类型的Gli作为转录因子进入细胞核并调节基因表达,以实现Shh信号对细胞命运的调控作用[56](图6)。在脊椎动物中,介导Shh 信号转导的Gli 有3种(Gli1~Gli3)[60-61]:Gli1为依赖于Shh信号的促进型转录因子;Gli3能够抑制Shh信号的转导和相关基因的表达;与Gli1和Gli3不同,Gli2具有强大的基因激活和抑制功能,作为促进型转录因子,Gli2能够被催化成抑制形式,但其阻遏物活性不受Shh的调节,从而具有独立的抑制Shh信号转导的能力[60]。目前的实验表明,Gli2 在神经管中的主要作用是激活性的,在Gli2-/-小鼠胚胎中,神经管腹侧,尤其是底板中的细胞类型受到严重破坏[61]。Gli3 在Shh 信号转导中起剂量依赖性的转录抑制子的作用,在Gli3突变体小鼠中观察到神经管细胞强烈的腹侧化表型,这支持了Gli3对Shh信号转导具有抑制作用的结论[62]。
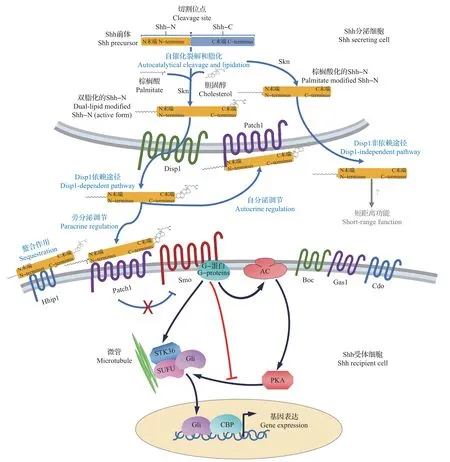
图6 Shh信号的产生、分泌和转导Fig.6 Production,secretion and transduction of Shh signaling
在Shh 配体浓度梯度作用下,在神经管中也诱导出了相似的Gli浓度梯度[63],这种浓度梯度对于腹侧细胞图式的产生是必需的。功能获得实验进一步支持了这一结论,该实验通过逐渐改变Gli 的活性成功地重现了部分背-腹图式[64]。
3.3.3 Shh 信号的时间调控机制
与BMP相似,神经管腹侧图式的精确形成不仅取决于Shh 的浓度梯度,还与细胞暴露于Shh 配体的阶段和持续时间有关[5,49,64]。2007 年,DESSAUD等[5]提出了Shh调控神经管背-腹图式形成的时间模型,该模型结合了Shh 信号的浓度作用和持续时间作用,认为受体细胞的敏感性将经历逐渐降低的过程。最初,由于细胞对Shh配体具有高敏感度,所以较低的Shh浓度即可激活足够水平的Gli活性,以用于调控基因表达和细胞命运决定。而随着神经管的发育,脱敏的神经祖细胞在与初始阶段相同的Shh浓度作用下只能诱导较低的细胞反应。在这种机制的作用下,相同浓度的Shh 信号实现了在不同的发育阶段诱导出不同细胞命运的能力[65]。该模型和脱敏假设获得了Patch1 响应实验的支持:在Shh的诱导下,反应细胞倾向于表达更多的抑制性蛋白,如Patch1[66],而为了补偿这些抑制性相互作用以实现正常的信号转导和细胞反应,就需要更高浓度的Shh配体[5]。
4 神经管类器官的研究与应用现状
类器官是在体外构建的含有多种器官特异性细胞类型的自组织结构,并具有相应器官的特定功能。近年来,类器官技术发展迅速,已成为研究器官发育、信号调控和疾病发生的重要手段。类器官通常由胚胎干细胞、器官祖细胞或诱导性多能干细胞组织并分化而成。目前比较成熟的类型包括脑、肠、肝、胰和上皮类器官等,已广泛应用于发育生物学探索和疾病研究。
近年来,神经系统类器官广泛发展,并被应用于神经发生和疾病方面的研究。2013 年建立的利用hPSC 诱导神经类器官的培养系统,部分真实地再现了人类大脑的发育和组织过程[67],同时,该培养系统将神经系统类器官从传统的二维组织培养体系转变为复杂的三维细胞培养系统,实现了对体内环境的较好模拟。其他培养方式包括培养具有早期神经命运的类器官球、无血清培养的类胚体样聚集体(SFEBq)等,以及LANCASTER 实验室构建的最新的脑类器官培养体系及其进一步的改进,都能够获得极为复杂的三维结构,甚至是培养出难以通过离体获得的星形胶质命运的细胞[67-70]。对于神经管这样一个模式化且复杂的重要结构,其类器官的培养经历了不断发展的过程,然而培养出能够重现体内类似的细胞空间分布(每种细胞类型和细胞外基质沿着3个体轴位于其对应的位置处)的类器官已成为目前整个类器官技术发展所面临的棘手挑战。
2013年初,SASAI提出了一个想法:为通过细胞自组织培养的三维类器官提供与在胚胎发育过程中位置和浓度相同的形态素,以诱导具有更高体内类似性的类器官模型[71]。令人高兴的是,近年来,对形态素浓度梯度的深入研究和先进生物工程技术的发展,为克服这一挑战提供了乐观的前景。例如:将含有不同浓度形态素的微珠递送至特定区域来实现在单细胞水平上诱导不对称的干细胞分裂[72],或是利用微流体装置在类器官中产生时空可调节的形态素浓度梯度,以及通过模拟Shh和BMP的反平行浓度梯度和其他2个相关信号(Wnt和视黄酸)的转导,以在小鼠胚胎干细胞的不同区域诱导不同类型的神经细胞命运[73]。这些技术为人们以正确的方式诱导特定细胞的自组织提供了足够的信心。除了利用这些技术,最近,CEDERQUIST 等使用能够诱导表达Shh的转基因hPSC模拟信号源,利用产生并扩散的Shh 在类器官中形成了适当的浓度梯度,并在这种Shh 浓度梯度下成功地诱导了具有高度体内相似性细胞命运和空间排布的独特的人前脑类器官[8](图7)。
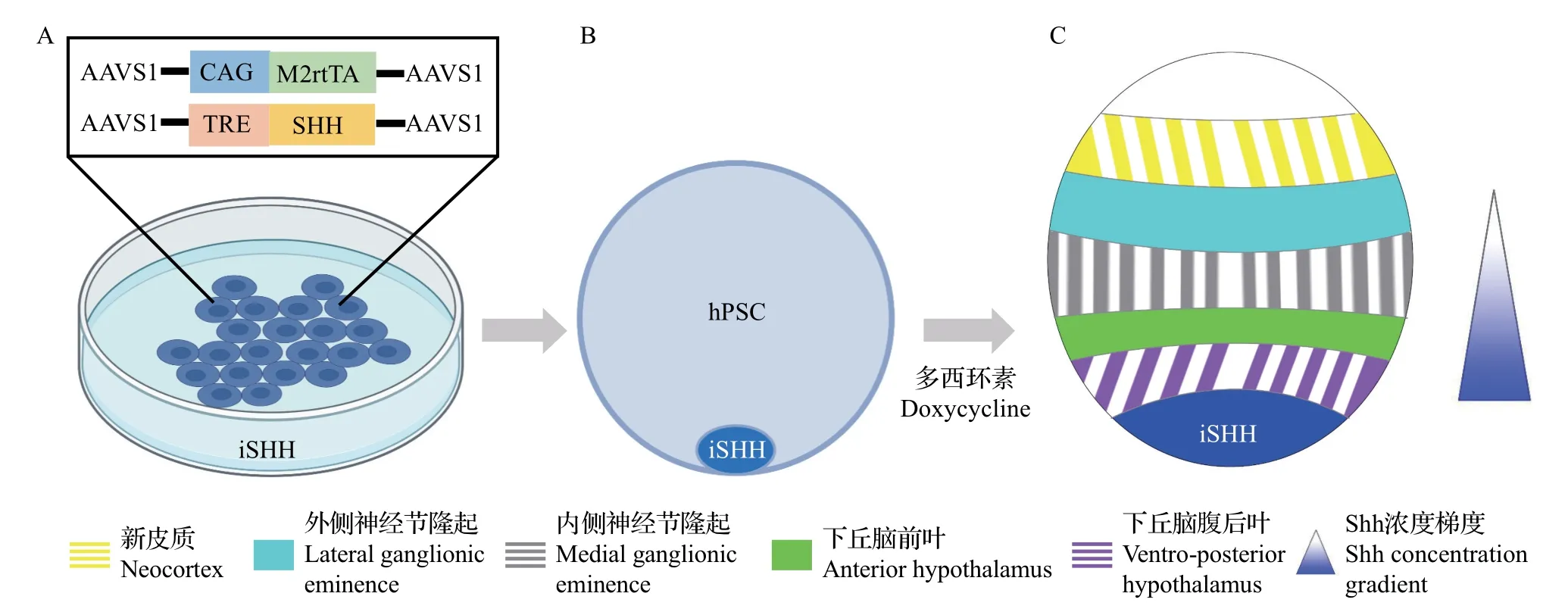
图7 利用Shh浓度梯度体外指导前脑类器官的形成示意图Fig.7 Schematic description of applying Shh concentration gradient to instruct forebrain organoid formation in vitro
5 小结与展望
本综述主要总结了2 个关键的形态素(BMP 和Shh)在脊椎动物神经管背-腹图式形成过程中的作用。在神经管形成过程中,位于神经管最背侧区域的顶板分泌的BMP 及位于腹侧的脊索和底板分泌的Shh形成反平行浓度梯度,以诱导背-腹图式的形成。Shh 可以通过分泌、扩散和降解的不同调控机制形成腹-背浓度梯度,而BMP 的背-腹浓度梯度的形成和维持方式尚待确定。建立浓度梯度后,这2个形态素都可以通过时空调节机制和相应的信号转导途径进一步调控细胞命运。近年来,越来越多的体内研究揭示了形态素浓度梯度在器官发生中的作用,并被逐步应用于构建类器官的研究中。
然而,要真正通过构建形态素浓度梯度模仿生物体发育过程并进行深入研究仍然存在一些挑战。第一,基于当前的技术,在特定时间和特定位置直接测量体内形态素的绝对浓度非常困难;第二,要在体外建立适当的形态素浓度梯度,不仅要考虑形态素的产生,还要考虑其扩散和降解;第三,由自组织产生的极高局部浓度极大地增加了形态素浓度梯度的复杂性;第四,由于细胞图式的产生不仅依赖于形态素的空间调节,还与暴露于形态素的时间相关,因此,对细胞的诱导时间需要精确控制;第五,对于某些形态素(如BMP),图式的诱导可能依赖于由不同配体组合成的二聚体,并且对于不同的二聚体,其功能是否依赖于浓度梯度仍有待验证。但我们相信,利用形态素浓度梯度并结合三维打印等生物工程方法是指导胚胎干细胞或诱导多能干细胞在体外产生具有正确结构和功能的类器官的最有前景的策略,克服这些挑战必将大力推动整个发育生物学和再生医学的发展。
