天麻、苦荞醇提物对灰树花胞外多糖合成酶类的影响及天麻苦荞醇提物复配发酵液的抗疲劳作用
2022-11-08雷露余波周景瑞王川南吴天祥
雷露,余波,周景瑞,王川南,吴天祥,3*
(1.贵州省农业科学院畜牧兽医研究所,贵州贵阳 550005)(2.贵州大学酿酒与食品工程学院,贵州贵阳 550025)(3.贵州食品工程职业学院粮油食品工程系,贵州贵阳 551400)
灰树花(Grifola frondosa)隶属于多孔菌科树花菌属,又名重菇、莲花菌等,是一种名贵的食药两用真菌[1]。通过液体深层发酵的培养方法可高效、快速的获取灰树花中的多酚、蛋白质、多糖、萜类、氨基酸、甾醇等生物活性物质[2,3],其中胞外多糖(EPS)是灰树花发酵液的重要活性成分之一,具有抗氧化[4]、抗肿瘤[5]、调节机体免疫力[6]、抗HIV[7]等生理功效。在灰树花EPS 的合成过程中酶起着举足轻重的作用,灰树花菌体合成EPS 的途径如图1 所示[8],菌体将葡萄糖作为碳源物质,在激酶(Glucokinase,GK)催化作用下转化成葡萄糖-6-磷酸(Glucose-6-phosphate,GSP),进入两条代谢路径,一条是在磷酸葡萄糖异构酶(GPI )的作用下转化为果糖-6-磷酸(Fructose-6-phosphate,FSP),经过一系列转化反应后生成乳酸(LA);另外一条通路则是在磷酸葡萄糖变位酶(PGM)和UDP-葡萄糖焦磷酸化酶(UGPase)的作用下将GSP在转化成UDP-葡萄糖(UDP-glucose,UDPG)参与糖链的连接,该途径与灵芝EPS 合成途径相类似[9,10]。可看出,GPI、PGM、UGPase 是胞外多糖合成的关键酶[11]。

图1 灰树花EPS 生物合成途径Fig.1 The EPS biosynthesic pathway of Grifola frondosa
随着人们生活品质的提高,有氧运动成为主流,但当前的运动饮料多以糖类、盐类为主要成分,仅起到预防运动后身体中的水盐紊乱作用[12],因此研究药食用真菌发酵液的抗疲劳功效,研发新型运动饮料极具开发价值。焦迎春等[13]从柴达木大肥菇发酵液中提取的EPS灌胃小鼠35 d后能够显著提高其体内肝糖原(HG)含量和血清中的乳酸脱氢酶(LDH)活性,降低血清尿素氮(BUN)和LA 含量,表现出良好的抗疲劳功效。胡振宇[14]发现用姬松茸发酵液连续灌胃小鼠30 d 后,小鼠的负重游泳与爬杆时间得到明显延长,同时肝组织中超氧化物歧化酶和谷胱甘肽过氧化物酶活性也显著提升;刘洋等[15]研究发现,添加人参水煎液的灵芝发酵液可明显延长小鼠游泳耗竭时间,并降低血液中LA 含量,从而表现出良好的抗疲劳效果。近年来,在药食用真菌领域上开发运动保健型饮料逐渐得到重视,但有关灰树花抗疲劳作用的相关研究鲜见报道。
本课题组前期研究表明在灰树花深层发酵体系中添加7 g/L 的天麻醇提物和5 g/L 的苦荞醇提物,可显著提升灰树花EPS 的产量(与空白组相比提高49.08%)[16]。为进一步探明EPS 产量的提升与EPS生物合成途径中的酶是否有一定的相关性,本研究通过向灰树花深层发酵体系中添加7 g/L 天麻醇提物、5 g/L 苦荞醇提物以及这两种醇提物的复配液,动态测定PGM、GPI 和UGPase 三种关键酶活性的变化。用发酵液连续灌胃试验小鼠30 d 后,测定小鼠负重游泳的首次下沉时间、力竭时间,以及游泳试验结束后肝脏HG 含量和血清中LA、LDH、BUN 含量。该文旨在为研究酶活的改变以诱导灰树花更高效的发酵给予相应的理论基础数据和试验依据,以期开发出优质的灰树花发酵液保健品。
1 材料与方法
1.1 实验动物与编号
SPF 级体质量为20±2 g 的雄性昆明小鼠,长沙天勤生物技术有限公司。动物生产许可证号:SCXK(湘)2019-0013。
1.2 菌种与试剂
灰树花5.404 菌种,中国普通微生物菌种保藏管理中心(CGMCC);天麻和苦荞籽粒,贵州德江县和威宁县。
葡萄糖-6-磷酸脱氢酶、α-葡萄糖-1-磷酸钠盐、D-果糖-6-磷酸二钠、α-磷酸葡萄糖变位酶、β-NADP+、UDP-葡萄糖,美国Sigma 公司;Tris-HCl、焦磷酸钾,北京索莱宝科技有限公司;无水乙醇、MgCl2、NaCl,国药集团;血清尿素氮(BUN)、乳酸脱氢酶(LDH)、糖原、血乳酸(LA)测试盒,南京建成生物工程研究所。
1.3 实验仪器
Thermo-17R 型离心机,德国赛默飞仪器公司;BXM-30R 型灭菌锅,上海博讯实业医疗设备厂;SPECTRA MAX 190 型酶标仪,昆明纳瑞科技有限公司;CP114 型电子天平,上海奥豪斯仪器有限公司;SW-CJ-1D 型超净工作台,苏州净化设备有限公司。
1.4 灰树花培养
培养温度:25 ℃。方法:从母种试管中挑取少量菌体接种至PDA 斜面培养基中培养10~14 d,转移至150 r/min 摇床液体种子培养4 d 后,再转移至同转速摇床发酵培养基(实验组加入天麻、苦荞醇提物)培养7 d。
1.5 制备醇提物
分别取洗净烘干的天麻、苦荞,用高速磨粉机粉碎后过80 目筛,用φ=75%乙醇(天麻常温下浸提48 h,苦荞60 ℃冷凝回流2 h)提取醇提物,80 r/min 旋蒸除乙醇,最后用蒸馏水(1 g 天麻或苦荞用10 mL 蒸馏水)定容,既得到醇提液(每10 mL 醇提液中含1 g天麻或苦荞)[8,16]。将7 g/L 天麻醇提物与5 g/L 苦荞醇提物按体积比1:1 混合得试验用天麻苦荞复配液。
1.6 酶活力的测定
1.6.1 粗酶液的提取
灰树花发酵液用滤纸过滤,得到菌丝体,用4 ℃的细胞提取缓冲液(0.02 mol/L 磷酸钾盐pH 值6.5)洗涤菌丝体表面残留的发酵液,转移菌丝体至预冷的研钵中,加入5 mL 细胞提取缓冲液后顺着同一方向研磨至浆状,在4 ℃,15 000 r/min 条件下离心20 min,取上清液。上清液中的蛋白浓度测定采用Bradford 法[17]。
1.6.2 酶活力的测定
参照聂文强[18]、李阳[19]的方法,根据PGM、UGpase 和GPI 三种酶活力测定的反应体系,添加各反应物于具塞试管中,加入1 mL 粗酶液,混匀。取200 μL 放入微孔酶标板中,在30 ℃,340 nm 处测定NAD(P)H 的变化。1 个酶活单位(U)定义为每分钟增加或减少的1 μmol NAD(P)H 所需酶量。计算公式见下。

式中:
ΔA/Δt——吸光值在60 s 的变化率;
Vq——所加酶液体积,mL;
Vy——反应体系总体积,mL;
ε——6.22×103L/(mol·cm);
d——吸收光径,cm。
1.7 动物实验
1.7.1 灌胃方法
小鼠适应性喂养7 d 后,每组随机选取8 只分成6组,共48 只。分别为:空白组(生理盐水)、对照组(灰树花发酵液)、复配液对照组(天麻苦荞复配液)、三个实验组(分别灌胃添加天麻醇提物、添加苦荞醇提物和添加天麻苦荞复配液的灰树花发酵液)。
灌胃周期30 d,根据小鼠体质量按量给药,每日一次(灌胃体积:0.01 mL/g)。
1.7.2 指标的测定
第30 d 灌胃后0.5 h 称量小鼠体质量→尾巴中下部捆绑质量为小鼠质量5%的铅皮→放入水槽中(25±0.5)℃游泳(记录首次下沉的时间与沉入水面8 s 无法上游时间即为游泳力竭时间)→摘眼球取血→解剖取出肝脏→测定BUN、LA、LDH、HG 的含量。
1.8 数据处理
以平均值(X)±标准差(SD)表示数据,分析显著性用IBM SPSS Statistics 23 软件,绘图软件用Origin 2017。
2 结果与讨论
2.1 醇提物对灰树花EPS 合成酶类的影响
2.1.1 磷酸葡萄糖变位酶
以7 g/L 的天麻醇提物(天麻组)、5 g/L 的苦荞醇提物(苦荞组)和天麻7 g/L、苦荞5 g/L 复配液(复配组)为三个实验组,不添加醇提物的发酵液为空白组进行试验。每2 d 取一次样,测定PGM 活力,绘制动态变化曲线如图2 所示,在发酵前期,各组PGM活力迅速提升,且复配组的活力最强。发酵的第7 d,所有组别的PGM活力均达到顶峰值后开始缓慢下降,这是由于在发酵的1~3 d,菌体处于调整期,发酵液中菌丝体极少,使得产PGM 活力较低;3~7 d,菌体处于对数生长期,PGM 活力迅速提高;7~13 d,菌体生长处于稳定期并逐渐进入衰亡期,PGM 活力开始降低。在第7 天时,酶活具体表现在:复配组为最高0.32 U,其次是天麻组0.27 U,再次是苦荞组0.26 U,最后是空白组0.17 U,复配组、天麻组、苦荞组的PGM活力与空白组相比提高了88.26%、58.82%、52.94%,且差异显著(p<0.05)。表明天麻、苦荞醇提物复配添时能够对PGM 活力起到最佳效果(p<0.05),使得合成EPS 过程中,葡萄糖转化成GSP 之后在PGM 活力提升的影响下,合成葡萄糖-1-磷酸(Glucose-1-phosphate,GOP)的效率和产量也得到提高,为灰树花EPS 的合成提供更充足的糖原物质。

图2 发酵过程中PGM 活力的变化Fig.2 Change of PGM activity during Grifola frondosa fermentation
2.1.2 UDP-葡萄糖焦磷酸化酶
UGPase 是灰树花菌体合成胞外多糖的途径(GSP→GOP→UDPG→…→EPS 重复单元)中重要的关键酶之一,通过该途径可得出,EPS 产量高低与其活力大小呈正相关。试验期间,整个发酵周期的UGPase 活力变化如图3 所示。从发酵的第3 天开始,三个实验组的UGPase 活力呈明显上升趋势且均显著高于空白组(p<0.05)。在第7 天,UGPase 活力变化与PGM 表现一致,达到最高值,其中复配组的UGPase活力为0.25 U,与天麻组0.22 U、苦荞组0.20 U 和空白组0.15 U相比分别增加了13.63%、25.00%、66.67%。Wu等[20]研究发现,PGM和UGPase是影响灰树花EPS种类和单糖成分的关键酶。结合上一步试验可得出,天麻和苦荞醇提物中存在某些对PGM和UGPase活力增效的成分,且这些成分有着协同增效的作用,使得在EPS 的合成中,通过改变多糖种类和单糖成分,进一步为EPS 的合成提供更多前体物质,此结论与唐家毅等[21]的研究相一致。

图3 发酵过程中UGPase 活力变化Fig.3 Change of UGPase activity during Grifola frondosa fermentation
2.1.3 磷酸葡萄糖异构酶
由图4 可知,GPI 活力的变化与PGM 和UGPase正好相反。从发酵第5 d 开始,实验组的GPI 活力均显著低于空白组(p<0.05),这说明一定浓度醇提物的添加能够让GPI 活力受到抑制,且抑制作用最为明显的是复配组。各组的GPI 活力在第7 d 达到最大,这是由于在灰树花整个发酵阶段,第7 d 为菌体生长的最旺盛时期[17]。与空白组(0.19 U)相比,苦荞组(0.17 U)、天麻组(0.15 U)和复配组(0.11 U)的GPI 活力分别降低了11.76%、26.67%、72.73%。GPI活力的减弱,会提升糖异生途径(EPS 合成途径)的碳通量,提升GSP 转化为UDPG 的效率,有利于灰树花菌体合成EPS,使得实验组发酵液中EPS 含量增加。
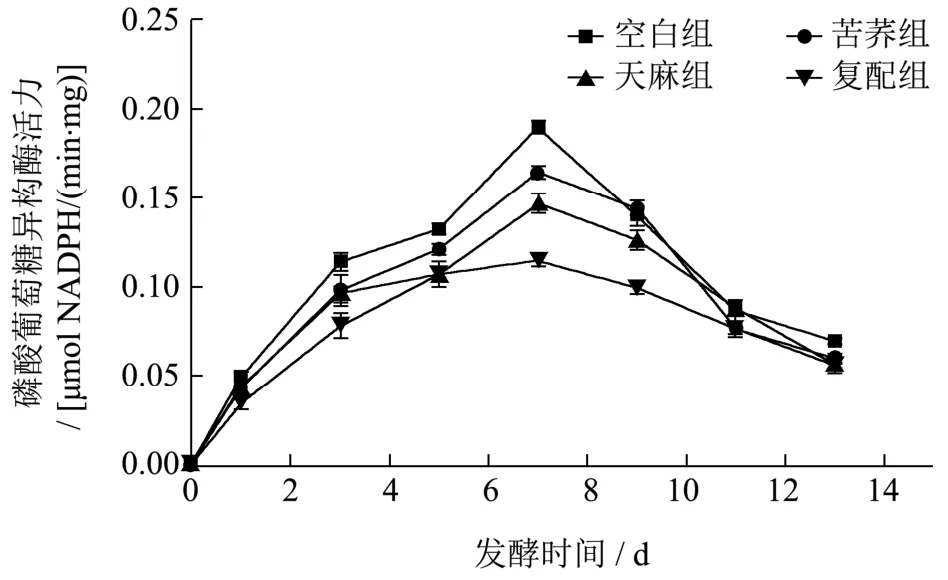
图4 发酵过程中GPI 活力的变化Fig.4 Change of GPI activity during Grifola frondosa fermentation
2.2 小鼠抗疲劳指标测定结果
2.2.1 体质量分析
观测灌胃30 d 后,小鼠体质量的增长率。结果如表1 所示,所有试验小鼠体质量在灌胃30 d 后均增加,空白组虽然增长率稍低一些。但与其余组别比较无统计学意义(p>0.05),说明发酵液和醇提物均不会加速小鼠体质量的增长,同时也未影响试验小鼠的正常生长发育。
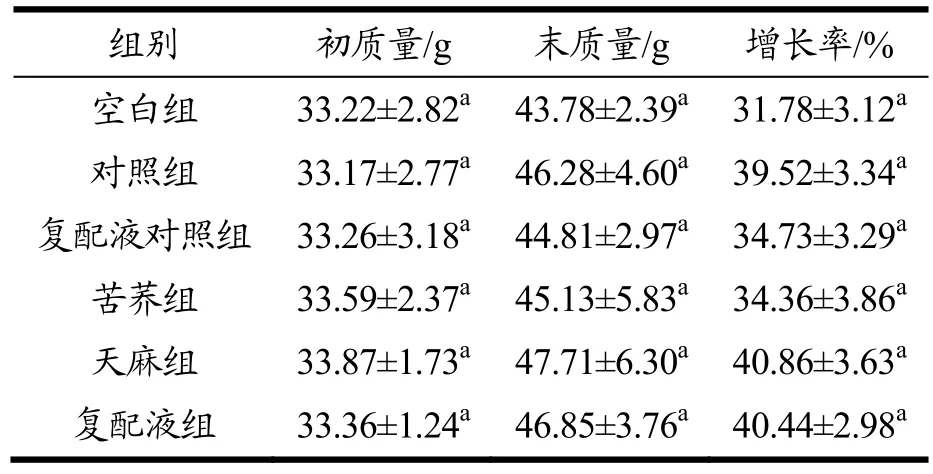
表1 小鼠体质量的对比分析Table 1 Comparative analysis of the body weight of mice(X±SD,n=8)
2.2.2 负重游泳实验结果
运动耐力试验被普遍用于评估疲劳现象,负重游泳试验是通常被作为检验抗疲劳的试验方法之一[22]。通过表2 对比发现,灌胃了灰树花发酵液的小鼠,首次下沉时间和游泳力竭时间均得到延长,与空白组和复配液对照组比较均有显著性差异(p<0.05),复配液对照组与空白组相比无显著性差异(p>0.05),表明未与灰树花共同发酵的天麻、苦荞醇提物不能提高小鼠的运动能力,由此可排除醇提物自身所带来的干扰因素。此外,复配组的小鼠游泳耐力效果最好,其作用优于除天麻组以外的其余组别,并分别是空白组和对照组的2.92 倍和1.22 倍,结合本实验发现,醇提物的添加使得灰树花发酵液中的EPS 含量提升,糖类作为主要能源物质在运动中由线粒体通过有氧呼吸分解后合成ATP,并直接释放能量,提升小鼠游泳耐力。

表2 小鼠负重游泳时间的对比分析Table 2 Comparative analysis on the swimming time of mice with loads (X±SD, n=8)
2.2.3 尿素氮和肝糖原含量的测定结果
由表3 可知,两个对照组和三个实验组均能不同程度的降低小鼠负重游泳结束后血清中BUN 含量,而肝脏中HG 含量得到提升。BUN 是评价机体承受能力的特征指标,当蛋白质开始代谢参与供能时,BUN含量提升,其含量与运动时间呈正相关,增幅越大表明机体运动负荷能力越差[23]。从表3 得知,三个实验组BUN 含量与空白组和复配对照组相比均显著降低(p<0.05),空白组和对照组与复配组相比分别降低了52.57%和31.66%,由此说明在灰树花发酵体系中添加天麻苦荞复配液能够使发酵液中抗疲劳因子总量增多,提高机体的运动承受能力,延长运动时间。

表3 尿素氮和肝糖原含量的对比分析Table 3 Comparative analysis of BUN and HG content(X±SD,n=8)
随着运动时间的延长,糖原物质的耗尽是产生疲劳的主要原因之一[24],因此,有效的缓解运动疲劳可通过增加机体中的糖原储备量,以此提升运动耐力。从表3 可看出,对照组和复配对照组与空白组相比较,HG 含量有小范围的提高,但不显著(p>0.05);而三个实验组与空白组相比,均能显著提高小鼠肝脏中HG 含量(p<0.05),说明含有醇提物的灰树花发酵液对小鼠进行一段时间的灌胃后,发酵液中的EPS 作为外源性糖分可有效提高其肝脏合成糖原的速度,以此来提高机体内糖原物质的储备量,延缓疲劳发生。
2.3.4 血清中乳酸脱氢酶、乳酸含量的测定结果
LA 含量是评价机体疲劳的指标之一,在剧烈运动时,产生的LA 得不到有效分解就会引起肌肉酸痛,从而产生疲劳感[25],此时,LDH 可加快清除无氧糖酵解所产生的LA,减少其在机体内的堆积,减缓或加速消除疲劳感[26]。由表4 可知,与空白组小鼠相比,除复配液对照组外,其余组别小鼠血清中LA 的含量均减少,而LDH 的含量均在一定程度上得到提高。效果最为明显的组别为复配组(p<0.05),其LA 含量与空白组和对照组相比,降低了46.01%和34.54%,LDH 提升了19.19%和11.30%;复配液对照组的LA和LDH 含量与空白组相比均无显著影响(p>0.05)。实验结果表明,添加天麻苦荞复配液的灰树花发酵液可通过提升LDH 在小鼠机体内的含量,从而分解长时间运动过程中无氧呼吸产生的LA,缓解肌肉酸痛感而达到抗疲劳效果。

表4 乳酸脱氢酶和乳酸含量对比分析Table 4 Comparative analysis of LDH and LA contents(X±SD,n=8)
3 结论
本研究能够初步证实添加天麻、苦荞醇提物后灰树花EPS 含量提升与PGM、UGPase 和GPI 三种酶密切相关。吴彩云等[27]研究发现在灰树花深层发酵中,菌丝体能消耗天麻醇提物中的天麻素、对羟基苯甲醛和对羟基苯甲醇,尤其是对羟基苯甲醛基本完全吸收。Chen 等[28]在苦荞醇提物中发现其含有丰富的芦丁、槲皮素等活性成分,但具体是哪一种或者哪几种成分对改变EPS 合成关键酶活性,提升发酵液中的抗疲劳因子尚不清楚,需做进一步研究。在该研究中,本课题组也首次发现了灰树花发酵液具有良好的抗疲劳作用,且将天麻苦荞复配液与灰树花共同发酵之后,所得发酵液抗疲劳作用起到1+1>2 的效果。研究结果表明,灰树花发酵液能够作为一种天然的初级保健产品,可进行下一步的深入研究,为灰树花功能型饮料的研发提供理论支撑。
