山芹菜多糖的分离纯化、结构分析及抗氧化活性比较
2022-11-08石曾卉刘丽阳洪慧丽勾东霞刘多
石曾卉,刘丽阳,洪慧丽,勾东霞,刘多,2*
(1.长春大学食品科学与工程学院,吉林长春 130000)(2.长春师范大学生命科学学院,吉林长春 130000)
山芹菜[Ostericum sieboldii(Miq.)Nakai]是伞形科、山芹属的多年生草本植物,也称短果茴芹、大叶芹、山芹等,有两种变种,分别为狭叶山芹和毛山芹。山芹菜在我国主要分布于吉林、辽宁、黑龙江等海拔150~1 400 m 的针阔叶混交林地区[1],其幼苗在春季常被采摘食用,有良好的风味,是长白山地区代表性的山野菜之一。从外观来看,山芹菜主根短、分枝较多,整体颜色呈黄褐色至棕褐色;茎相较家芹而言细、且沟纹深,多为二年生或多年生草本植物[2]。花期为八月到九月,果期为九月到十月。古代中药书中记载,山芹菜可以清热解毒、滋阴养颜、治疗风湿痹痛、腰膝酸痛和感冒头痛等[3],具有一定的保健功能。此外有研究表明,山芹菜含有许多的生物活性化合物,具有高于普通蔬菜水果的生物活性[4]。
植物多糖是植物体内很重要的一类生物大分子,为醛糖或酮糖通过糖苷键连接而成的天然高分子多聚物,与机体免疫功能的调节、细胞与细胞之间的识别、细胞间物质的运输和癌症的诊断与治疗等密切相关,也是有效维持和保证生物体生命活动能够正常运转的基本物质,目前已被广泛应用于食品和药品等多种领域[5,6],近年来成为国内外研究的热点之一。目前对植物多糖提取方法的研究已较为成熟,但是由于多糖分子量大,结构解析复杂,因此对其精细结构分析研究较少[7-10]。目前研究表明,针对山芹菜的研究主要包括山芹菜多糖的提取和含量测定,以及山芹菜挥发性成分的生物活性[11,12]。而对山芹菜多糖的分离纯化及结构解析未见报道。本文在对山芹菜中的多糖进行提取的基础上,进一步对其组分进行分离纯化,并测定了各个多糖组分的主要化学成分、基本结构和体外抗氧化活性,旨在为山芹菜在医药和食品等方面的应用提供参考,为东北地区山野菜的深度开发利用提供理论依据。
1 材料与方法
1.1 实验材料
山芹菜,购于吉林省长白山地区;苯酚、硫酸,分析纯,北京化工厂有限责任公司;DEAE 纤维素,上海源叶生物科技有限公司;乙腈,色谱纯,北京化工厂有限责任公司;甲醇,色谱纯,北京化工厂有限责任公司;氯化钠,色谱纯;其他试剂均为分析纯。
1.2 实验仪器与设备
BM312-B 旋转蒸发器、3K15 台式高速离心机,上海亚荣生化仪器厂;LC-10AT 高效液相色谱仪,日本岛津公司;Nicolet is 5 傅里叶红外光谱仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 山芹菜多糖的提取及分离纯化
1.3.1.1 多糖提取
通过水提醇沉法提取山芹菜中的植物多糖。称取一定量的新鲜山芹菜,在料液比1:20(g/mL)、提取时间4 h、提取温度100 ℃的条件下进行提取,过滤滤渣得到山芹菜粗多糖提取液。用旋转蒸发仪将粗多糖液浓缩后,在4 ℃下用φ=70%乙醇醇沉24 h,4 000 r/min 离心20 min 收集沉淀,在60 ℃水浴下不停地搅拌烘干除去乙醇,加dH2O 溶解冷冻干燥,得到山芹菜多糖(WOSP)。
1.3.1.2 多糖分离纯化
离子交换层析法分离纯化WOSP。将2 g WOSP用100 mLdH2O充分溶解后缓慢加入DEAE离子交换层析柱中,待其完全进入后用dH2O 为流动相洗脱山芹菜中性多糖(WOSP-N),洗脱完全后将流动相替换为0~0.5 mol/L NaCl 洗脱山芹菜酸性多糖(WOSP-A)。将洗脱完全后的WOSP-N、WOSP-A 溶液用旋转蒸发仪浓缩体积,透析后冷冻干燥得到固体。
1.3.1.3 多糖分子量测定
高效凝胶渗透色谱法(HPGPC)测定WOSP-A和WOSP-N 的分子量。使用分子量为5 000、12 000、25 000 和50 000 u 的葡聚糖作为标准品,以保留时间为横坐标x(tR)和葡聚糖标准品分子量的对数为纵坐标y(lgM)作图,得到回归曲线方程:
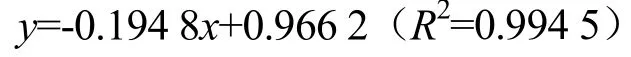
根据标准曲线计算多糖的分子量。
HPGPC 分析方法:采用高效液相系统(CTO-20 A泵和RID-10 A 检测器),TSK-gel G-3000 PWXL 色谱柱(4.6×150 mm),流动相为0.2 mol/L NaCl 水溶液,体积流量为1.0 mL/min,柱温35 ℃,进样体积20 μL,采用示差检测器检测。
1.3.2 山芹菜多糖基本化学组成测定
1.3.2.1 总糖含量测定
依据苯酚-硫酸法[13]并进行适当改良,分别测定WOSP、WOSP-A 和WOSP-N 中总糖含量。配制浓度为0.1 mg/mL的多糖溶液,吸取10 μL糖溶液于2.5 mL EP 管中,加dH2O 至1 mL,然后加入50 μLw=6%的苯酚和250 μL 浓硫酸,立刻震荡摇匀,置于沸水浴中反应15 min。反应完毕后迅速冷却,使用酶标仪检测反应液在490 nm 的OD 值。以葡萄糖标准品的总糖含量为横坐标x(mg)和不同浓度下葡萄糖标准品吸光度为纵坐标y(OD 值)作图,得到多糖的回归曲线方程:

根据标准曲线计算样品中的总糖含量。
1.3.2.2 糖醛酸含量测定
依据间羟基联苯法[14]并进行适当改良,分别测定WOSP、WOSP-A 和WOSP-N 中糖醛酸含量。配制浓度为0.1 mg/mL 的山芹菜多糖溶液,吸取60 μL 糖溶液于2.5 mL EP 管中,加蒸馏水至1 mL 后加入250 μL浓硫酸和4 μL 间羟基联苯,100 ℃水浴反应20 min,冷却后加入4 μL 氨基磺酸反应15 min。反应完毕后使用酶标仪检测反应液在525 nm 的OD 值。以半乳糖醛酸标准品的糖醛酸含量为横坐标x(mg)和不同浓度下糖醛酸标准品吸光度为纵坐标y(OD 值)作图,得到多糖的回归曲线方程:
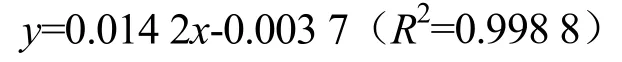
根据标准曲线计算样品中的糖醛酸含量。
1.3.2.3 蛋白质含量测定
依据考马斯亮蓝法[15]并进行适当改良,分别测定WOSP、WOSP-A 和WOSP-N 中蛋白质含量。配制浓度为0.05 mg/mL 的山芹菜多糖溶液,吸取100 μL 糖溶液于5 mL EP 管中,加蒸馏水至1 mL,然后加入2.5 mL的考马斯亮蓝溶液,立刻震荡摇匀,反应5 min。反应完毕后用酶标仪检测反应液在590 nm 的OD 值。以牛血清蛋白标准品的蛋白质含量为横坐标x(mg)和不同浓度下牛血清蛋白标准品吸光度为纵坐标y(OD 值)作图,得到多糖的回归曲线方程:
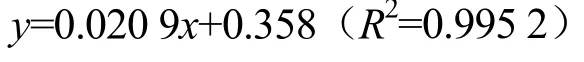
根据标准曲线计算样品中的蛋白质含量。
1.3.3 山芹菜多糖单糖组成测定
首先对WOSP、WOSP-A 和WOSP-N 进行衍生化反应:称取1 mg 多糖样品置于酸水解小瓶中,加入1 mL 的2 mol/L 盐酸甲醇溶液,充N2密封后,置于80 ℃金属浴中水解10 h 后用空气泵吹干,再加入1 mL 的2 mol/L 三氟乙酸溶液,于120 ℃金属浴中水解1 h 后用空气泵吹干除去三氟乙酸。混合标准品由甘露糖(Man)、葡萄糖醛酸(GlcA)、鼠李糖(Rha)、半乳糖醛酸(GalA)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)、岩藻糖(Fuc)各0.1 mg组成,得到标准品混合液,置于酸水解小瓶中备用。
向完全酸水解后得到的干燥样品和混合标准品中加入500 μL 的0.3 mol/L NaOH 溶液,使样品充分溶解,再加入500 μL 的PMP(1-苯基-3-甲基-5-吡唑啉酮)-甲醇溶液进行混合,取200 μL混合液于1.5 mL EP管中。将样品和标准品在70 ℃条件下水浴反应0.5 h,分别加入100 μL 的0.3 mol/L HCl 溶液,充分混匀后加入700 μL CH3Cl,充分振荡后,萃取得到剩余的PMP-甲醇试剂,弃去CH3Cl 层,保留水层,重复操作萃取三次。0.22 μm 有机滤膜过滤,然后进行检测。
高效液相色谱法(HPLC)分析方法:采用Shimadzu HPLC 系统(CTO-20A 泵和SPD-20AVD 紫外光检测器),DIKMA Inertsil ODS-3 色谱柱(4.6×150 mm),流动相为PBS(0.2 mol/L,pH 值7.0)-乙腈19.2:80.8(V/V),体积流量为1.0 mL/min,进样量为20 μL,检测波长为245 nm。
1.3.4 山芹菜多糖红外光谱测定
在干燥条件下将1 mg 样品与180 mg 无水溴化钾混合压制成片,使用傅里叶红外光谱仪测定在4 000~500 cm-1的波长范围内多糖的FT-IR 光谱。
1.3.5 WOSP-A 和WOSP-N 酶解实验
选择阿拉伯聚糖酶(α-1,5-Arabinanase)、半乳聚糖酶(β-1,4-Galactanase )和半乳糖醛酸酶(Endo-polygalacturonanase)对WOSP-A 和WOSP-N进行酶解。配制0.2 mol/L 的醋酸-醋酸钠缓冲液并调节pH 值(半乳糖醛酸酶pH 值为5.0,阿拉伯聚糖酶和半乳聚糖酶pH 值为4.0,混合添加时pH 值为4.5),取400 μL 缓冲液溶解1 mg 样品后加入1 μL 酶溶液,40 ℃反应12~24 h 后,98 ℃反应5 min 将酶灭活,再用0.22 μm 水系滤膜过滤。
HPGPC 法测定酶解后多糖的分子量,测定方法同1.3.1.3。通过酶解前后分子量对比,进一步明确WOSP-A 和WOSP-N 中糖苷键组成。
1.3.6 山芹菜多糖体外抗氧化性质测定
通过对1,1-二苯基-2-三硝基苯肼(DPPH·)、超氧阴离子自由基(O2-·)、羟自由基(·OH)清除能力和对铁离子(Fe3+)还原能力[16,17]测定WOSP、WOSP-A和WOSP-N 三种多糖的体外抗氧化能力。
配制0.5、1、2、5 和10 mg/mL 5 个梯度的三种多糖样品溶液,dH2O 为空白对照,Vc 为阳性对照,每个样品测定3 次取其平均值。
1.3.6.1 清除DPPH·能力测定
取0.6 mL 不同浓度的三种多糖样品溶液,分别加入2.4 mL 的0.1 mmol/L DPPH,充分混匀后避光反应30 min,在517 nm 处测定混合溶液OD 值A1,同时测定dH2O 的OD 值A0,将无水乙醇代替DPPH 测得OD值为A2。DPPH·清除率(记为F1,%)计算公式如下:
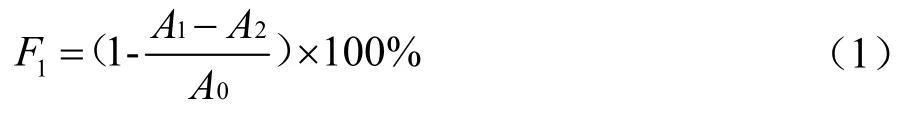
1.3.6.2 清除O2-·能力测定
取50 μL 不同浓度的三种多糖样品溶液,加入50 μL 的300 μmol/L NBT(氯化硝基四氮唑蓝)、50 μL的936 μmol/L NADH(还原型辅酶Ⅰ)、50 μL 的120 μmol/L PMS(吩嗪硫酸甲脂),充分混匀后避光反应30 min,在517 nm 处测定混合溶液OD 值B1,同时测定dH2O 的OD 值B0作为空白对照,将dH2O 代替PMS 测得OD 值B2。O2-·清除率(记为F2,%)计算公式如下:

1.3.6.3 清除·OH 能力测定
取500 μL 不同浓度的三种多糖样品溶液,加入1 mL FeSO4、1 mL 水杨酸、1 mL H2O2(过氧化氢),充分混匀后避光反应30 min,在510 nm 处测定混合溶液的OD 值C1,同时测定dH2O 的OD 值C0作为空白对照,将dH2O 代替H2O2测得OD 值C2。·OH 清除率(记为F3,%)计算公式如下:
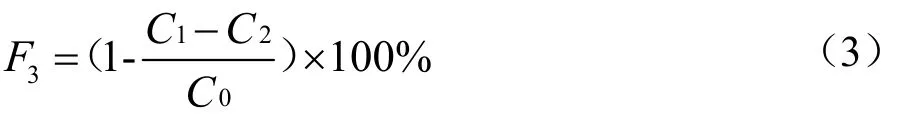
1.3.6.4 Fe3+还原能力测定
取1 mL 不同浓度的三种多糖样品溶液,加入2.5 mL 的0.2 mol/L PBS(pH 值6.6)、2.5 mL 1%铁氰化钾溶液,充分混匀后于50 ℃下恒温水浴20 min,迅速冰浴冷却,加入1 mL 的10wt% TCA(三氯乙酸)溶液混合均匀后,离心取1.5 mL 上清液加入1.5 mLdH2O、1.5 mL 0.1wt%的FeCl3溶液,振荡后静置10 min,在700 nm 处测定吸光度值D1,空白对照测得吸光度值D0。Fe3+还原能力(记为H,%)计算公式如下:

1.3.7 数据处理
所有数据采用SPSS Statistics 24 统计分析软件进行差异显著性分析,采用Origin 2018 64Bit 软件。
2 结果与分析
2.1 山芹菜多糖的提取及分离纯化
采用水提醇沉法获得WOSP 得率为6.78%,经DEAE 纤维素离子柱层析分离后的WOSP-A 和WOSP-N 得率分别为51.34%和2.55%。WOSP 线性梯度洗脱结果如图1a 所示:WOSP-N 被dH2O 洗脱下来,WOSP-A 随着NaCl 浓度的增加而逐渐被洗脱下来,并在0.24 mol/L 的NaCl 溶液处有较为明显的洗脱峰。进一步分析其分子量分布,WOSP-A 分子量主要分布在14.21 ku 左右(图1b),WOSP-N 分子量主要分布在169.36 ku 左右(图1c)。
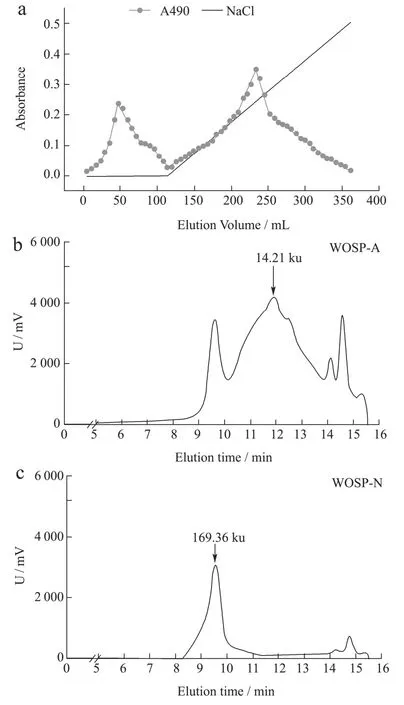
图1 山芹菜多糖的梯度洗脱图和分子量分布图Fig.1 Gradient elution and molecular weight distribution of polysaccharides from WOSP
2.2 山芹菜多糖基本化学组成分析
三种多糖的总糖、蛋白质和糖醛酸含量测定结果如表1 所示。它们的总糖及蛋白质含量几乎无差异。WOSP-A 糖醛酸质量分数为35.38%,明显高于WOSP和WOSP-N。可能是由于酸性多糖中含有半乳糖醛酸和葡萄糖醛酸等酸性单糖,因此WOSP-A 中糖醛酸含量明显高于WOSP 和WOSP-N。
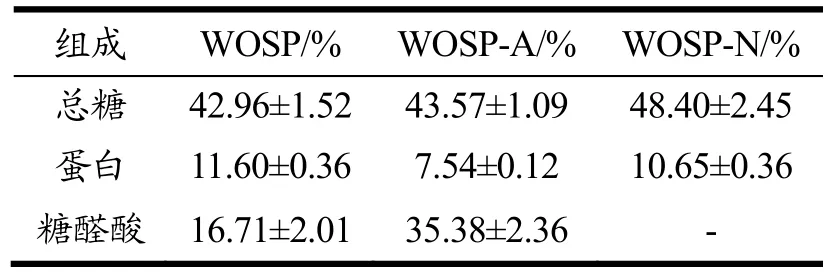
表1 WOSP、WOSP-A 和WOSP-N 的总糖、蛋白质和糖醛酸含量Table 1 The total sugar,protein and uronic acid content of polysaccharides from WOSP,WOSP-A and WOSP-N
2.3 山芹菜多糖单糖组成分析
三种多糖与九种标准混合样品比对分析结果如表2 所示。在WOSP 中,主要单糖组分及物质的摩尔比为GalA:Gal:Ara=11.36:41.50:38.08。进一步纯化后的两个多糖组分的单糖组成存在一定差异,WOSP-A中主要单糖组分及物质的摩尔比为GalA:Gal:Ara=46.99:26.56:19.94,其中糖醛酸所占比例较高,与苯酚-硫酸法所检测的糖醛酸含量检测结果相符合,推测WOSP-A 是主要含有 GalA 的聚半乳糖醛酸(Homogalacturonan,HG)果胶和以Gal 和Ara 为主的阿拉伯半乳聚糖(Type I Arabic Galactans,AG)果胶[18-20];WOSP-N 中主要单糖组分及物质的摩尔比为Gal:Ara=55.32:30.69,GalA 含量较低,推测WOSP-N是主要含有Gal 和Ara 的AG 型果胶。
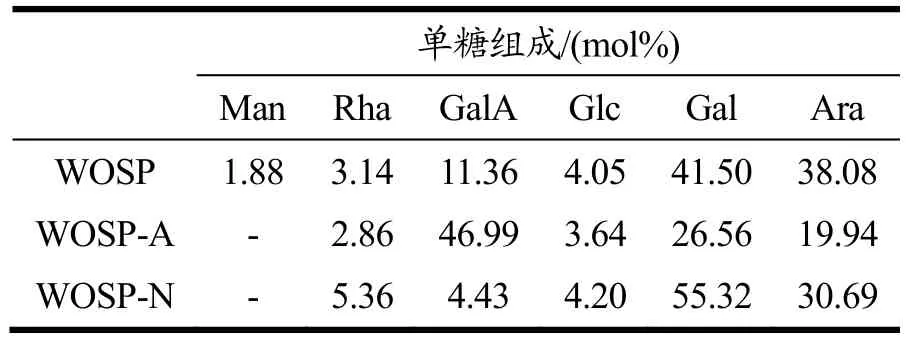
表2 WOSP、WOSP-A 和WOSP-N 单糖组成表Table 2 Monosaccharide composition of WOSP,WOSP-A and WOSP-N
2.4 山芹菜多糖红外光谱分析
三种多糖的红外光谱测定结果如图2 所示。参考相关文献进行分析[21-23]。它们的光谱图含有的特征吸收峰大致相同。在3 374.72 cm-1、1 261.38 cm-1附近的吸收峰为多糖O-H 伸缩振动特征峰;2 953.93 cm-1附近的吸收峰为多糖类物质C-H 伸缩振动所产生的,说明可能存在饱和碳氢键的伸缩振动,这是糖类物质的特征吸收峰;1 738.98 cm-1附近的特征吸收峰为酯基C=O 的伸缩振动峰,表明在WOSP-A 中含有糖醛酸;1 424.16 cm-1处的吸收峰可能为C-H 键的变角振动和反对称伸缩振动所产生的;1 074.42 cm-1附近的特征吸收峰为C-O-C碳水化合物骨架的伸缩振动峰,表明在WOSP、WOSP-A 和WOSP-N 组分中均存在有吡喃糖环;在802.24 cm-1附近显示为α-糖苷键,在WOSP和WOSP-N组分中单糖之间可能存在α-糖苷键的连接方式。
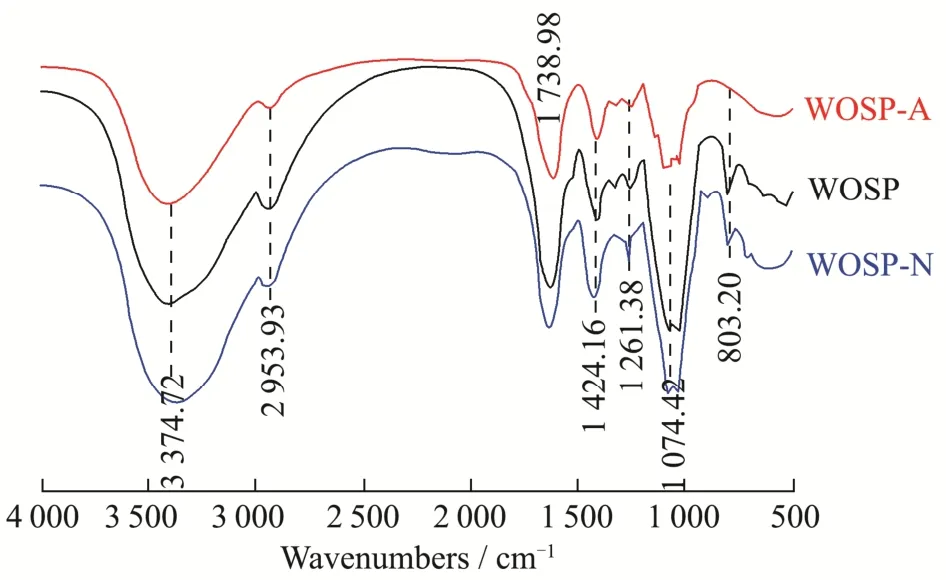
图2 WOSP、WOSP-A 和WOSP-N 的红外光谱图Fig.2 FT-IR spectra of polysaccharide fractions from WOSP,WOSP-A and WOSP-N
2.5 WOSP-A 和WOSP-N 酶解结果分析
为了进一步明确两种多糖的糖苷键连接方式[24],根据它们的单糖组成结果,分别向两种多糖加入不同的酶进行分析。由单糖结果可知,WOSP-A 中主要含有GalA、Gal 和Ara,因此向WOSP-A 中以不同组合添加能够水解α-1,4-半乳糖醛酸糖苷键的内切-半乳糖醛酸酶(Endo-polygalacturonanase)、水解β-1,4-半乳糖糖苷键的β-1,4-半乳聚糖酶(β-1,4-Galactanase)和水解α-1,5-阿拉伯糖糖苷键的内切-α-1,5-阿拉伯聚糖酶(α-1,5-Arabinanase),结果如图3 所示。当添加单一酶(图3a、b、c)后,WOSP-A 的分子量发生变化,将三种酶同时作用于WOSP-A(图3d),其分子量明显降低。说明三种酶将WOSP-A 中的α-1,4-半乳糖醛酸糖苷键、β-1,4 半乳糖糖苷键和α-1,5 阿拉伯糖糖苷键破坏,使其分子量变小,当组合三种酶水解WOSP-A时,糖苷键破坏更为彻底,基本将其降解成分子量较低的寡糖片段。因此,WOSP-A 含有α-1,4-半乳糖醛酸、β-1,4-半乳糖和α-1,5-阿拉伯糖。结合单糖及红外分析结果,推测WOSP-A 主要由HG 型果胶(以α-1,4-GalA 为主)和AG-I 型果胶(以β-1,4-Galp和α-1,5-Araf为主)结构域组成。
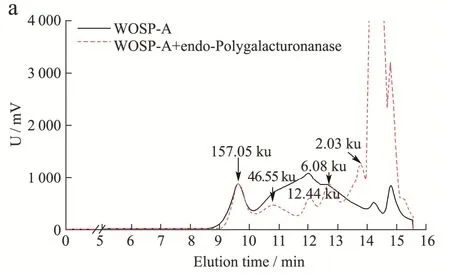
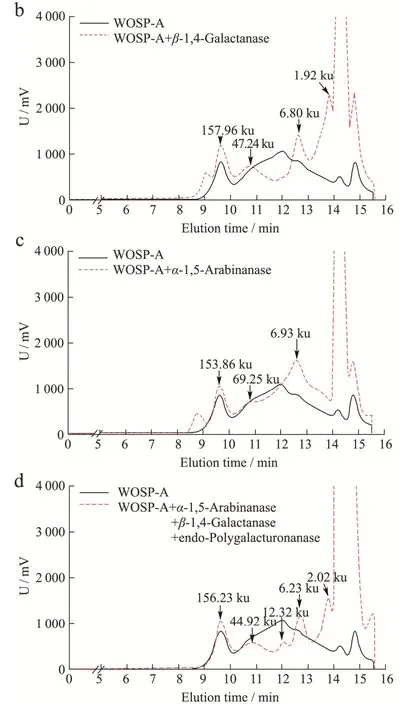
图3 WOSP-A 酶解后分子量分布图Fig.3 Molecular weight distribution of WOSP-A after enzymatic hydrolysis
由单糖结果可知,WOSP-N 中GalA 的含量较低,因此不再添加内切-半乳糖醛酸酶。仅向WOSP-N 中以单独或组合方式添加β-1,4-Galactanase 和α-1,5-Arabinanase,结果如图4 所示。对于WOSP-N而言,添加能够降解AG-I 型果胶的β-1,4-Galactanase和α-1,5-Arabinanase 后,WOSP-N 的分子量均未发生明显变化,说明WOSP-N 不含有AG-I 型果胶。由于以Ara 和Gal 为主的AG 型果胶主要包括AG-I 型和AG-II 型,结合单糖及红外分析结果,推测WOSP-N主要是由AG-II 型果胶(β-1,3/6-Galp和α-1,3-Araf)结构域组成。
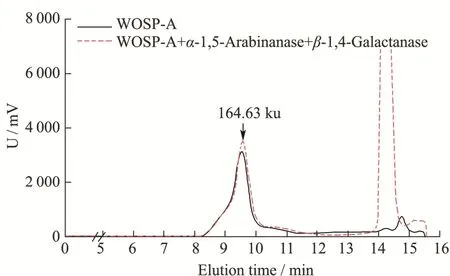
图4 组合添加半乳聚糖酶和阿拉伯聚糖酶水解WOSP-N 前后分子量变化图Fig.4 Molecular weight distribution of WOSP-N after enzymatic hydrolysis by β-1,4-Galactanase and α-1,5-Arabinanase
2.6 山芹菜多糖体外抗氧化能力分析
三种多糖的体外抗氧化活性实验结果如图5、6、7和8所示。WOSP的DPPH·清除力明显高于WOSP-A和WOSP-N(图5),当质量浓度达到1 mg/mL 时,清除率达到50%左右,且随浓度增加呈现明显上升趋势,当质量浓度达到10 mg/mL 时,自由基清除能力与Vc 的清除能力相当;WOSP-A 和WOSP-N 质量浓度低于5 mg/mL 时,清除DPPH·能力较低;质量浓度高于5 mg/mL 时,清除DPPH·能力明显上升。研究表明,多糖中的单糖以糖苷键形式连接,其中含有游离醛基或酮基的单糖具有还原性,它们可以提供氢,氢可以与自由基结合来终止自由基反应,抗氧化活性可能与分子大小和构象有关[25,26],WOSP-A 对DPPH·的清除能力高于WOSP-N,说明随着分子量的升高,多糖清除DPPH·的能力逐渐下降。朱晓冉等[27]探究不同分子量黑木耳多糖的抗氧化能力时发现,小分子量的黑木耳多糖清除DPPH·的能力更强。WOSP 对DPPH·的清除能力明显高于WOSP-A 和WOSP-N,当多糖溶解于水后呈现不同链构象,会影响其生物活性,具体关系还有待进一步探究。从结果来看,推测山芹菜抗氧化能力是酸性糖和中性糖在协同发挥作用。
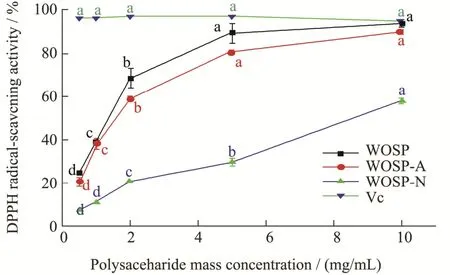
图5 WOSP、WOSP-A 和WOSP-N 的DPPH·的清除能力Fig.5 DPPH free radical scavenging ability of WOSP,WOSP-A and WOSP-N
三种多糖对O2-·的清除能力呈现一定的浓度依赖性,随着浓度的增加,多糖对O2-·的清除率逐渐增强,其中WOSP 的清除能力比WOSP-A 和WOSP-N 强,当溶度达到10 mg/mL 时,清除O2-·能力与Vc 相当(图6)。O2-·是基态氧接受电子后形成的,容易在体内产生且发生转化[28],因此评价O2-·清除能力十分有必要。多糖能够催化O2-·与氢离子结合,因此不同分子量可能是影响O2-·清除能力的原因之一,Wu 等[29]研究坛紫菜多糖发现抗氧化活性大小与分子量呈负相关。通过比较多糖的分子量大小可知,其中WOSP-N的分子量大于WOSP-A,因此抗氧化活性较低。而WOSP 中包含WOSP-A 和WOSP-N,具有更多的醛酮类强电基团,因而具有更强的清除O2-·能力。
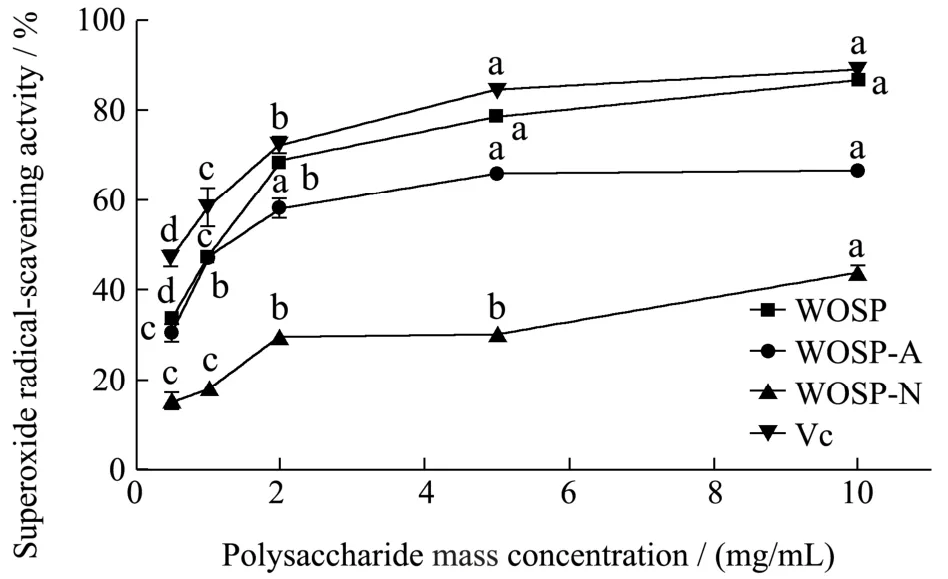
图6 WOSP、WOSP-A 和WOSP-N 的O2-·的清除能力Fig.6 Superoxide anion free radical scavenging ability of WOSP,WOSP-A and WOSP-N
三种多糖对·OH 清除能力随着浓度的增加而增加,呈现一定的浓度依赖性,但三者之间对·OH 的清除能力无明显差异,均不如Vc(图7)。·OH 氧化能力强,会造成多糖解聚、核酸断裂等,与衰老作用等有关。国内外已将抗氧化检测用于抗衰老等保健食品的评价[30,31]。·OH 清除能力与多糖中总糖含量相关,而三种多糖总糖含量接近,因此其·OH 清除能力接近。研究显示抗氧化活性也与某些特定的单糖及衍生物相关,如岩藻糖、鼠李糖和糖醛酸含量高时多糖清除·OH能力较强[32],而本研究中三种多糖的单糖组成中岩藻糖和鼠李糖的含量极低,因此整体而言·OH 清除能力较低,其中WOSP-A 糖醛酸含量高,所以在三种多糖中的·OH 清除能力相对较好。
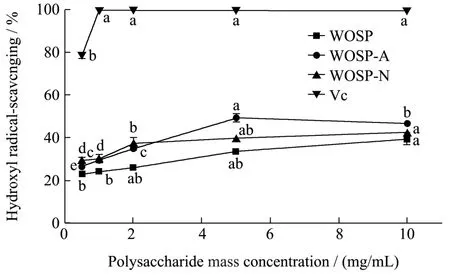
图7 WOSP、WOSP-A 和WOSP-N 的·OH 的清除能力Fig.7 Scavenging ability of hydroxyl radicals of WOSP,WOSP-A and WOSP-N
三种多糖对Fe3+的还原能力结果如图8 所示。WOSP 具有一定的Fe3+还原能力,且呈现出明显的浓度依赖性;而WOSP-A、WOSP-N 对Fe3+的还原能力较弱,且不随浓度变化呈现出明显的变化趋势。研究表明,多糖可以与产生活性氧所必须的金属离子形成络合物[33,34],因此多糖可以抑制活性氧自由基的产生,从而达到抗氧化目的,其抗氧化能力与单糖中的Ara和Glc 等有关[35],而WOSP 中含有较多的Ara,所以表现出较强的Fe3+还原能力,此外也有研究表明,大分子量的多糖不容易结合活性位点[27],因此WOSP-N的还原能力较弱。
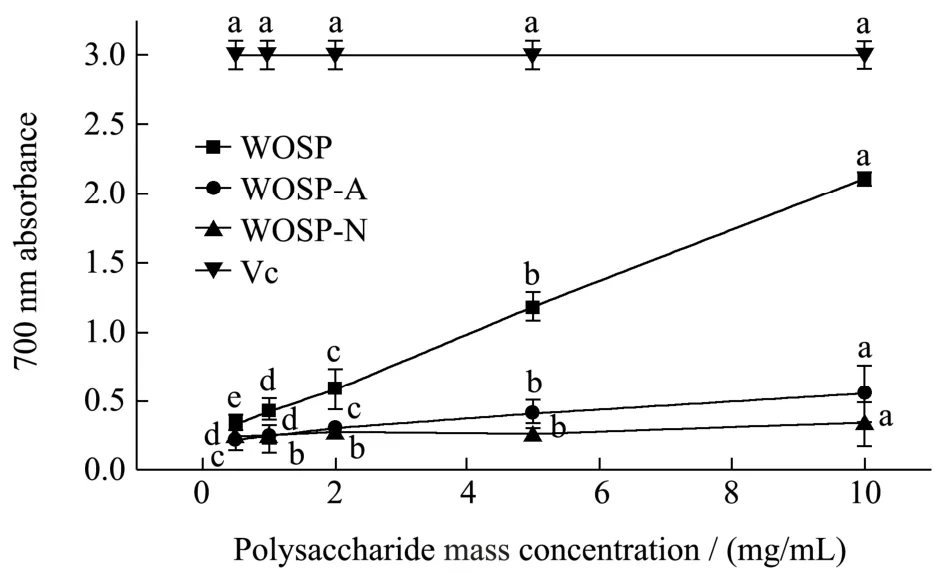
图8 WOSP、WOSP-A 和WOSP-N 对Fe3+的还原能力图Fig.8 Reduction capacity of polysaccharide from WOSP,WOSP-A and WOSP-N to iron
通过以上四种抗氧化测定结果对比可知,四种方法下多糖的抗氧化能力均有浓度依赖性。研究结果与双参多糖、紫菜多糖、罗汉果多糖、山药多糖的抗氧化结果相似[36,37],均在一定多糖浓度范围内,其抗氧化能力与浓度呈现正相关。WOSP 的抗氧化活性整体而言要强于WOSP-A、WOSP-N,在这四种方法中,对DPPH·清除能力和对O2-·清除能力较好,因为WOSP-N 中GalA 含量低,其抗氧化活性不如WOSP,而目前有研究表明其抗氧化能力依赖于氢的供体能力[38],但具体机制研究尚未明确。
3 结论
本文采水提醇沉法从山芹菜中提取WOSP,用DEAE 离子交换柱层析法对WOSP 分离纯化得到WOSP-A 及WOSP-N,得率分别为51.34%和2.55%,通过HPGPC 法测定两个级分的分子量主要分布在14.21 ku 左右和169.36 ku 左右。结合红外、单糖及酶解分析结果说明,三种多糖均含有多糖的特征吸收峰,WOSP 和WOSP-A 中GalA、Gal 和Ara 的含量较高,WOSP-A 中GalA 所占比例达到46.99%,WOSP-N 中Gal 和Ara 的含量较高,GalA(4.43%)含量较低,与WOSP-A 结果存在差异。推测WOSP-A 是以GalA、Gal 和Ara 为主的HG 型和AG-I 型果胶结构域构成,WOSP-N 是以Gal 和Ara 为主的AG-II 果胶结构域构成。以Vc 为阳性对照,比较三种多糖组分对DPPH·、、·OH 的清除能力及对Fe3+的还原能力,WOSP的抗氧化活性强于WOSP-A 和WOSP-N,四种方法中对DPPH·清除能力和对O2-·清除能力较好,在WOSP浓度为10 mg/mL 时,清除率分别达到96.42%和86.69%,推测可能是由于WOSP 包含WOSP-A 和WOSP-N,它们之间存在协同作用,另外产生这种差异也可能与多糖的糖苷键类型等因素有关[39],具体机制有待进一步研究。本文结果为山芹菜的深度开发利用提供了理论研究基础,为东北地区山野菜的精深加工提供新策略。
