miR-99a通过下调RRM2抑制人子宫颈癌HeLa细胞系增殖、迁移和侵袭
2022-11-07贺春花张小柳
贺春花,刘 冷,张小柳
(荆门市第一人民医院 妇科, 湖北 荆门 448000)
宫颈癌(cervical cancer,CC)是全球范围内女性第四大常见癌之一,全世界每年约有53万新发CC患者,总体病死率达半数以上,其中发展中国家高达85%[1]。目前,手术及放射和化学治疗(简称放化疗)治疗CC已取得很大进步,然而,CC复发及病灶转移仍是影响患者预后的主要原因[2]。故而,探究CC细胞增殖及转移相关机制已成为临床研究热点。微RNA(microRNA,miRNA)可通过与其靶基因结合进而调控肿瘤进展。过表达miR-99a抑制CC细胞增殖、侵袭及转移[3]。核糖核苷酸还原酶小亚基M2(ribonucleotide reductase subunit M2,RRM2)是DNA合成及修复的限速酶,是肿瘤发生发展过程的关键酶[4]。抑制RRM2表达增加CC细胞的化疗敏感性[5]。miR-99a可通过靶向下调RRM2表达抑制转移性肾透明细胞癌细胞增殖及转移[6]。然而,miR-99a是否通过靶向调控RRM2参与CC细胞生物学行为过程尚不可知。本研究旨在探讨miR-99a与RRM2的关系及二者对CC细胞增殖、侵袭及转移的影响,以期为CC寻找新型生物治疗靶标提供参考。
1 材料与方法
1.1 细胞与主要试剂
人子宫颈癌HeLa细胞系(北京百欧博伟生物技术有限公司)。MEM培养基、蛋白提取试剂盒和LipofectamineTM3000转染试剂盒(焦作云之羽生物科技);靶向RRM2的siRNA(RRM2-siRNA)(上海普迈生物科技公司);miR-99a抑制剂(miR-99a-inhibitor)与其阴性对照(inhibitor-NC)(上海百奥生物公司);3-(4,5-二甲基噻唑-2)-2,5-四甲基偶氮噻唑蓝(MTT)(上海索宝生物科技有限公司);反转录试剂盒、AceQqPCR SYBR Green Mix和双荧光素酶报告基因检测试剂盒(武汉纯度生物公司);增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、E-钙黏附蛋白(E-cadherin)、N-钙黏附蛋白(N-cadherin)、波形蛋白(vimentin)、RRM2、β-肌动蛋白(β-actin)和HRP标记山羊抗兔二抗(均武汉菲恩生物科技有限公司);异硫氰酸酯(FITC)(北京伊塔生物科技公司);4’,6-二脒基-2-苯基吲哚(DAPI)(上海吉至生化科技有限公司)。
1.2 方法
1.2.1 细胞的分组及处理:对数增殖期的HeLa细胞接种于24孔板(2.5×104个/孔),24 h后,将细胞分组:对照组(control)、阴性对照组(inhibitor-NC)、抑制miR-99a表达组(miR-99a-inhibitor)、共转染组(RRM2-siRNA+miR-99a-inhibitor)。严格按照LipofectamineTM3000转染试剂盒说明书操作,转染相应的inhibitor-NC(50 pmol/μL)、miR-99a-inhibitor(50 pmol/μL)或RRM2-siRNA(5 μL)培养细胞48 h。
1.2.2 MTT法检测细胞增殖率:将细胞重悬后接种于24孔板(2.5×105个/孔),24 h后添加20 μL MTT,4 h后测定490 nm处各孔细胞吸光度(absorbance,A)值。实验组与对照组A值的比值即为细胞相对增殖率(%)。
1.2.3 平板集落检测集落形成:细胞种植于6孔板(1×103个/孔),常规培养14 d,多聚甲醛固定后结晶紫染色,拍照并以集落成数量与接种细胞数量的比值来表示集落形成率。
1.2.4 划痕愈合实验检测迁移能力:细胞种植于24孔板(2.5×105个/孔),培养细胞,至其汇合度达70%~90%,使用100 μL枪头进行划痕,更换无血清的培养基培养,显微镜下观察0、24 h划痕宽度。划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.5 Transwell小室法检测侵袭能力:无血清培养基稀释的细胞种植至含Matrigel的Transwell小室上室中(3×103个/孔),下层补充加入600 μL正常培养基,24 h后用多聚甲醛固定,结晶紫染色。显微镜下拍照、统计侵袭细胞数。
1.2.6 Western blot检测蛋白质表达:细胞总蛋白质通过RIPA提取,BCA对蛋白质进行定量,定量、变性后的蛋白质经电泳后转膜,封闭后加入抗体在4 ℃过夜,加入山羊抗兔二抗孵育1 h,添加ECL显色液于凝胶成像仪中采集图像,Image J分析蛋白质条带的A值。目的蛋白A值与内参β-actin的A值的比值表示为目的蛋白的相对表达水平。蛋白质样品充足,所有蛋白质均使用同一份样品跑两块胶,一块做内参,一块做目的蛋白。
1.2.7 免疫荧光法检测E-cadherin、N-cadherin、vimentin定位及表达情况:接种细胞于无菌载玻片中,待细胞增殖汇合度达70%~90%,多聚甲醛固定,0.1% Triton-X100透膜20 min,加入一抗E-cadherin、N-cadherin、vimentin,4 ℃过夜;加入FITC标记羊抗兔二抗孵育30 min,DAPI染色5 min,荧光显微镜拍照观察。
1.2.8 双荧光素酶报告基因实验:TargetScan网站结果显示,miR-99a与RRM2存在结合位点,根据预测结果,将含miR-99a存在结合位点的RRM2-3′UTR片段及突变片段插入到pGL4载体中,构建RRM2野生型质粒(RRM2-WT),并构建突变型质粒(RRM2-MUT)。将其与与inhibitor-NC、miR-99a-inhibitor通过LipofectamineTM3000试剂共转染HeLa细胞,转染48 h后,按照双荧光素酶试剂盒方法检测相对荧光素酶活性。
1.2.9 RT-qPCR检测miR-99a、RRM2 mRNA表达:细胞总RNA通过TRIzol法获得,经反转录合成cDNA。参照试剂盒说明书进行RT-qPCR检测。引物序列见表1,以β-actin和U6为内参,以2-△△Ct法计算miR-99a、RRM2 mRNA的相对表达量。

表1 引物序列及扩增长度
1.3 统计学分析
2 结果
2.1 各组HeLa细胞增殖情况比较
与对照组比较,抑制miR-99a表达组HeLa细胞增殖率和克隆形成率增高(P<0.05),与抑制miR-99a表达组相比,共转染组HeLa细胞增殖率和克隆形成率降低(P<0.05)(表2,图1)。

From left to right, the clone formation rate of HeLa cell plates gradually increased, but there was no significant difference between the first two pictures

表2 各组HeLa细胞增殖情况比较
2.2 各组HeLa细胞迁移及侵袭情况比较
与对照组相比,抑制miR-99a表达组HeLa细胞划痕愈合率升高,侵袭细胞数量增多(P<0.05),与抑制miR-99a表达组相比,共转染组HeLa细胞划痕愈合率降低,侵袭细胞数量减少(P<0.05)(图2,3,表3)。

Scratch healing rate of HeLa cells gradually increased from left to right, and there was no significant difference between the first two pictures

表3 各组HeLa细胞迁移及侵袭比较
2.3 各组HeLa细胞RRM2、增殖、侵袭及迁移相关蛋白表达比较
与对照组相比,抑制miR-99a表达组HeLa细胞中RRM2、PCNA、N-cadherin、vimentin蛋白水平上调,E-cadherin水平下调(P<0.05);与抑制miR-99a表达组相比,共转染组HeLa细胞RRM2、PCNA、N-cadherin、vimentin蛋白水平下调,E-cadherin蛋白水平上调(P<0.05)(图4,5)。
2.4 免疫荧光检测结果
E-cadherin、N-cadherin蛋白主要定位于细胞质,vimentin蛋白主要定位于细胞膜。与对对照组相比,抑制miR-99a表达组HeLa细胞N-cadherin、vimentin蛋白荧光信号增强,E-cadherin蛋白荧光信号减弱;与抑制miR-99a表达组相比,共转染组HeLa细胞N-cadherin、vimentin蛋白荧光信号减弱,E-cadherin蛋白荧光信号增强(图6)。
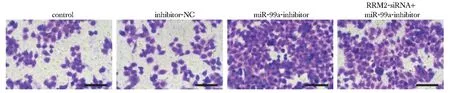
From left to right, the number of HeLa cells invaded gradually increases, and there is no significant difference between the first two figures

图4 各组HeLa细胞RRM2、PCNA、E-cadherin、N-cadherin、vimentin蛋白表达比较

*P<0.05 compared with control group,#P<0.05 compared with miR-99a-inhibitor group

图6 荧光显微镜下观察HeLa细胞N-cadherin、vimentin、E-cadherin蛋白免疫荧光水平
2.5 miR-99a与RRM2靶向关系验证
Targetscan(http://www.targetscan.org/)在线网站预测,miR-99a与RRM2之间存在相互作用位点(图7)。进一步结果显示,miR-99a-inhibitor-RRM2-WT组相对荧光素酶活性显著高于inhibitor-NC-RRM2-WT组(P<0.05)(图8)。

图7 miR-99a与RRM2靶向关系

*P<0.05 compared with inhibitor-NC-RRM2-WT group
2.6 各组HeLa细胞miR-99a及RRM2 mRNA水平比较
与对照组相比,抑制miR-99a表达组HeLa细胞miR-99a水平降低,RRM2 mRNA水平升高(P<0.05);与抑制miR-99a表达组相比,共转染组HeLa细胞miR-99a水平无显著差异,RRM2 mRNA水平显著降低(P<0.05)(表4)。

表4 HeLa细胞中各组miR-99a和RRM2 mRNA表达水平
3 讨论
MicroRNA与靶基因的3′-非翻译区碱基互补配对,促使信使RNA降解及转录翻译,调控基因表达[7]。miR-99a是一种单链小分子miRNA,由染色体21q上C21orf34基因的内含子所编码,在多种肿瘤中异常表达[8-9]。上调miR-99a表达可有效抑制CC细胞的增殖和侵袭[10]。PCNA是细胞增殖常用的标志蛋白,可反映肿瘤细胞增殖活性;上皮间质转化是上皮细胞向间质细胞表型转变的生物学过程,可通过削弱细胞间黏附能力及增强细胞运动能力进而促进肿瘤细胞转移[11]。其中,E-cadherin介导细胞间黏附反应,维持上皮形态结构得完整性;N-cadherin、vimentin是间质细胞相关蛋白,可通过提高肿瘤细胞的游走能力促进细胞侵袭及转移[12]。结果表明,抑制miR-99a表达HeLa细胞增殖、迁移和侵袭能力均明显上调,此外PCNA、N-cadherin、vimentin表达增强,E-cadherin表达降低。与既往研究结果一致,说明下调miR-99a表达可能促进HeLa细胞增殖、侵袭及迁移。
RRM2是DNA合成及修复过程中关键限速酶,在肿瘤细胞增殖及侵袭转移等过程中发挥重要作用[13]。RRM2在子CC组织中高表达,是影响预后的危险因素[14]。上调miR-99a可靶向抑制RRM2表达,进而阻碍转移性肾透明细胞癌细胞增殖及转移[6]。本研究结果显示,下调miR-99a表达,RRM2 mRNA及其蛋白表达均增高,且在转染miR-99a-inhibitor基础上抑制RRM2表达后,HeLa细胞增殖、侵袭及迁移能力均一定程度减弱。说明抑制miR-99a表达能促进HeLa细胞增殖、侵袭及迁移,可能与上调RRM2表达有关。经双荧光素酶报告实验验证,RRM2确为miR-99a靶基因。以上结果表明,抑制miR-99a表达可能靶向上调RRM2表达,促进HeLa细胞增殖、侵袭及迁移。
综上所述,下调miR-99a可能通过靶向上调RRM2表达促进HeLa细胞增殖、侵袭及迁移。本研究并未涉及多个细胞系重复验证,也并未探究过表达miR-99a和RRM2对HeLa细胞的影响,故实验结果具有一定的局限性。其次,CC恶性行为的作用机制极为复杂,其他关于miR-99a与下游靶基因或相关通路作用机制仍需进一步探索。
