丙泊酚对H2O2 诱导的HT22 细胞凋亡的保护作用
2022-11-07李婕王小波李春梅
李婕 王小波 李春梅
当前人口老龄化问题越来越严重,与之相关的疾病负担正日益受到社会的关注,其中年发生率显示不断提升的病症成为备受关注的重点疾病,其中就包括神经退行性疾病。全球疾病负担研究显示,目前约有超过10 亿人受到神经退行性疾病的影响,每年约有近700 万人死于该类疾病。同时,在世界卫生组织的相关预测中得知,预计到2040 年,该疾病的致死率将超过癌症[1]。虽然神经退行性疾病尤其是阿尔兹海默症(AD)和帕金森氏病(PD)等是不同性质的疾病,其明确的发病机制目前也尚不清楚,但研究表明,氧化应激(Oxidative Stress)被认为是AD 和PD 等神经退行性疾病发病的重要原因[2]。超氧阴离子、羟自由基及H2O2等ROS 积累和氧化损伤与神经退行性疾病的发病进程密切相关[2]。
沉默信息调节因子2 相关酶1(silent mating type information regulation 2 homolog 1,SIRT1) 属于一种基于烟酰胺腺嘌呤二核苷酸而形成的组蛋白脱乙酰化酶,可使P53、Ku70、FoxOs、过氧化物酶体增殖物激活受体γ 辅激活因子(PGC-1α)和核转录因子-κB(NF-κB)等多种蛋白脱乙酰化,在氧化应激和细胞凋亡发生时有一定的作用呈现。在氧化应激过程中,将导致细胞中P300/CBP 对FoxO 家族的乙酰化修饰作用提升,乙酰化的FoxO 家族可促进下游靶分子P53、P16 及P21 的转录和表达,诱导细胞凋亡和衰老。而SIRT1 可使FoxO 家族去乙酰化,促进DNA 损伤修复和抑制细胞衰老和凋亡等多种生物过程,预防各种疾病的发生[3,4]。
丙泊酚作为临床麻醉中常用的镇静药物,因具有起效迅速、短效、复苏迅速、可控性好、副作用少、首相迅速分布及消除等优点被广泛应用于外科麻醉[5,6]。本研究采用H2O2对HT22 细胞实施处理,以完成体外神经细胞损伤模型的创建,期间通过丙泊酚执行干预操作,最终观察丙泊酚是否可抑制H2O2损伤的神经元细胞凋亡,以及是否通过SIRT1-FoxO1 信号通路起到保护作用,为临床治疗、临床用药及改善患者预后提供一定的理论和实验依据。现报告如下。
1 材料与方法
1.1 试剂 丙泊酚(北京费森尤斯卡比医药有限公司);海马神经元HT22 细胞株(北京北纳创联生物技术研究所);胎牛血清、1640 培养基、0.25%胰蛋白酶均购自美国Gibco 公司;NAD/NADH 检测试剂盒(碧云天生物技术公司);SIRT1 抗体、Cleaved-Caspase3、Bax、Bcl-2、Cyt C、β-actin 抗体均购自Cell Signaling Technology 公司。
1.2 仪器 电泳仪(BioRad)、垂直电泳槽(BioRad)、湿式转膜仪(BioRad)、化学发光成像仪(Tanon)、制冰机(三洋)、4 度离心机(Thermo)、超洁净工作台(江苏通净)、水平脱色摇床(其林贝尔)、Infinite M200 Pro 型酶标仪(瑞士Tecan 公司)。
1.3 方法
1.3.1 HT22 细胞的培养 采用含10%胎牛血清的1640 培养基培养HT22,置于温度37 ℃,且含有5%CO2的专用箱中进行培养。待细胞密度达80%~90%进行0.25%胰蛋白酶消化HT22 传代培养,以进行后续实验研究。
1.3.2 CCK-8 法检测细胞存活率和筛选H2O2合适作用浓度 取培养对数期HT22 细胞,0.25%胰蛋白酶消化后调整密度至 6×104/ml,取96 孔板按每孔 100 μl的体积进行铺板。分别设对照组、H2O2组及丙泊酚组,对照组加入含1%FBS 的培养基,H2O2组加入含100 μM H2O2的1%FBS 的培养基,丙泊酚组在100 μM H2O2干预后,加入含50 μM 丙泊酚的1%FBS 培养基,培养6 h后,弃上清,加入含10%CCK-8的1640培养基,37℃孵育2 h,酶标仪450 nm 处测吸光度。
1.3.3 DCFH-DA 检测细胞内ROS 水平 选用对数生长期的 HT22 细胞,消化收集后用二十四孔板铺板,24 h 细胞贴壁后,根据实验进行相应处理因素添加。干预结束后,弃掉培养基,4℃预冷PBS 洗HT22 1 次,弃PBS。加入终浓度为5 μM 的荧光探针工作液,避光孵育20~30 min。PBS 洗HT22 1 次,检测各孔荧光强度。
1.3.4 NAD/NADH 检测试剂盒检测NAD 选用对数生长期的 HT22 细胞,消化收集后用六孔板以每孔4×105个细胞进行铺板,24 h 细胞贴壁后,根据实验进行相应处理因素添加。弃培养基,加入200 μl 的NAD/NADH 提取液,轻吹裂解细胞;按照NAD/NADH 检测试剂盒说明检测NAD 水平。
1.3.5 Westernblot 检测HT22 细胞内SIRT1、FoxO1及细胞凋亡相关蛋白Cleaved-Caspase3、Bax、Bcl-2、Cyt C 的表达水平 选用对数生长期的 HT22 细胞,消化收集后用六孔板以每孔 4×105个细胞进行铺板,24 h细胞贴壁后,根据实验进行相应处理因素添加。干预结束后,需要将上清液等剔除,并对细胞进行收集。然后,向其中加入适量的裂解缓冲液,以此在冰上匀浆裂解,温度为4℃,时间为0.5 h,12000×g 离心,最终取上清液,实施蛋白定量操作。此后,获取适量的蛋白上样,并进行电泳分离,所用为十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电转到固相支持体聚偏二氟乙烯(PVDF)膜上,10%脱脂奶粉封闭PVDF 膜45~60 min,含一抗的抗体稀释液与PVDF 膜共孵育4℃过夜,TBST 摇床洗膜3 次,5~10 min/次,含二抗的抗体稀释液与PVDF 水平摇床室温共孵育45~60 min,TBST 摇床洗膜3 次,5~10 min/次,配制适量发光液,Tanon 全自动化学发光图像分析系统检测。Image J 分析净光密度。
1.4 统计学方法 采用SPSS21.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差()表示,两独立样本比较采用独立样本t检验;多组分析采用方差分析;组间比较采用SNK 或LSD 法。P<0.05表示差异具有统计学意义。
2 结果
2.1 H2O2对HT22 细胞存活率的影响 用50、100、200、300、400、500 μM 不同浓 度H2O2处 理HT22细胞24 h 后,与对照组相比,随着H2O2浓度的增加,HT22 细胞存活率逐渐下降,差异具有统计学意义(P<0.05)。见图1。H2O2诱导细胞损伤的IC50 为234.13 μM。与对照组比较,100 μM H2O2处理HT22 细胞24 h 后,HT22 细胞存活率为75.62%。100 μM H2O2组细胞存活率明显低于对照组,差异具有统计学意义(P<0.05)。见图2。本研究通过实验摸索和调整结合参考文献最终确定100 μM 作为本次实验的处理浓度。
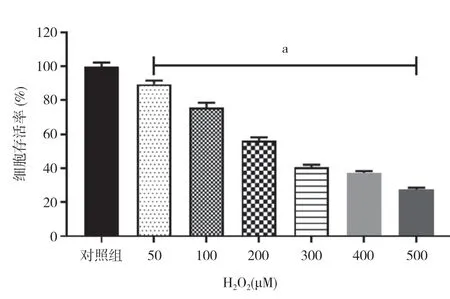
图1 H2O2 对HT22 细胞存活率的影响注:与对照组比较,aP<0.05
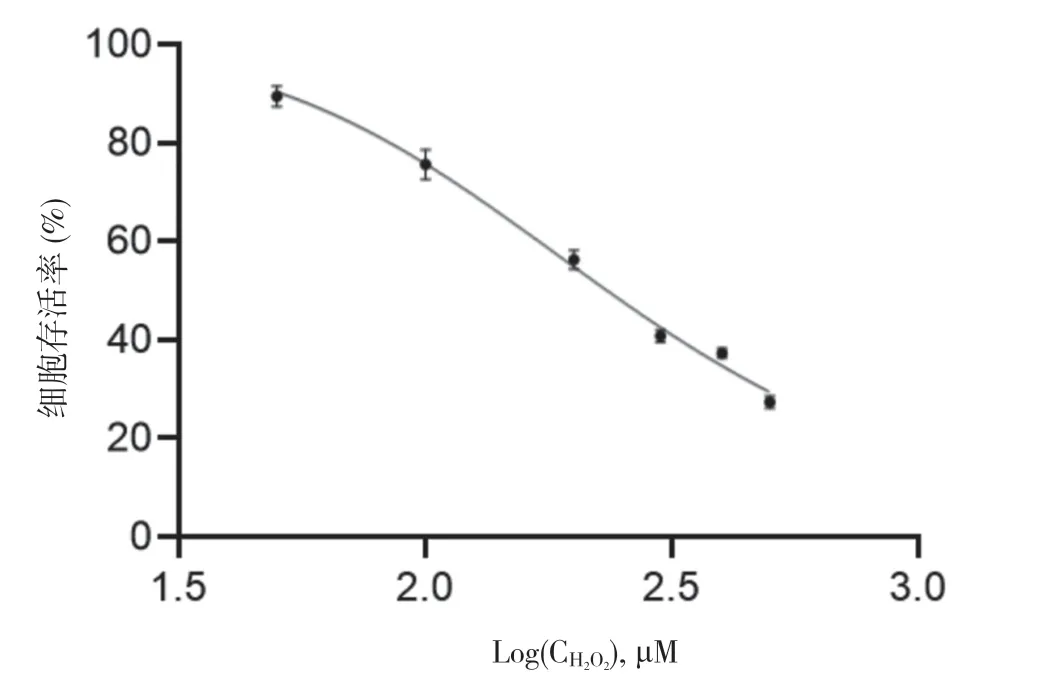
图2 H2O2 对HT22 细胞活力的浓度抑制曲线
2.2 丙泊酚对H2O2诱导的HT22 细胞存活率的影响H2O2组细胞存活率显著低于对照组,丙泊酚组高于对照组,差异均具有统计学意义(P<0.05);H2O2和丙泊酚联合处理组细胞存活率高于H2O2组,低于丙泊酚组,差异具有统计学意义(P<0.05)。见图3。
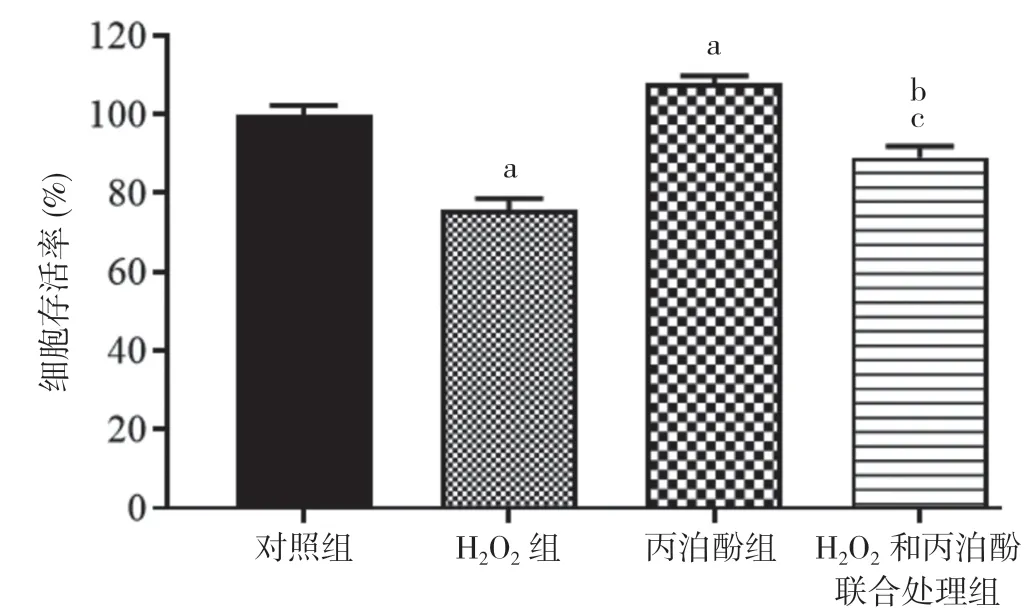
图3 丙泊酚对H2O2 诱导的HT22 细胞存活率的影响
2.3 丙泊酚对H2O2诱导的HT22 细胞内ROS 的影响H2O2组细胞内ROS 显著高于对照组,丙泊酚组低于对照组,差异均具有统计学意义(P<0.05)。H2O2和丙泊酚联合处理组细胞内ROS 低于H2O2组,高于丙泊酚组,差异具有统计学意义(P<0.05)。见图4。

图4 丙泊酚对H2O2 诱导的HT22 细胞内ROS 含量的影响
2.4 丙泊酚对H2O2诱导的HT22 细胞凋亡的影响H2O2组细胞内Cleaved-Caspase3、Bax、Cyt C 蛋白的表达水平显著高于对照组,丙泊酚组显著低于对照组,差异具有统计学意义(P<0.05)。H2O2和丙泊酚联合处理组细胞内Cleaved-Caspase3、Bax、Cyt C 的表达水平低于H2O2组,高于丙泊酚组,差异均具有统计学意义(P<0.05)。见图5,图6,图7,图8。

图5 Westernblot 检测凋亡相关蛋白的表达

图6 四组凋亡相关蛋白Bax 的表达

图7 四组凋亡相关蛋白Cleaved-Caspase3 的表达
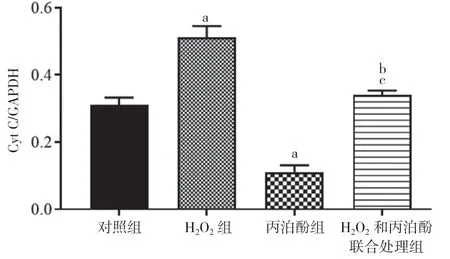
图8 四组凋亡相关蛋白Cyt C 的表达
2.5 丙泊酚对H2O2诱导的HT22 细胞内SIRT1-FoxO1 信号通 路的影 响 H2O2组细胞 内SIRT1 和FoxO1 蛋白的表达水平明显低于对照组,丙泊酚组明显高于对照组,差异均具有统计学意义(P<0.05)。H2O2和丙泊酚联合处理组细胞内SIRT1 和FoxO1 的表达水平高于H2O2组,低于丙泊酚组,差异均具有统计学意义(P<0.05)。见图9,图10,图11。

图9 Westernblot 检测SIRT1 和FoxO1 的表达
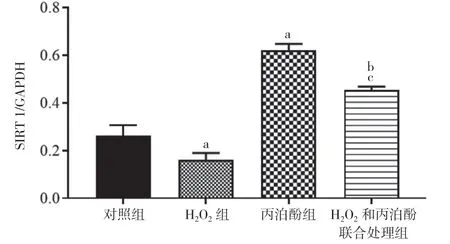
图10 四组SIRT1 蛋白的表达
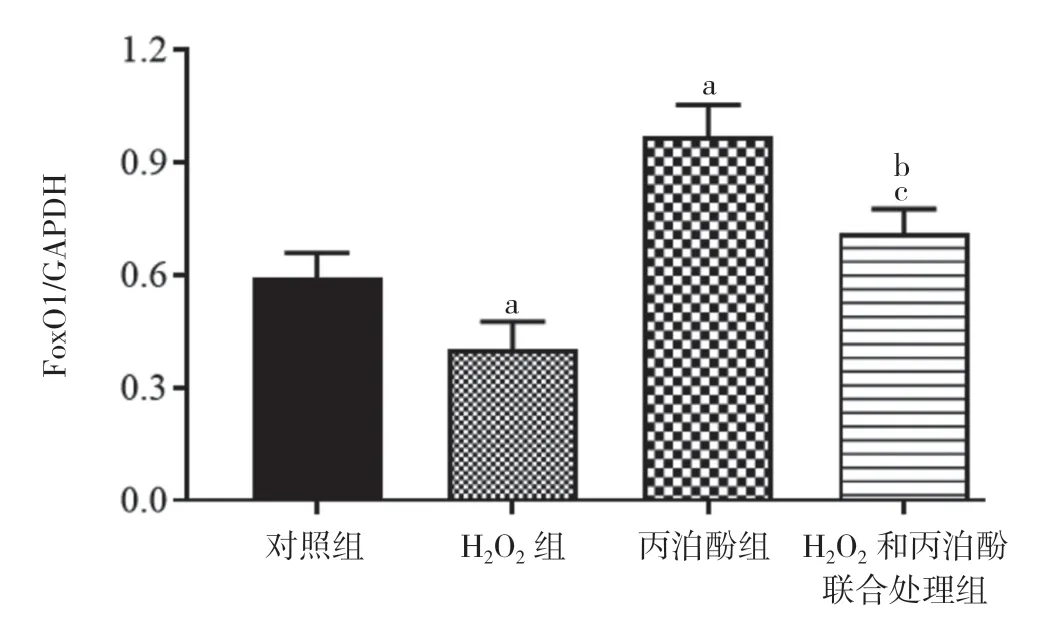
图11 四组FoxO1 蛋白的表达
2.6 丙泊酚对H2O2诱导的HT22 细胞内NAD 含量的影响 H2O2组细胞内NAD 水平明显低于对照组,丙泊酚组明显高于对照组,差异均具有统计学意义(P<0.05)。H2O2和丙泊酚联合处理组细胞内NAD 水平高于H2O2组,低于丙泊酚组,差异均具有统计学意义(P<0.05)。见图12。

图12 丙泊酚对H2O2 诱导的HT22 细胞内NAD 含量的影响
3 讨论
大量文献查阅后发现,氧化应激与神经退行性疾病的发生有不可分割的联系,表现在神经细胞中的某些物质水平增加,比如ROS[7]。在大脑运行期间,相关组织对氧气的消耗量较大,加之脂质含量相对较高,所以会使得相应细胞中的上述物质大量形成并堆积,因此大脑组织易受氧化应激的影响。同时因神经元质膜中不饱和脂肪酸比较多,所以神经元对ROS 高度敏感。氧化应激是PD 和AD 等神经退行性疾病出现的关键原因[2]。研究表明海马神经元为AD 患者大脑组织中最先作出反应的神经元细胞,而且其中还有大量的内源性糖皮质激素受体,导致其更容易被氧化应激所“控制”,也就使得氧化应激与AD 的发生、发展都有着密切关联[7],可见氧化应激是导致该类疾病发生以及加重的重要因素之一;同时神经元对于氧化应激高度易感,本研究采用H2O2对HT22 细胞实施处理以完成体外神经细胞损伤模型的创建。实验结果表明,H2O2可降低 HT22 细胞存活率,且具有浓度依赖性。
研究人员总结临床病例时发现,丙泊酚可通过减少术中血流量,缩短脑损伤患者的康复时间而满足脑外科手术的基本镇静需求[8]。实验研究表明丙泊酚可通过PI3K/Akt 信号通路,提高颅内血肿SD 大鼠的神经功能评分,减轻SD 大鼠的神经水肿和炎症[9]。丙泊酚可通过降低脑局部血流量、降低神经系统高量代谢、减轻水肿及减少出血周边坏死等作用减少脑组织损伤,从而起到保护作用[6]。研究表明脑出血患者行血肿摘除术时应用丙泊酚镇静可明显降低其死亡率,改善术后认知功能,但其具体作用机制不清[6]。因此本研究采用H2O2对HT22 细胞实施处理以完成体外神经细胞损伤模型的创建,并应用丙泊酚进行干预,在细胞水平上观察到丙泊酚对神经元细胞起到了一定的保护作用。本实验研究结果表明丙泊酚可提高H2O2损伤后的HT22 细胞存活率,减少细胞凋亡。进一步实验观察到,丙泊酚可降低H2O2损伤后的HT22 细胞内ROS 含量,这一结果表明丙泊酚可降低HT22 细胞的氧化损伤,从而起到保护细胞的作用。本研究在体外实验证实了丙泊酚在脑外科临床应用中可能的重要保护作用,为临床治疗、临床用药及改善患者预后提供一定的理论和实验依据。
研究表明SIRT1-FoxO1 信号通路会对氧化应激等反应进行一系列调节,以参与到细胞从生长到凋亡的全过程[10]。氧化应激可降低细胞内SIRT1 酶的活性,而SIRT1 则是在FoxO 途径下实现对抗氧化物表达的强化,同时抑制SIRT1 活性可上调NF-κB 信号通路,诱导炎症反应[10]。研究表明人成神经细胞瘤SHSY5Y 细胞经β-拉帕醌诱导后,细胞内SIRT1 活性会出现一定的提升,同时FoxO1 核转位也提升,自噬水平增加,细胞毒性降低。同时提高细胞内SIRT1 的活性,可减少PolyQ 蛋白聚合物并降低细胞毒性,同时伴有FoxO1表达上调[11]。同时另有研究表明。过表达SIRT1,会使得PolyQ 毒性扩散的影响降低,新杆状线虫神经元损伤程度也会减小,不过这个过程中应有FoxO 及其伴侣 β-连环蛋白参与。因此SIRT1-FoxO 还有一定的保护神经元的能力[12,13]。本研究发现H2O2可降低SIRT1 和 FoxO1 的表达,表明氧化应激具有降低细胞内SIRT1 酶的活性和降低细胞抗氧化应激的能力。在氧化应激过程中,将导致细胞中P300/CBP 对FoxO 家族的乙酰化修饰作用提升,乙酰化的FoxO 家族可促使下游靶分子P53、P16 及P21 的转录和表达,诱导细胞凋亡和衰老。而SIRT1 可使FoxO 家族去乙酰化,促进DNA 损伤修复和抑制细胞衰老和凋亡[3,4]。为了进一步探讨丙泊酚干预后减轻细胞损伤可能的分子机制,本实验发现,在H2O2诱导的损伤模型中,丙泊酚处理后,SIRT1 和 FoxO1 表达增加。这一结果提示丙泊酚能够激活SIRT1-FoxO1 信号通路减轻细胞内ROS 水平和降低细胞凋亡。
综上所述,丙泊酚对H2O2诱导HT22 细胞损伤具有的保护作用,其作用机制可能与激活SIRT1-FoxO1信号通路来减轻氧化应激水平,降低细胞凋亡有关。
