眼内液检测在病毒性视网膜炎中的临床应用
2022-11-06郝昕蕾王文俊陈刘贵杨安怀
郝昕蕾 肖 璇 金 玮 王文俊 袁 满 陈刘贵 杨安怀
武汉大学人民医院眼科中心 湖北 武汉 430060
血‑眼屏障的存在使眼球内部成为一个相对独立的微型免疫环境。眼内液是眼球内部液体的统称,主要包括房水和玻璃体液,可以直接反映眼内微环境的改变,有利于明确疾病的病因诊断,了解病情的发展演变,判断预后和指导临床治疗[1‑4]。由于眼内液样本量通常较少,使得传统检测方法有所限制;随着宏基因组学第二代测序技术(metage‑nomics next generation sequencing,简称宏基因组测序)、免疫学检测技术和微量样本检测技术的发展,眼内液检测在眼部疾病中的临床应用价值显著提升,尤其在感染性眼病方面[5‑7]。本研究主要通过分析病毒性视网膜炎患者的眼内液检测结果,对眼内液的临床应用进行评价。
1 资料与方法
1.1 临床资料对2019 年6 月至2021 年2 月在武汉大学人民医院就诊并进行眼内液检测的病例进行回顾性分析。共20 例20 眼入选,女性8 例,男性12 例;年龄 12~56(40.35±11.83)岁。其中,10 例诊断为病毒性视网膜炎,为本文的主要研究对象;10 例非感染性葡萄膜炎作为对照。所有患者入院时均已进行验光、眼压、裂隙灯、间接眼底镜检查,必要时行 B 超、眼底照相、OCT、OCTA、FFA、IC‑GA 等检查,诊断仍不明确者进行眼内液检测。纳入标准为:(1)通过病史采集、眼部症状与体征、眼科局部与全身系统性辅助检查等手段无法确定疾病病因,有必要进行眼内液检测;(2)患者同意眼内液检测,且检测至少包括一种细胞因子。细胞因子的检测项目主要包括:白细胞介素(IL)‑6、IL‑8、IL‑10、血管内皮生长因子(VEGF)、细胞黏附分子(VCAM)、碱性成纤维细胞生长因子(BFGF)。检测样本:房水9 个,玻璃体液11 个。因诊疗需要,医师建议眼内液检测,患者拒绝该项检查的病例不纳入本项研究。本研究通过武汉大学人民医院伦理委员会批准,并取得患者书面知情同意。
1.2 样本采集方法
1.2.1 房水采集 穿刺操作在经紫外线消毒的环境下进行。前房穿刺前频点抗生素眼药水(每5 min 1 次,至少6 次),点表面眼麻药于结膜囊内(每3 min 1 次,至少3 次),进行皮肤消毒,结膜囊冲洗,在裂隙灯显微镜前行前房穿刺术,嘱患者保持眼球固定,使用1 mL 胰岛素注射器于5 点方位向7 点方位进针,抽出0.05~0.1 mL 房水后拔出针头,保证前房维持一定深度。术后抗生素眼水频点。
1.2.2 玻璃体液采集
1.2.2.1 玻璃体穿刺抽液术 手术室要求及眼部处理同内眼手术。嘱患者注视上方,将一连有注射器的23G 针头于下方角膜缘后3.5 mm 做巩膜斜行穿刺口,经睫状体平坦部垂直进针于玻璃体腔,抽取玻璃体液。若玻璃体液化不全,可旋转针头或改变针头的角度及位置,抽取标本。术后予抗生素眼水并包扎。
1.2.2.2 玻璃体切除 术中获取玻璃体液手术室要求及眼部处理同眼后段手术。采用23G 微创玻璃体切除手术系统,于角膜缘后3.5 mm 经巩膜斜行穿刺后垂直进针,建立经睫状体平坦部玻璃体切割三通道,置入玻璃体切割套管和灌注管,在确保没有灌注液进入玻璃体腔的情况下,旋开玻璃体切除器的管道螺旋帽,连接注射器,设置切割频率≥2 500 次/min,踩动脚踏板,缓慢抽取玻璃体液。打开灌注,恢复眼压后继续完成玻璃体切除手术或拔出套管并检查穿刺口。术后处理同前。
1.3 统计学方法采用SPSS 26.0 统计学软件进行数据描述与统计分析。以患眼数据纳入统计。数据以均数±标准差()表示。对病毒性视网膜炎患者眼内液中病毒核酸的拷贝量和细胞因子含量的相关性做Spearman 相关性分析。对病毒性视网膜炎和非感染性葡萄膜炎患者的细胞因子差异行非参数秩和检验(Mann‑WhitneyU检验)。对两组间各细胞因子检出阳性率的差异行卡方检验(Fisher 确切概率法)。P<0.05 为差异具有统计学意义。
2 结果
2.1 10 例病毒性视网膜炎患者的眼内液结果10例病毒性视网膜炎患者中,7 例为水痘‑带状疱疹病毒(varicella zoster virus,VZV)感染,2 例为巨细胞病毒(cytomegalovirus,CMV)感染,1 例为单纯疱疹病毒(herpes simplex virus,HSV)感染,其临床资料与眼内液结果如表1 和表2 所示。
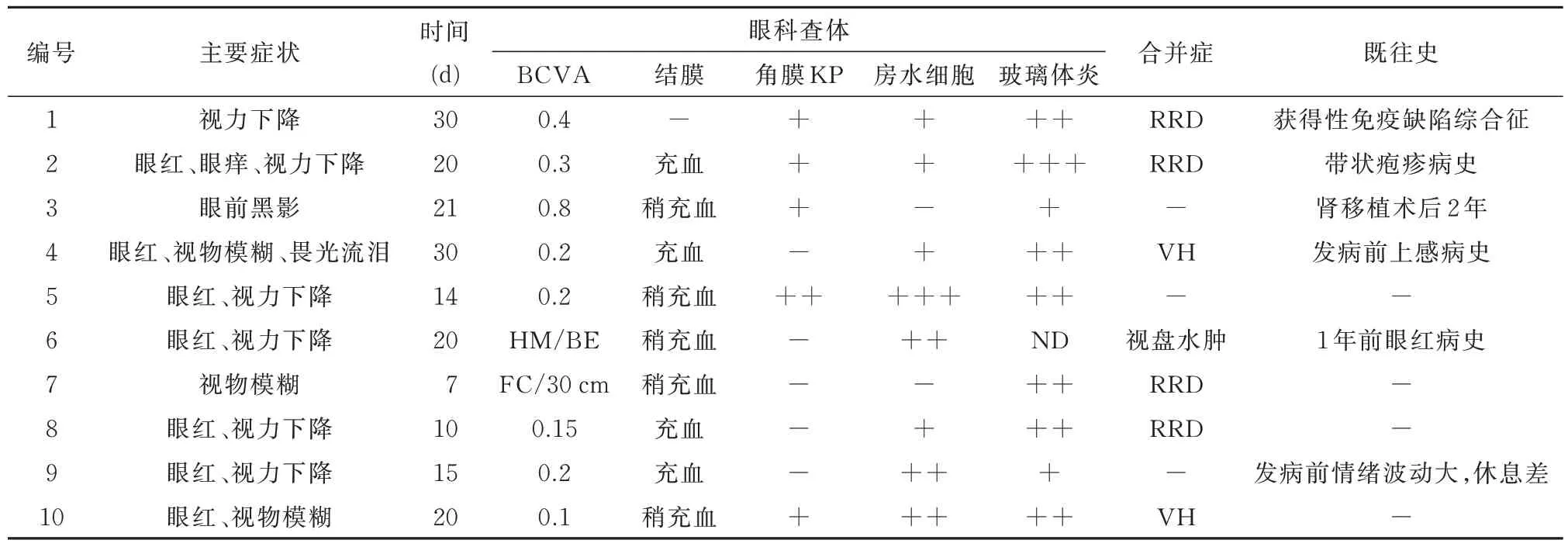
表1 病毒性视网膜炎患者的临床资料
分别对眼科查体结果、各类细胞因子含量与病毒的拷贝量进行相关性分析,发现入院视力、前房炎性细胞、玻璃体炎程度等均与病毒拷贝量无明显相关性,而IL‑6、IL‑8 含量与病毒拷贝量之间存在显著的正相关关系(P=0.005,rs=0.806;P=0.005,rs=0.806),IL‑10、VEGF、VCAM、BFGF 数值与病毒拷贝量之间没有显著相关性(P=0.907、0.347、0.293、0.565)。
2.2 病毒性视网膜炎和非感染性葡萄膜炎患者眼内液细胞因子的比较
2.2.1 病毒性视网膜炎和非感染性葡萄膜炎患者眼内液细胞因子含量差异 10 例病毒性视网膜炎患者眼内液中细胞因子含量如表2 所示,与非感染性葡萄膜炎患者的各类细胞因子相比,IL‑6、IL‑8、IL‑10、VCAM 的含量在两类患者中具有显著性差异(均为P≤0.001),而 VEGF 和 BFGF 含量在两类患者中无明显差异(P=0.058、0.263)。
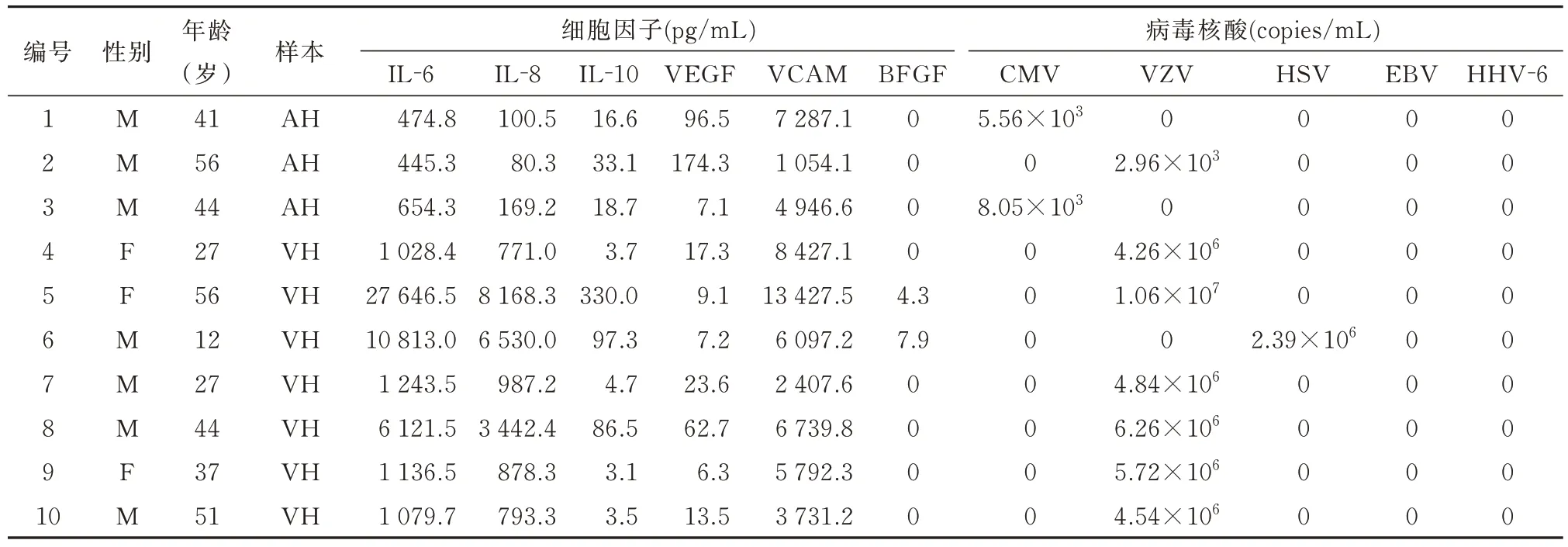
表2 病毒性视网膜炎患者的眼内液检测结果
2.2.2 病毒性视网膜炎和非感染性葡萄膜炎患者眼内液细胞因子阳性率差异 对10 例病毒性视网膜炎和10 例非感染性葡萄膜炎眼内液细胞因子阳性率进行分析,其中,IL‑8、IL‑10、VCAM 的阳性率在两类患者中具有显著性差异(P=0.003、0.011、0.001),而 IL‑6、VEGF 和 BFGF 阳性率在两类患者中无明显差异(P=0.211、0.211、0.628)。
3 讨论
眼部感染是眼病致盲的重要原因之一,病原微生物的多样性使感染性眼病的病原体检出具有挑战性[5]。病原微生物培养的阳性率为40%~70%,现有的检测方法仅针对部分明确致病的病原体[5,8],眼内液样本量较少也限制了微生物的检出。
随着宏基因组测序技术的发展,眼内液在感染性眼病中的应用范围扩大,它可以无偏倚地检出微量样本中所有已知或未知的病原体,包括细菌、真菌、寄生虫、DNA 或 RNA 病毒[9‑12]。相对于传统的细菌培养或PCR 方法,宏基因组测序敏感性更高[5]。有学者借助宏基因组测序技术在所有细菌培养呈阴性和部分培养呈阳性的眼内炎患者的眼内液标本中发现Torque Teno 病毒,并被qPCR 确证[6];Li 等[12]利用宏基因组测序技术在 20 个感染性角膜炎患者的角膜样本(多聚甲醛溶液固定)中发现18 个样本的细菌、真菌、阿米巴原虫、巨细胞病毒等病原体;Gonzales 等[9]借助宏基因测序检出 EBV和HHV‑8 合并感染以及MYD88 基因突变。
本研究纳入的10 个病毒性视网膜炎患者,依据眼内液检测,7 例为 VZV 感染,2 例为 CMV 感染,1例为HSV 感染。尽管不同种病毒感染的治疗手段相似,随着患者对自身病情了解欲望的不断提高、信息获取深度逐渐加深,医者亦需在可靠证据的基础上为患者提供更精准的医疗信息[13]。
IL‑6、IL‑8 和 IL‑10 作为促炎症细胞因子,提示眼内炎性反应存在,既往研究中发现其含量在非感染性葡萄膜炎或感染性眼病中高于健康人[14,15];VCAM 在炎症中也发挥作用,它参与内皮细胞内的信号通路,促使白细胞迁移[16];VEGF 具有较强的促新生血管生成作用,亦有研究报道其与眼部炎症相关[14,17];BFGF 作为成纤维细胞生长因子,与纤维增生有一定关联。本研究发现IL‑6、IL‑8 含量与病毒拷贝量之间存在显著的正相关关系,提示眼内病毒载量越高,眼内炎性反应越重。已有文献指出,在病毒性视网膜炎患者中,房水中IL‑6 和IL‑8 水平与病毒核酸明显相关(P<0.001,r=0.327;P<0.001,r=0.381)[18],与本文结论相符,但本研究中二者相关性更高。
以往研究中,多将非感染性葡萄膜炎或感染性眼病患者与健康人做对照,本研究将病毒性葡萄膜炎患者作为主要研究对象,以非感染性葡萄膜炎患者作为参照进行分析。在10 例非感染性葡萄膜炎中,4 例患者发作2 次以上或激素治疗效果欠佳,6例患者拒绝经验性激素治疗,取得患者同意后行眼内液检测。在病毒性视网膜炎和非感染性葡萄膜炎患者的眼内液中,IL‑6、IL‑8、IL‑10、VCAM 的含量在两者之间存在显著性差异;其中,IL‑8、IL‑10、VCAM 的阳性率在两者中具有显著性差异:提示病毒性视网膜炎患者的眼内炎性反应较严重。IL‑6在两组病例中均为阳性率最高的细胞因子,且数值在病毒性视网膜炎中显著高于非感染性葡萄膜炎。有学者指出,非感染性葡萄膜炎患者房水中IL‑6 浓度高于健康对照组,所有患者房水中均可检出,与前房炎性细胞呈正相关[19],可见 IL‑6 与眼内炎性反应的紧密联系。需要注意的是,细胞因子仅提示眼内炎性反应的剧烈程度,不能用于确诊疾病。
细胞因子对病毒性视网膜炎的治疗终点亦有提示作用。有学者对骨髓造血干细胞移植术后发生巨细胞病毒性视网膜炎(cytomegalovirus retini‑tis,CMVR)的患者进行前瞻性随机对照研究,将24个进行玻璃体腔注射抗病毒药物的患者,根据治疗终点不同分为两组,第一组治疗终点:房水CMV‑DNA<1×103copies/mL,第二组:房水CMV‑DNA<1×103copies/mL 或 IL‑8<30 pg/mL,证实后者的安全性和有效性,可减少球内注药次数[20]。Qian等[15]对 HIV 阴性的 CMVR 病例进行研究,证明 IL‑8 作为终止球内注药指征的可靠性与前者结论一致。
眼内液检测不仅可以发现眼内病毒感染,也可以检出细菌、真菌、寄生虫等病原体[6,10,12,21];不仅可以检出已知病原体,对未知病原体也有应用价值,同时可以检出多重感染[6]。眼内液检测也有助于识别伪装综合征,IL‑10 和 IL‑6 对原发性玻璃体视网膜淋巴瘤有提示意义,若二者比值大于1,提示淋巴瘤可能[22],有研究指出,近年来该比值对于眼内弥漫性大 B 淋巴瘤的预测准确性达(95±5)%[23]。
当然,本研究也有其局限性:(1)纳入样本量较少;(2)存在明显的选择偏倚,眼内液取样属于有创操作,仅针对临床诊断不明确和感染性眼病可能性大的患者进行检测;(3)取材时间未统一,取样时间可能处于疾病的急性期或慢性期、治疗前或治疗中等。
眼内液检测在临床工作中具有一定价值,尤其在临床表现不典型或不同疾病临床改变相似的病例中;对临床经验不足的青年医师,眼内液也具有一定的参考意义。但眼内液取材作为一种有创操作,应规范其临床应用,减少患者经济负担和眼部创伤。
