龙葵生长对佳乐麝香与镉污染土壤酶活性的影响
2022-11-05韩晓墨李兴国
律 泽,苏 澳,张 驰,韩晓墨,李兴国
(沈阳建筑大学市政与环境工程学院,辽宁 沈阳 110168)
土壤酶是一类生物活性物质,参与土壤中养分元素循环、有机质矿化、污染物降解等生物化学过程,在土壤生态系统中发挥关键的作用[1]。土壤酶对环境变化敏感,能反映土壤环境的微小变化,其活性常被作为土壤生态系统功能的重要指标之一[2]。土壤酶活性特别易受到污染物的影响,研究污染物与土壤酶之间的关系对于了解土壤在生态系统的物质循环过程以及土壤生态系统退化机理有重要作用。
佳乐麝香(HHCB)是备受关注的PPCPs污染物之一,重金属镉(Cd)是土壤中常见污染物。化妆品厂污水处理系统的污泥中,HHCB污染水平高达703.68 mg/kg[3],而土壤中Cd污染水平达到65.31 mg/kg[4]。HHCB和Cd污染都会影响土壤酶的活性[5]。土壤中HHCB和Cd主要来自于污水灌溉以及污泥利用,它们共存于土壤中形成复合污染[6]。相对于单一污染,复合污染的毒性效应更加复杂。目前,HHCB-Cd复合污染的研究大多集中于对水生生物和陆生生物的影响[7],对于土壤酶影响的研究不多,特别是在植物修复条件下的研究更为少见。
龙葵是Cd超积累植物,可用于修复Cd污染的土壤[8],同时还能促进土壤中的多氯联苯降解[9],具有潜在的修复有机污染和重金属复合污染土壤的能力。因此笔者以HHCB和Cd为研究对象,通过盆栽试验,研究龙葵生长对HHCB与Cd污染土壤酶活性的影响,利用龙葵进行有机污染物和重金属复合污染土壤的植物修复。
1 试 验
1.1 供试土壤
供试土壤采集于辽宁省沈阳市某郊区农田0~20 cm土壤表层。土壤pH值5.82、含水量15.62%、有机质3.48%、速效氮48 mg/kg、速效钾17 mg/kg、速效磷18.5 mg/kg。土壤中HHCB和Cd背景值在检测限下。
1.2 供试药品
HHCB样品购于英国Promochem公司,纯度为75%,其分子式为C18H26O。氯化镉样品为分析纯,国药集团化学试剂有限公司生产。龙葵种子来源于沈阳农业大学。
1.3 试验方法
采用盆栽进行试验,盆中土壤质量为2 kg。试验共设12个处理组,具体试验设计方案如表1所示。为了使研究有实际应用价值,本研究中HHCB根据文献[3]监测得到的最高污染水平,污染物与土壤质量比为700 mg/kg设为高污染,再以其10%即70 mg/kg设为低污染;土壤中重金属与土壤的质量比为0 mg/kg和10 mg/kg[5],每个处理组3个平行,各处理组污染物在土壤中的含量如表1所示。
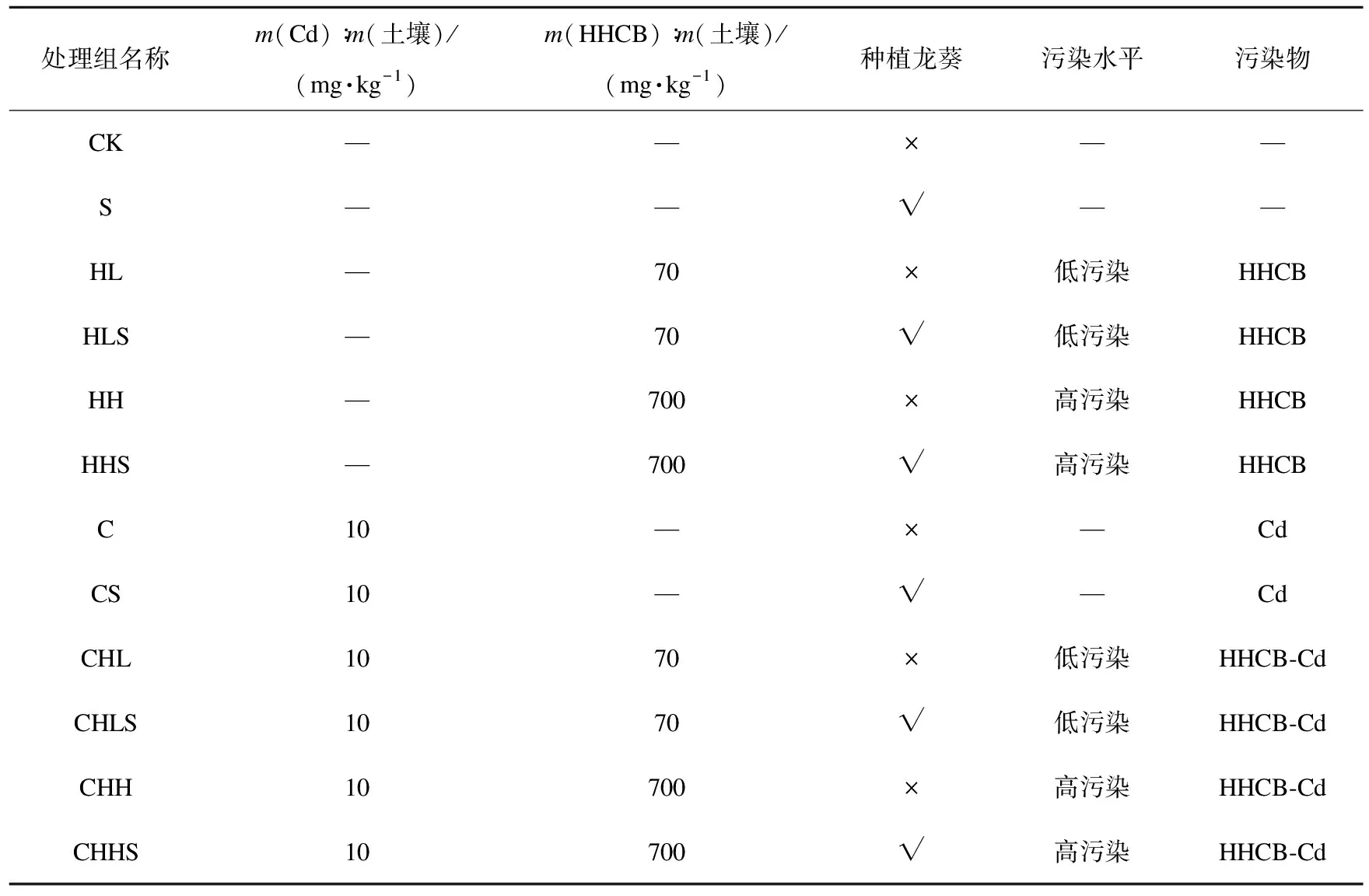
表1 不同处理组中含重金属镉与佳乐麝香的污染水平Table 1 Pollution levels of Cd and HHCB in different treatments
龙葵栽培方法:每盆种10粒种子,株高5 cm左右间苗,每盆保留5株。试验期间利用补水称重法使土壤水分保持在60%,每天定时随机改变盆的位置。试验进行60 d,分别于1、20、40和60 d收集根部附近土壤,测定其脲酶、蔗糖酶和酸性磷酸酶的活性。分析60 d土壤的HHCB和Cd残留量、理化性质(有机质、pH值)、微生物和龙葵生物量等。
1.4 测定方法
土壤脲酶、蔗糖酶和酸性磷酸酶活性测定分别采用苯酚钠法、 3、5-二硝基水杨酸法和对硝基酚比色法。
微生物数量采用荧光qPCR法。采用荧光定量qPCR测定细菌16S rRNA、真菌18S rRNA和放线菌特异基因的拷贝数。
土壤中HHCB和Cd残留量参考M.Mackova等[9]研究的方法。土壤有机质和pH值分别采用重铬酸钾容量法(外加热法)和电位法测定。
1.5 数据分析
试验数据采用DPS7.5进行处理,数据以平均值±标准差表示,利用单因素方差分析中Tukey多重比较检验不同处理组间的结果差异显著性,处理组间差异显著性用不同小写字母表示,显著性水平设为p<0.05,极显著水平为p<0.01,p值利用DPS7.5软件包计算。菌种的拷贝数经对数转换后再进行分析。土壤酶-影响因子分析采用冗余分析(RDA),在Canoco for windows 4.5 软件包上进行。
2 结果与分析
2.1 HHCB与Cd污染对龙葵生长的影响
从表2可见,60 d后HHCB与Cd单一、复合污染处理组中龙葵的4个生长指标均高于无污染处理组,根据方差分析差异均不显著(p>0.05),说明HHCB与Cd单一、复合污染均未对龙葵的生长产生明显影响。
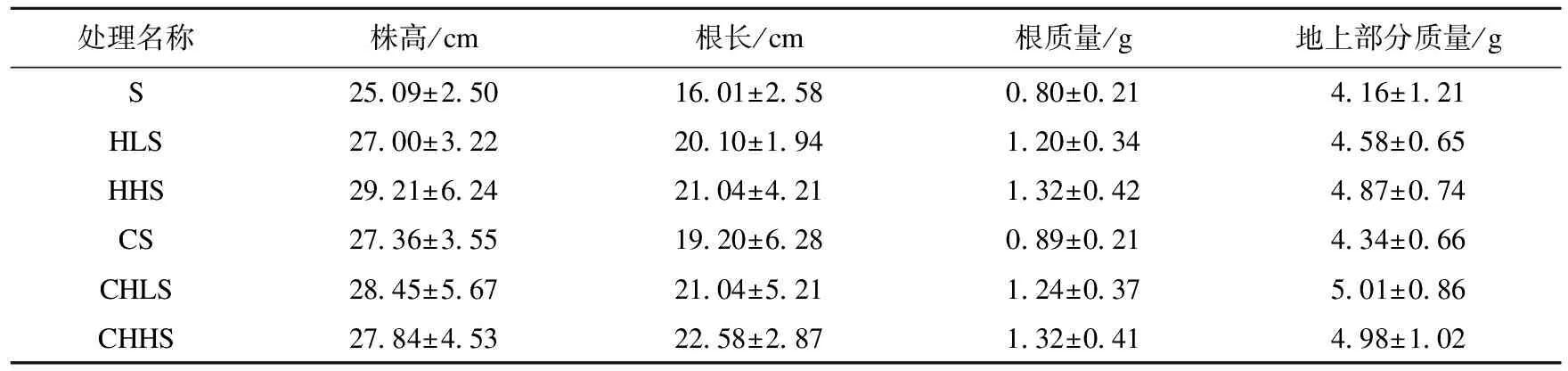
表2 不同处理组中龙葵的生长状况Table 2 The growth of S.nigrum in different treatments
2.2 土壤酶活性变化
无污染处理组CK、S和低HHCB污染水平的单一污染处理组HL、HLS中3种土壤酶在前20 d均呈现快速上升,而后维持在较稳定水平。造成这种现象是因为土壤酶主要来源于植物和微生物,在试验初始,植物和微生物暴露于污染物,诱发植物和微生物分泌酶以适应污染胁迫[10],在植物和微生物适应污染胁迫之后也趋于稳定,因而其活性维持在一个稳定水平。由图1可知,在高HHCB污染水平的单一污染HH、HHS以及HHCB-Cd复合污染CHL、CHH、CHLS、CHHS处理组中,土壤酶活性均表现持续缓慢升高。这是因为随着时间推移,HHCB会发生降解,其毒性变小,对土壤酶抑制作用降低,从而表现出土壤酶活性增加趋势。60 d后脲酶和酸性磷酸酶在低HHCB污染水平的处理组HL、HLS中显著高于对应的对照处理组CK、S,而在高HHCB污染水平处理组HH、HHS恰好相反,低、高HHCB污染水平分别促进和抑制脲酶和酸性磷酸酶。这是由于低污染水平的有机污染物可以成为微生物可利用的碳源,促进微生物生长,从而提高了土壤酶活性[11]。对于蔗糖酶,高、低HHCB污染水平处理组均低于对照处理组,说明HHCB对蔗糖酶表现为抑制作用。从图1可以看出,在各个时间点,HHCB单一污染的土壤酶活性均显著高于相对应HHCB-Cd复合污染的酶活性,表明HHCB-Cd复合污染比HHCB单一污染更加抑制土壤酶的活性。造成这种原因是因为有机物污染物可以通过官能团与重金属发生络合反应,互相影响并改变其存在形态,从而使有机污染物-重金属复合污染时能对土壤酶活性产生协同促进/抑制作用[12]。脲酶活性在种植龙葵处理中是相应未种植龙葵处理的2.29~20倍,蔗糖酶和酸性磷酸酶的数值分别是11.67~60.06倍、20.07~37.29倍,这些说明龙葵显著提高了土壤酶活性。
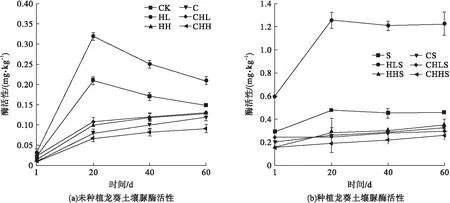
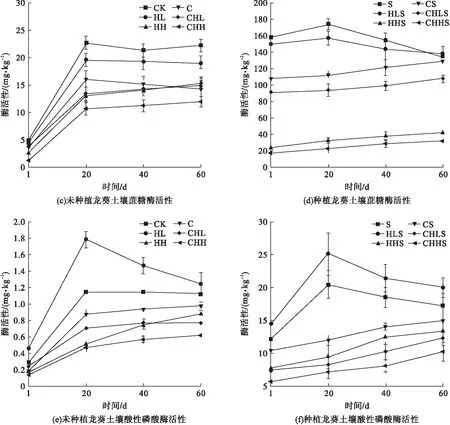
图1 不同处理组土壤酶活性的变化Fig.1 The changes of soil enzyme activities in the different treatments
2.3 土壤微生物变化
在污染条件下,与CK组相比,除了CHL处理组,细菌的增幅在0.77%~14.32%;除了HH和C处理组,真菌的增幅在4.61%~30.52%,放线菌呈现降低趋势,减幅为0.70%~24.13%(见图2)。可见,HHCB单一污染和HHCB-Cd复合污染均促进细菌和真菌生长,但抑制放线菌生长。总体上种植龙葵处理组中的微生物数量均显著高于相应的无种植处理组,表明植物能促进微生物生长繁殖。然而,复合污染在有无龙葵处理组中呈现不同变化特征,在未种龙葵处理组中,复合污染处理组中微生物数量均高于相应HHCB单一污染的处理组,CHL处理组中的细菌除外。在种植龙葵处理组中,两者关系相反。可见,植物对HHCB-Cd复合污染土壤中的微生物产生了复杂影响。
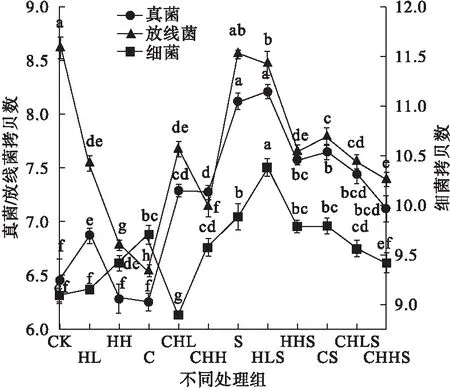
图2 不同处理组中土壤微生物数量Fig.2 The soil microbial quantity in different treatments
2.4 污染物残留和土壤理化性的变化
60 d后土壤污染物残留及理化性变化如表3所示。Cd残留量在未种植龙葵处理中几乎没有变化,Cd是重金属,不能为微生物所利用[11]。在种龙葵处理组中,由于龙葵吸收Cd,其土壤Cd残留量均显著低于无龙葵处理组,p<0.01。
对于HHCB残留量,在低HHCB污染水平时,HHCB单一污染和HHCB-Cd复合污染中的HHCB残留量差异显著,p<0.05;但在高HHCB污染水平处理组时,两者差异不显著,p>0.05 ;表明HHCB残留量与其初始污染水平相关。对比种植与未种植龙葵的处理组发现,HHCB残留量均呈现种植龙葵处理组显著低于未种植的处理组,p<0.01,说明植物有助于促进土壤中HHCB的去除。
从表3可知,种植龙葵处理组中土壤有机质质量比高于未种植处理组。对比HHCB单一污染和HHCB-Cd复合污染发现,在未种植龙葵条件下,复合污染处理组中土壤有机质高于单一污染,但不显著,p>0.05。在种植物龙葵条件下,低HHCB污染水平的HHCB-Cd复合污染处理组中土壤有机质显著高于单一HHCB污染,p<0.01;高HHCB污染水平的HHCB-Cd复合污染稍高于单一HHCB污染。表明龙葵种植影响土壤有机质变化。
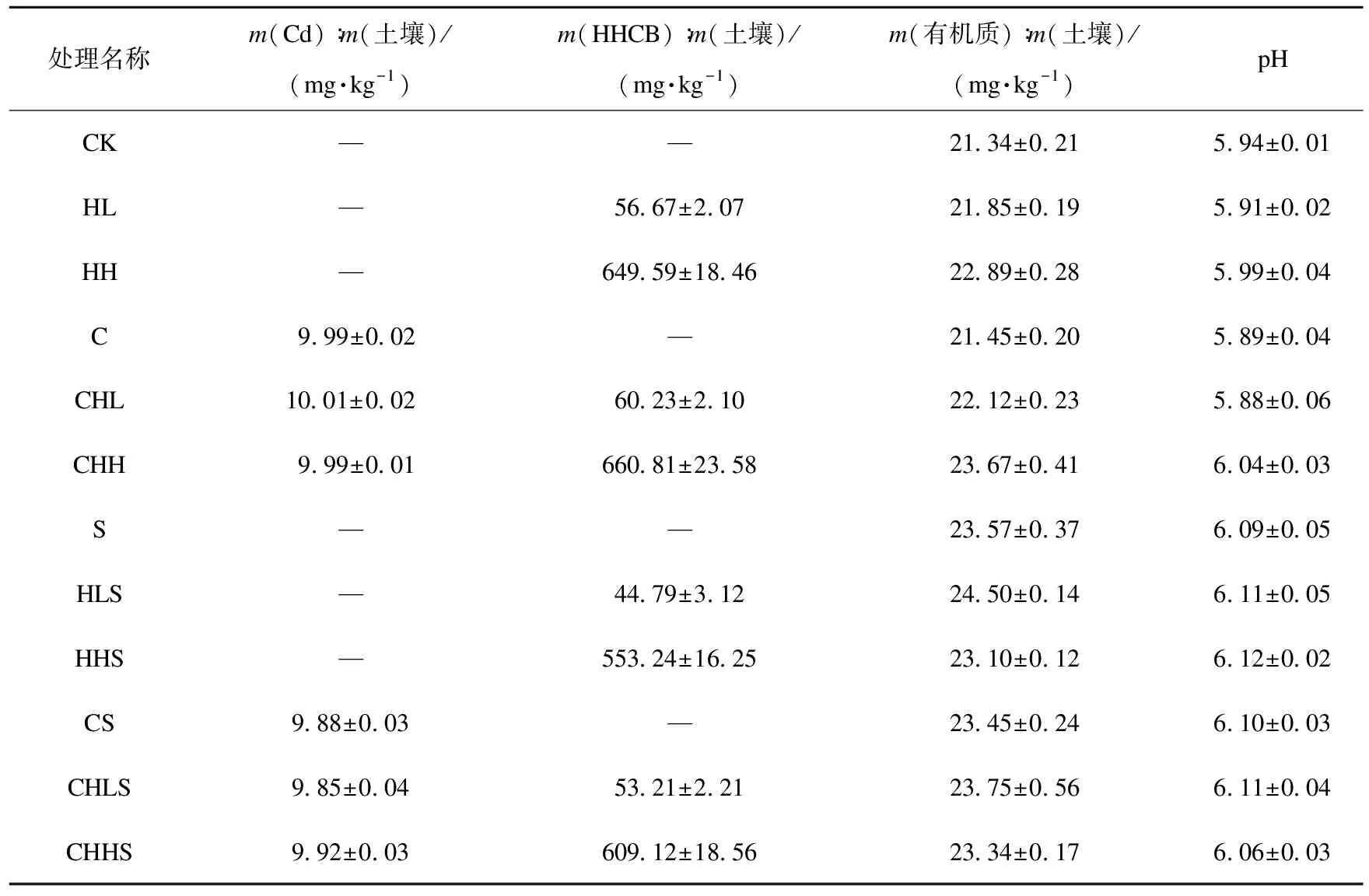
表3 土壤污染物残留量、有机质质量比和pH值Table 3 The pollutant residual quantity,organic matter mass ratio and pH in soils
种植龙葵处理组中的土壤pH值均显著高于未种植处理组,说明龙葵有利于提高土壤pH。在高、低HHCB污染水平的单一污染处理组之间、HHCB单一和HHCB-Cd复合污染处理组之间,两两之间的土壤pH值差异均不显著,p>0.05。表明HHCB污染水平及其与Cd复合污染对土壤pH影响不显著。
2.5 各种因素对土壤酶的影响分析
对土壤酶活性与影响因素,包括微生物、污染物残留、土壤理化性质等,进行冗余分析(RDA),结果见表4,土壤酶与影响因子RDA排序如图3所示。

表4 土壤酶与影响因子的RDA分析Table 4 Redundancy analysis results for soil enzyme and impact factors
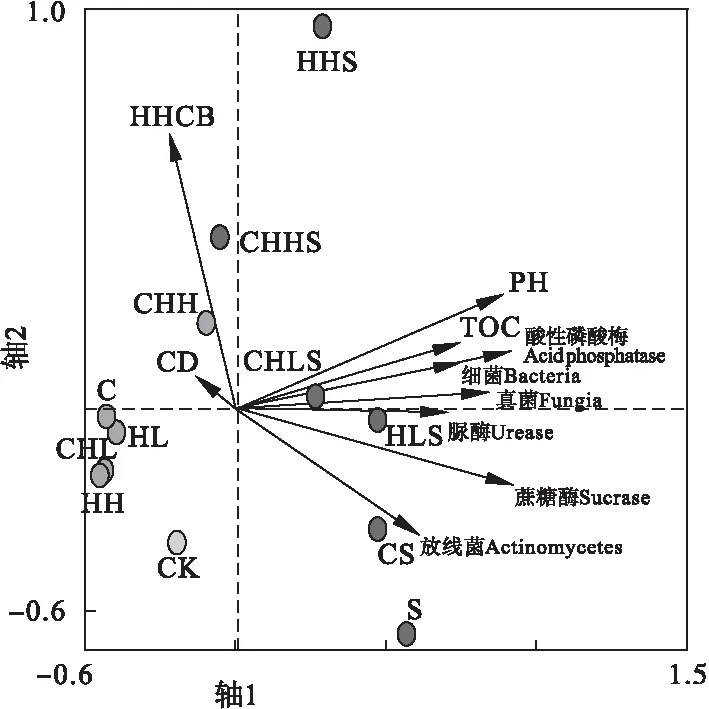
图3 土壤酶与影响因子RDA排序图Fig.3 Redundancy analysis ordination diagram of the soil enzyme and impact factors
由表4可知,7个影响因子共解释了87.9%的土壤酶变化信息,其中前两轴累计解释了87.1%土壤酶变化信息和99.2%的土壤酶-影响因子关系信息。总变化率为100.0%,总典特征值为0.879。由图3可知,在RDA排序图上,因子线头越长,说明其影响程度越高[13]。在所有因子中,土壤pH值和HHCB残留量的线头最长,说明两者是影响土壤酶活性变化的关键因子。土壤pH值下,F=20.67,p=0.006;HHCB残留量下,F=4.79,p=0.03。两者对土壤酶变化影响达到显著水平,p<0.05,而其他因子未达到显著水平,p>0.05,进一步证明了土壤pH值和HHCB残留量是影响土壤酶活性变化的关键因子。
土壤pH与土壤酶活性之间密切相关[14]。对土壤pH变化影响土壤酶活性有两种解释:一是改变酶空间构象[15];二是改变土壤微生物类群[16]。3种土壤酶活性大小均与土壤pH值呈显著正相关,表明较高土壤pH值有助于提高土壤酶活性。从图3可以看出,微生物数量与土壤酶也呈显著正相关,可以推断本研究中土壤酶活性变化主要是通过土壤pH变化改变微生物实现。方差分析表明,HHCB单一污染和HHCB-Cd复合污染之间、低HHCB污染水平和高HHCB污染水平之间的土壤pH值差异均不显著,p>0.05。复合污染和污染物污染水平均不是影响土壤酶活性变化的主要原因。然而,种植龙葵和未种植龙葵处理组之间的土壤pH值差异显著,p<0.05。说明种植龙葵是土壤pH值差异的根本原因。由此可见,通过龙葵影响土壤pH值,进而改变土壤酶的活性。
土壤酶对有机污染物高度敏感性。土壤受污染后,土壤酶活性会发生很大的变化[17]。在RDA排序图中,箭头连线和排序轴的夹角代表影响因子与排序轴的相关性,夹角越小,相关性越高;反之越低[13]。图3中第2轴代表HHCB污染水平,3种土壤酶的线头与第2轴夹角大小依次为脲酶、酸性磷酸酶、蔗糖酶。说明受HHCB影响最大的蔗糖酶,接着是酸性磷酸酶,最小的是脲酶。从图3中可以看出,种植龙葵处理组中HHCB污染水平相对较低,说明龙葵是改变土壤中HHCB污染水平的关键因素。一方面龙葵通过直接吸收HHCB,降低土壤中HHCB污染水平;另一方面,龙葵促进微生物生长繁殖,从而提高HHCB降解。因此,龙葵通过改变土壤中的HHCB污染水平而实现对土壤酶活性的调控。
3 结 论
(1)不同HHCB污染水平对不同土壤酶影响不同,对于脲酶和酸性磷酸酶,低HHCB污染水平起促进作用,而高污染水平则起抑制作用;对于蔗糖酶,高、低HHCB污染水平均表现为抑制作用。
(2)HHCB-Cd复合污染比HHCB单一污染更加抑制土壤酶活性。
(3)种植龙葵显著提高了土壤酶活性。
(4)土壤pH值和HHCB残留量是影响土壤酶活性变化的关键因子,它们作用发挥是通过龙葵调控实现。
