成人高级别胶质瘤患者的预后影响因素分析
2022-11-05王伊旻徐晓婷
朱 焱 王伊旻 徐晓婷
胶质瘤是中枢神经系统的肿瘤,根据肿瘤的恶性程度分为WHO Ⅰ~Ⅳ级,其中Ⅲ、Ⅳ级为高级别胶质瘤(high-grade gliomas, HGG),是颅内最常见的原发性恶性肿瘤,占中枢神经系统原发性恶性肿瘤的50%以上[1]。 成人高级别胶质瘤恶性程度高,具有快速侵袭性生长,极易复发的特点,是引起患者生存期短的重要原因。 其中,胶质母细胞瘤患者中位生存时间约为12 个月,5年生存率仅5%左右[2,3]。 目前,成人高级别胶质瘤的标准治疗为术后放疗同步替莫唑胺(temozolomide, TMZ)化疗以及后续TMZ 辅助化疗(即“STUPP 方案”)[4]。 然而,尽管采用标准方案治疗,多数高级别恶性胶质瘤患者常在短期内复发,而且患者的预后差。 由于高级别胶质瘤的生物学行为和预后不同,确定影响预后的因素将有助于提高其整体治疗水平。 本研究对2017年1月~2019年12月苏州大学附属第一医院收治的75 例成人高级别胶质瘤患者的临床资料进行回顾性分析,探讨影响高级别胶质瘤患者预后的相关因素。
资料与方法
1.一般资料:回顾性分析苏州大学附属第一医院2017年1月~2019年12月收治的75 例初发高级别胶质瘤患者的临床和分子病理资料。 其中男性43 例(57.3%),女性32 例(42.7%);WHO Ⅲ级28 例(37.3%),WHOⅣ级47 例(62.7%);年龄<60 岁54例(72.0%),≥60 岁21 例(28.0%);术前KPS 评分≤70 分36 例(48.0%),≥80 分39 例(52.0%);病灶数量单个60 例(80.0%),多个15 例(20.0%);病灶最大径≤3.5cm 者28 例(37.3%), >3.5cm 者47 例(62.7%); SVZ 受侵33 例(44.0%),未受侵42例(56.0%);手术全切54 例(72.0%),次全切除21例(28.0%);手术穿通侧脑室19 例(25.3%),未穿通56 例(74.7%);IDH1 突变型19 例(25.3%),野生型55 例(73.3%),不明1 例(1.3%);ki-67 表达量≤10% 者 13 例(17.3%), >10% 者 62 例(82.7%);MGMT 甲基化14 例(18.7%),未甲基化54 例(72.0%),不明7 例(9.3%)。
纳入标准:①年龄≥18 岁;②术后病理学确诊为高级别脑胶质瘤(WHOⅢ~Ⅳ级);③术后行放疗同步联合TMZ 化疗;④有完整的生存期数据;⑤无其他颅脑损伤及颅脑手术史。 排除标准: ①复发性脑高级别胶质瘤; ②围术期术后死于并发症; ③合并心脏、肺等重要器官病变; ④精神障碍或认知功能障碍,不能配合完成研究; ⑤既往有其他肿瘤病史;⑥失访、生存情况不明或临床资料不完整。 本研究通过苏州大学附属第一医院医学伦理学委员会批准[伦理审批号:(2021)伦研批第328 号]。
2.手术方式:75 例患者均在苏州大学附属第一医院行肿瘤切除手术,手术原则是最大范围的安全切除肿瘤。 术前行影像学评估,如头颅增强磁共振扫描(magnetic resonance imaging, MRI)、磁共振灌注成像(perfusion imaging, PWI)、磁共振波谱分析(magnetic resonance spectroscopy, MRS) 等检查,确定病变的恶性程度、侵犯范围、周边血供及水肿程度等。 依据术后头颅MRI 检查评估肿瘤切除的程度,将手术切除程度分为全切除(>95%)和部分切除(≤95%)。
3.放疗方式:所有患者均行术后放疗。 放疗计划:将患者的头颅MRI 与定位CT 在治疗计划系统里融合以完成图像重建。 根据患者术前与术后的影像学资料,在治疗计划中的定位CT 图像上确定靶区勾画范围,包括肿瘤靶区(gross tumor volume, GTV)、临床靶区(clinical target volume, CTV)和危及器官(脊髓、脑干、视交叉、视神经、眼球、晶状体等)。 靶区勾画:①肿瘤靶区(GTV),为术后残留或瘤腔;②临床靶区(CTV),为GTV 基础上外扩1 ~2cm 后的修正区域;③计划靶区(planning target volume,PTV),为CTV外扩3 ~5mm 构成。 剂量及分割:治疗总剂量54 ~60Gy,分27 ~30 次照射,单次分割剂量为1.8 ~2.0Gy,每周5 次照射,总共5 ~6 周。
4.化疗方案:患者均采用术后放疗同步TMZ 化疗,同步放化疗后加用TMZ 辅助化疗。 放疗期间,患者同步口服TMZ 剂量为75mg/(m2·d)。 大部分患者同步放化疗4 周后,患者再连续口服TMZ[150 ~200mg/(m2·d)]5 天,每28 天为1 个周期。 第1 个疗程剂量为150mg/(m2·d),后续疗程剂量调整为200mg/(m2·d)。
5.随访情况:每3 ~6 个月对患者进行1 次随访,主要随访方式为电话随访和门诊随访。 随访内容包括患者术后治疗的方案、术后头颅MRI、临床症状和存活情况。 随访终点事件是患者因肿瘤死亡。 总生存期(overall survival, OS)定义为患者手术当日至最后一次随访的时间间隔或至患者因脑胶质瘤及其并发症死亡的间隔时间;无进展生存期(progression free survival, PFS)为患者手术当日至患者首次经影像学证实出现颅内病灶进展/肿瘤复发或二次手术病理学证实复发的间隔时间。
6.统计学方法:应用SPSS 25.0 统计学软件对数据进行统计分析。 通过单因素和多因素COX回归模型分析患者生存预后的影响因素;采用Kaplan-Meier生存曲线分析患者的生存状态,不同组别患者之间生存期差异用Log-rank法检验,以P<0.05 为差异有统计学意义。
结 果
1.随访结果:本研究随访截至2021年9月,患者的中位随访时间为34.0 个月。 结果表明,接受标准治疗的高级别胶质瘤患者中位PFS 和OS 分别为13.0(95% CI:10.7 ~15.3)个月和30.0(95% CI:21.8 ~38.2)个月。 全组无进展生存曲线和总生存曲线,详见图1 和图2。

图1 全组无进展生存曲线
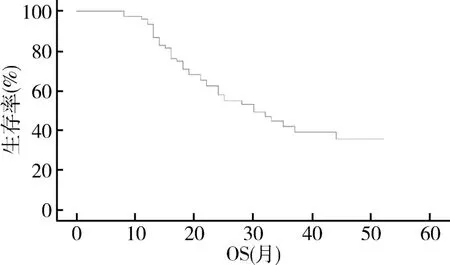
图2 全组总生存曲线
2.COX回归单因素分析:对可能影响患者预后的临床和分子病理特征等因素进行COX回归分析(表1、表2)。 结果显示,患者术前KPS 评分、病理分级、病灶数目、SVZ 受侵、手术切除程度、手术穿通侧脑室、IDH-1 突变情况和ki-67 表达量对于PFS 的影响有统计学意义;与OS 有显著相关性的因素有术前KPS 评分、SVZ 受侵、手术切除程度、手术穿通侧脑室、IDH-1 突变情况和ki-67 的表达量。

表1 75 例高级别脑胶质瘤患者无进展生存期的影响因素分析结果
3.COX回归多因素分析:选取单因素COX回归分析中有意义的因素,纳入多因素COX回归分析(表1、表2)。 结果显示,病灶数目(HR = 2.579, 95%CI: 1.345 ~4.948,P=0.004)、手术切除程度(HR =1.928, 95% CI: 1.077 ~3.452,P=0.027)、IDH-1突变(HR = 0.357, 95% CI: 0.170 ~0.747,P=0.006)和ki-67 表达量(HR = 2.907, 95% CI:1.059 ~7.976,P=0.038)为影响PFS 的独立预后因素;手术穿通侧脑室(HR =2.252, 95% CI: 1.192 ~4.255,P=0.012)、IDH-1 突变(HR =0.237,95% CI:0.082 ~0.687,P=0.008)和ki-67 表达量(HR =6.796, 95% CI: 1.619 ~28.528,P=0.009)为影响OS 的独立预后因素。

表2 75 例高级别脑胶质瘤患者总生存期的影响因素分析结果
4.手术因素对标准治疗高级别脑胶质瘤患者的生存率影响分析:对于标准治疗的高级别胶质瘤,肿瘤全切能显著延长患者的PFS 和OS(P均<0.05),而手术穿通侧脑室会显著缩短患者的PFS 和OS(P均<0.05)。
讨 论
胶质瘤起源于神经胶质细胞,是颅内最常见的原发肿瘤,高级别胶质瘤是组织病理学中恶性程度高、极易复发的类别,通常预后较差。 标准治疗方案,即TMZ 同步放化疗联合TMZ 辅助化疗的“STUPP 方案”的出现显著改善了患者的预后。 本研究结果显示,高级别胶质瘤患者标准治疗后中位PFS 和OS 分别达13.0(95% CI:10.7 ~15.3)个月和30.0(95%CI:21.8 ~38.2)个月,其疗效优于既往文献报道,原因可能是本研究中入组患者的辅助TMZ 化疗周期更长。 在一项Ⅲ期临床试验中,411 例新诊断的高级别胶质瘤患者经过标准治疗后中位PFS 和中位OS 分别为5.5 (95% CI:4.7 ~6.1) 个月和16.6(95%CI:14.9 ~18.0)个月[5]。 一项国内回顾性研究分析了标准治疗中长周期辅助TMZ 化疗对高级别胶质瘤患者生存的影响,结果显示,完成6 个月辅助TMZ 化疗和完成>6 个月辅助TMZ 化疗的患者PFS(15.0个月vs 20.1 个月)与OS(19.4 个月vs 25.6 个月),与本研究结果相似[6]。 杜霄等[7]研究也表明,患者的生存时间与辅助TMZ 化疗的周期相关。
脑胶质瘤的病理学类型和病理学分级是影响患者生存时间的重要因素。 本研究中,病理学分级仅作为单因素分析PFS 的影响因素,说明病理学分级对高级别胶质瘤患者标准治疗后的预后具有一定的预测意义,也提示单纯病理学分级无法决定高级别胶质瘤的预后。 随着胶质瘤分子病理学研究的不断进展,2016年WHO 发布的中枢神经系统肿瘤第4 版修订版分类标准首次将胶质瘤组织学分型和分子分型相结合[8]。 异柠檬酸脱氢酶-1(isocitrate dehydrogenase, IDH-1)是其中公认的关键分子,与胶质瘤的代谢增殖相关。 本研究中IDH-1 突变是影响高级别胶质瘤标准治疗后生存期的独立因素,与既往的研究结论一致[9]。
ki-67 是另一种与胶质瘤增殖相关的分子标志物,既往研究发现,ki-67 低表达与高级别胶质瘤患者OS 延长相关[10~12]。 本研究亦提示,ki-67 低表达是高级别胶质瘤标准治疗患者PFS 和OS 的独立良好预后因素。 6-氧-甲基鸟嘌呤-DNA 甲基化转移酶(O-6methylguanine-DNA methyltransferase,MGMT)是参与胶质瘤烷化类化疗药物(如替莫唑胺)耐药的关键基因,被证实与胶质瘤的预后相关[13]。本研究COX单因素分析结果显示,MGMT 甲基化状态与高级别胶质瘤标准治疗预后无显著相关性,这可能是由于较长周期的TMZ 化疗抵消了MGMT 非甲基化带来的生存受损。
外科手术是高级别胶质瘤标准治疗的基石,其原则是最大范围安全切除肿瘤。 既往国内外大量研究表明,手术切除程度与高级别胶质瘤患者的生存时间密切相关[14~17]。 本研究中所有患者均接受手术治疗,手术全切患者中位PFS 和OS 分别为16.0(95%CI:9.0 ~23.0)个月和33.0(95% CI:20.6 ~45.4)个月,部分切除患者中位PFS 和OS 分别为9.0(95%CI:8.2 ~9.8)个月和21.0(95% CI:12.3 ~29.7)个月。 单因素COX回归分析显示,手术切除程度与PFS 和OS 显著相关(P均<0.05),多因素COX回归分析显示,手术全切仅与较好的PFS 显著相关(P=0.027),考虑可能与患者随访时间较短有关。
有研究指出,胶质瘤手术穿通侧脑室增加软脑膜播散风险,与术后患者不良预后显著相关[18~21]。 原因可能是术中残留的肿瘤细胞脱落由打通的侧脑室进入脑脊液,随脑脊液循环播散。 本研究中单因素分析结果显示,手术穿通侧脑室影响标准治疗高级别胶质瘤患者的PFS 和OS;而多因素分析显示,手术穿通侧脑室是OS 的独立危险因素。 这可能是因为术后患者接受了积极的同步放化疗和TMZ 辅助化疗,降低了肿瘤细胞扩散的风险。
本研究也存在一些不足:①样本量较少;②本研究为回顾性研究;③随访时间有待于延长;④仅极少数患者进行1p/19q 杂合性缺失的检测,故不能分析1p/19q 与标准治疗高级别胶质瘤预后的关系;⑤肿瘤的复发主要依据影像学判断,缺少病理学检查。
综上所述,手术穿通脑室、IDH-1 野生型和ki-67 高表达的高级别胶质瘤患者预后较差。 行肿瘤全切后联合放化疗可以显著提高胶质瘤的疗效,但手术穿通侧脑室可能会缩短患者的生存期,这需要开展多中心临床研究来予以进一步验证。
