酮体对小鼠脓毒症急性肾损伤的保护作用及其机制的研究
2022-11-05张家丽佐拉木买买提
张家丽 佐拉木·买买提 于 虎
急性肾损伤(acute kidney injury,AKI)是由多种因素引起的以肾功能快速下降为特征的临床综合征[1,2]。 AKI 是败血症和内毒素血症的常见并发症,超过50%的败血症患者发展为AKI[3]。 与其他原因引起的AKI 比较,脓毒症诱发AKI 的病理生理机制十分复杂,死亡风险更高,住院时间更长,预后更差,目前仍缺乏有效的防治方法[3,4]。 越来越多的证据表明,脓毒症过程中活性氧(reactive oxygen species,ROS)爆发诱发的氧化应激增强会导致肾小球或肾小管上皮细胞细胞功能紊乱、脱落或凋亡,甚至大面积的死亡[5,6]。 许多临床研究也支持氧化应激损伤在脓毒症诱导的肾功能进展性衰竭中起了关键作用[7,8]。 因此降低脓毒症肾脏的氧化应激可能是脓毒症相关AKI 治疗的重要靶点。
酮体是人体生命活动重要的替代能源,近年来被发现可以作为信号转导介质、蛋白质翻译后修饰的驱动因子发挥广泛的生物学效应[9]。 酮体包括β-羟基丁酸、乙酰乙酸和丙酮,其中β-羟基丁酸占循环酮体水平的80%,也被证实是主要发挥功能的成分[9]。 有研究证实,增加终末期心力衰竭患者酮体利用可以明显改善心功能[10]。 也有研究发现,对老年小鼠进行生酮喂养可以减轻神经细胞的氧化损伤,最终表现出记忆和认识能力的提升[11]。 临床研究也证实,给运动员赛前服用含酮饮料可以显著增强运动表现[12]。 但鲜有研究观察酮体对脓毒症AKI 的作用。 本研究使用连续3 天酮脂灌胃增加体内酮体浓度,通过腹腔注射脂多糖(lipopolysaccharide,LPS)诱导小鼠脓毒症肾损伤,观察酮体对于LPS 诱导的AKI是否具有保护作用并研究其可能的机制。
材料与方法
1.主要试剂与仪器:LPS 购自美国Sigma-Aldrich 公司;BCA 蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;酶标仪购自美国BioTek 公司;倒置显微镜购自日本奥林巴斯公司;血酮试纸及血酮仪购自美国罗氏公司;尿肾损伤分子-1(urinary kidney injury molecule-1,KIM-1)ELISA 检测试剂盒(MKM100)购自美国R&D System 公司;FOXO3A抗体(66428-1)、SOD2 抗体(20809-1)购自中国Proteintech 公司;酮脂购自美国MCE 公司,溶于水制备成100mg/ml 溶液4℃保存;超氧化物歧化酶(superoxide dismutase, SOD)、 过氧化氢酶(catalase,CAT)、还原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)、尿微量白蛋白(urine microalbumin,UALb)检测试剂盒均购自南京建成生物有限公司。
2.动物分组和模型建立:本研究符合《美国NIH实验室动物使用指南》 的规定,18 只SPF 级雄性C57BL/6J 小鼠,体质量为18.0 ~22.0g(约7 ~8 周龄),购自北京维通利华动物实验公司。 将小鼠保持在无病原体的条件下,进行22℃、12h/12h 光/暗循环,自由获取食物和水,适应性喂养1 周后将小鼠随机分为对照组、模型组和实验组,每组6 只。 具体处理如下,实验组:对小鼠连续3 天,每天晨9:00 时灌胃酮脂(1mg/g);模型组:连续3 天灌胃等量0.9%氯化钠溶液。 实验组和模型组第3 天灌胃结束后30min 腹腔注射LPS(10mg/kg)以诱导脓毒症AKI。对照组:连续3 天灌胃等量0.9% 氯化钠溶液,第3天腹腔注射等量0.9% 氯化钠溶液。 LPS 处理后24h,取小鼠膀胱尿、血和两侧肾组织,血液样本4000r/min 离心10min 取上清,-80℃留存备用。 左肾组织用4%多聚甲醛固定,右肾组织-80℃留存备用。
3.肾功能指标(SCr、BUN、UAIB/Cr 和KIM-1)检测:参照试剂盒说明测定各组小鼠血中SCr 和BUN水平,同样参照说明检测尿液样本中KIM-1 和UALb/Cr 水平。
4.肾脏组织病理学检测:取各组小鼠左肾,多聚甲醛固定和石蜡包埋后切3μm 厚的切片,HE 染色观察肾组织形态学变化,倒置显微镜下采用细胞水肿、细胞凋亡、细胞坏死、炎性细胞浸润和出血对与肾组织相对应的5 个区域的损伤程度进行盲法评分。AKI 评分标准分5 个等级:0 分,正常肾组织;1 分,肾小管受损范围<25%;2 分,肾小管受损范围≥25%且<50%;3 分,肾小管受损范围≥50% 且<75%;4分,肾小管受损范围≥75%。
5.氧化应激水平检测:各组小鼠分别取20mg 肾脏,按照试剂盒说明分别进行MDA 含量,SOD、GSH和CAT 活性测定。 BCA 法定量校正蛋白后得到MDA 含量(nmol/mg)、SOD 活性(U/g)、GSH 活性(U/g)和CAT 活性(U/g)。
6.从肾组织中提取总蛋白,用BCA 蛋白浓度试剂盒进行蛋白定量后将蛋白变性,将含有30μg 蛋白质的样品经SDS-PAGE 分离后转移到PVDF 膜上。室温下用5%脱脂牛奶封闭1h 后,分别用FoxO3a 一抗(1∶1000)和SOD2(1∶10000)一抗在4℃下孵育过夜,次日,TBST 洗膜3 次,加入荧光兔二抗(1∶10000)溶液室温摇床孵育1h,TBST 洗膜3 次后进行显影。用Image J 测得FoxO3a 和SOD2 灰度值与内参蛋白GAPDH 灰度值之比作为相对表达值。
7.统计学方法:应用GraphPad Prism 8.0 统计学软件对数据进行统计分析。 计量资料以均数± 标准差(±s)表示,使用非配对双尾Student t检验对两组之间计量资料进行分析,使用重复测量单因素方差分析结合Sidak检验对成组数据进行分析,以P<0.05为差异有统计学意义。
结 果
1.酮体对LPS 诱导的脓毒症小鼠肾功能和组织结构的影响:与对照组比较,模型组小鼠BUN、SCr、UALB/Cr 和KIM-1 水平均显著升高(P<0.001,图1 中B ~E)。 实验组血β-羟基丁酸浓度明显高于对照组和模型组(P<0.001,图1A)。 与模型组比较,实验组BUN 和SCr 水平及UALB/Cr 和KIM-1 水平均有所降低(P<0.001,图1 中B ~E)。 同样,各组小鼠肾脏组织学改变与肾功能结果一致,模型组小鼠肾组织损伤明显,表现为明显的肾小球坏死、空泡样变性,肾间质水肿及炎性细胞浸润(图1F),肾损伤评分高于对照组(P<0.001,图1G)。与模型组比较,实验组小鼠肾损伤程度有所改善(图1F),肾损伤评分降低(P<0.001,图1G)。
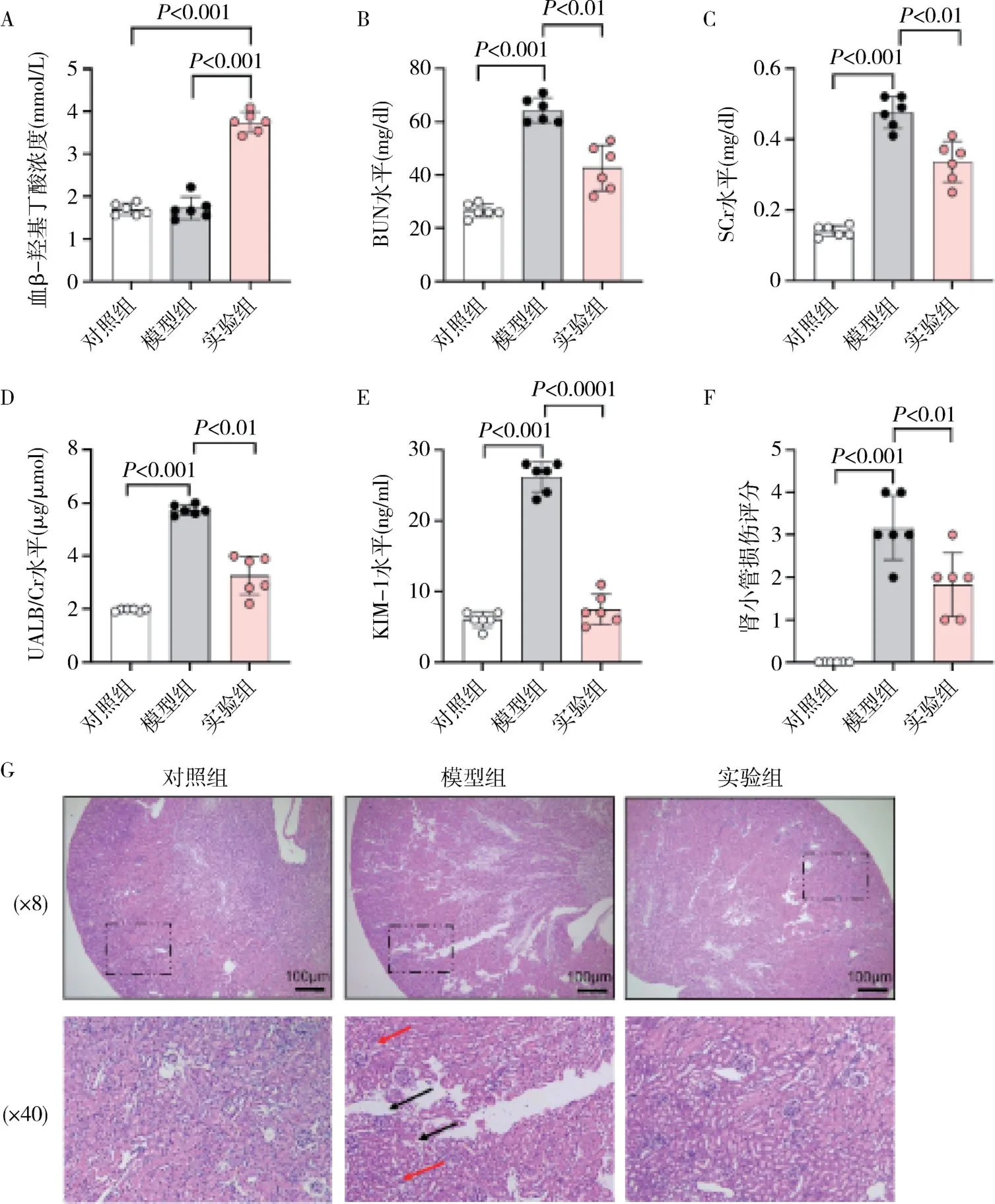
图1 各组小鼠肾功能指标和肾组织病理结构
2.酮体对LPS 诱导的小鼠急性肾损伤氧化应激的影响:与对照组比较,模型组小鼠肾组织MDA 含量显著上升(P<0.001,图2A),其余抗氧化酶,包括SOD、GSH 和CAT 活性均明显下降(P<0.001,图2中B ~D)。 与模型组比较,实验组小鼠肾组织MDA含量较低(P<0.001,图2A),SOD、GHS 和CAT 活性均有一定恢复(P<0.001,图2 中B ~D)。

图2 各组小鼠肾组织氧化应激指标
3.酮体对LPS 诱导的小鼠急性肾损伤FoxO3a 和SOD2 蛋白表达的影响:与对照组比较,模型组小鼠肾组织中FoxO3a 和SOD2 蛋白水平均明显下降(P<0.001)。 与模型组比较,实验组小鼠肾组织FoxO3a和SOD2 蛋白表达有所上升(P<0.001),详见图3。

图3 蛋白免疫印迹检测各组小鼠肾组织中FoxO3a 和SOD2 的表达
讨 论
AKI 是一种以血肌酐水平快速升高和肾脏排泄功能突然丧失为特征的复杂临床综合征,已被视为与高发生率和高病死率相关的重大公共卫生问题[13]。全球范围内,住院或重症监护病房患者的AKI 患病率相当惊人[4,13]。 尽管肾脏替代疗法已取得相当的进步,但大多数患者仍然面临严重肾功能损害[2,4]。值得注意的是,败血症被看做是危重患者AKI 的重要触发器。 大量研究表明,脓毒症诱导的AKI 肾功能变化更明显,肾脏组织学变化更剧烈,总体病死率更高[2,14]。 因此,迫切需要制定有效的治疗策略来缓解这一严重临床症状并改善预后。
本研究通过腹腔注射LPS 诱导小鼠脓毒症后,小鼠肾小球滤过功能指标BUN 和SCr 和肾小管损伤指标KIM-1 都明显增高,提示AKI 的发生[16,17]。HE 染色也显示肾组织结构的破坏,表现为肾小管上皮细胞出现大量空泡,小管内可见散在铸型和脱落细胞及炎性细胞的浸润,与文献报道一致[7,15]。 本研究中酮脂灌胃的小鼠上述指标和肾脏结构都趋于正常,明确了酮体对脓毒症肾损伤的保护作用。 此外,大量研究已经证明活性氧爆发导致的氧化应激损伤是AKI 发病的关键因素之一[6,18]。 在生理条件下,细胞内氧化应激与抗氧化防御处于平衡,当活性氧生成过多时,抗氧化通路被激活以清除增多的活性氧,以维持细胞正常功能,其中SOD、CAT 和GSH 都是胞内重要的抗氧化物质[5,6]。 本研究发现,LPS 处理的小鼠肾组织内上述几种抗氧化酶活性均显著下降,脂质过氧化终产物MDA 含量也明显增加。 因此,减轻肾脏氧化应激可能对急性肾损伤起到保护作用。
近年来,酮体作为信号分子,在调节蛋白翻译后修饰以及炎症和氧化应激过程中的重要作用备受关注[9,19]。 β-羟基丁酸是循环血中酮体的主要形式,生理条件下,人血液中β-羟基丁酸浓度维持在0.02 ~0.10mmol/L,禁食48 ~72h 可提升至2 ~3mmol/L,更长时间的禁食或生酮喂养会进一步增加其至5 ~8mmol/L[9,10]。 有研究发现,在人胚胎肾细胞,β-羟基丁酸可以通过促进组蛋白乙酰化来增加抗氧化基因的表达,从而减轻细胞氧化应激[20]。 也有研究发现,β-羟基丁酸可以通过增加谷胱甘肽过氧化氢酶活性对缺血性脑卒中起到保护作用[11]。 总之,酮体已经在细胞、动物和在体层面都显示出相当的益处,但尚未研究观察酮体对脓毒症急性肾损伤的影响。因此本研究通过灌胃酮脂升高小鼠血酮浓度并且改善了小鼠肾功能和肾损伤,同时伴随抗氧化酶活性的提高,更重要的是发现抗氧化通路FoxO3a 及下游靶蛋白SOD2 表达的增强,从而介导肾脏抗氧化应激,这与既往研究结果一致[20]。
综上所述, 酮体可以通过促进抗氧化通路FoxO3a 和SOD2 的表达,减轻氧化应激损伤来防止肾功能恶化和肾组织的破坏。 本研究也存在一定的不足,酮体上调FoxO3a 和SOD2 表达的具体机制,还需要进行更深层次地验证。
