抑制HDAC6可增强自噬减轻肾脏缺血再灌注损伤
2022-11-05邓芳静朱杰夫吴雄飞
邓芳静 朱杰夫 吴雄飞
肾脏缺血再灌注损伤(renal ischemic reperfusion injury,RIRI)是指肾脏血流中断后,血流恢复反而引起肾功能不全和组织损伤加重的现象,是导致急性肾损伤(acute kidney injury,AKI)的主要原因之一。 组织损伤的程度与血流减少的程度和缺血的持续时间有关。 RIRI 是器官移植、休克、脓毒症、烧伤、心血管疾病和创伤患者常见的并发症之一[1~3]。 目前认为,组织缺血和随后的再灌注导致受影响组织的各种代谢改变,包括细胞三磷酸腺苷(adenosine triphosphate,ATP)水平的降低,细胞内和线粒体钙水平的增加,活性氧的产生,内质网应激,炎症损伤作用,细胞凋亡和坏死等[2~5]。 近年来研究发现,自噬和表观遗传学也参与了肾脏缺血再灌注损伤。
自噬由一系列高度保守的细胞自噬相关蛋白(autophagy-related proteins,ATGs)参与并受多种信号通路调控的过程。 自噬可以通过降解错误折叠或聚集的蛋白质,清除受损的细胞器(如线粒体、内质网和过氧化物酶体)以及消除细胞内病原体,维持机体内环境平衡。 自噬包括巨自噬、微自噬和分子伴侣介导的自噬,所有这些都促进溶酶体中胞质组分的蛋白水解降解[6,7]。 自噬是一个复杂的过程和调控机制,在生理和病理条件下都具有重要意义。 随着研究的不断深入,自噬功能障碍与多种疾病发生、发展都有关,如衰老、恶性肿瘤、神经病变、脑卒中等[8~11]。研究发现,肾脏基础自噬对于维持肾脏稳态、结构和功能至关重要。 自噬在肾脏疾病的发生、发展中发挥着重要的作用,激活自噬可减轻肾脏损伤[12,13]。
表观遗传学是指在不改变DNA 序列的前提下,通过某些机制引起可遗传的基因表达或细胞表型的变化,其中包括乙酰化、甲基化、磷酸化、磺酰化、泛素化、羰基化和糖基化。 组蛋白乙酰转移酶(histone acetyltransferases,HATs)和组蛋白去乙酰化酶(histone deacetylases, HDACs) 介导乙酰化和去乙酰化[15]。 HDAC6 是组蛋白去乙酰化酶家族成员之一,含有两个N 端去乙酰化结构域、1 个C 端泛素结合结构域、1 个强核输出信号、8 个连续重复的十四肽[16]。HDAC6 可以使组蛋白和非组蛋白去乙酰化。 微管具有从维持细胞形态到亚细胞转运,细胞信号转导,细胞迁移和细胞极性形成的重要功能。 微管对于各种生物过程至关重要,如炎症、免疫反应、学习和记忆等。 微管参与了自噬体的形成、自噬体在细胞质中的运输以及自溶体的形成。 微管是由α-微管蛋白和β-微管蛋白组成的异二聚体。 α-微管蛋白在自噬中起重要作用。 α-微管蛋白受到各种共价修饰,其中一种修饰是微管蛋白乙酰化,它与稳定微管结构相关。 在哺乳动物中,其乙酰化水平主要由α-微管蛋白乙酰转移酶1 和HDAC6 控制[6,14]。 HDAC6 能与微管结合,除去α-微管蛋白中的乙酰基残基,介导α-微管蛋白乙酰化,从而调节微管结构并保持微管完整性[7]。 HDACs 功能异常与肿瘤、神经退行性疾病、炎性反应性疾病、肾脏疾病等诸多疾病发生、发展关系密切[6,15,17,18]。 目前,HDAC6 参与肾脏缺血再灌注损伤作用的潜在机制尚不清楚。 本研究中笔者试图验证HDAC6 调控自噬参与了肾脏缺血再灌注损伤,为治疗缺血再灌注损伤提供参考依据。
材料与方法
1.主要材料:小鼠肾小管细胞BUMPT 购自中南大学湘雅医学院;胎牛血清购自中国四季青公司;高糖培养基购自美国Hyclone 公司;TRIzol 试剂购自美国Invitrogen 公司;反转录试剂盒购自中国Servicebio公司;GAPDH 抗体(货号:10494-1-AP)购自中国Proteintech 公司;acetylated tubulin(Lys40) Monoclonal antibody(货号:66200-1-lg) 购自中国Proteintech公司;HDAC6 抗体(货号:ab207612)购自英国Abcam公司;ATG7 抗体(货号:DF6130)购自中国Affinity 公司;Beclin-1 抗体(货号:T55092) 抗体购自中国Abmart 公司;LC3 抗体(货号:3868)抗体购自美国CST 公司;CCK-8 溶液购自中国Servicebio 公司;PE AnnexinⅤ双染细胞凋亡检测试剂盒购自中国安特捷公司。
2.细胞培养:将BUMPT 细胞分为4 组:正常对照组、正常加TA 组、缺氧复氧组、缺氧复氧加TA组。 BUMPT 细胞用含有10% FBS,1% 青霉素和链霉素的高糖培养基,在37℃含5% CO2和95% 的空气培养箱中培养。 用ATP 耗竭方法制作细胞缺氧复氧模型。
3.动物:体质量为20 ~25g 的雄性C57BL/6 小鼠(购自三峡大学)喂养在提供食物和水的12h∶12h的光/暗循环环境中。 12 只小鼠随机分为对照组(n=6)和缺血再灌注组(n=6)。 缺血再灌注组采用双侧肾动脉夹闭28min 再灌注24h 的方法建立肾IRI小鼠模型,即戊巴比妥钠(60mg/kg)腹腔注射麻醉小鼠,开腹暴露肾脏,夹闭双侧肾蒂,当肾脏由鲜红色变为紫黑色为缺血成功;28min 后恢复血流,由紫黑色变为鲜红色为再灌注成功。 本实验已通过笔者医院动物伦理审批[伦理号:WDRM 动(福)第202110707号]。
4.组织学检查:将肾脏固定在4%的多聚甲醛溶液中,在一系列不同浓度的乙醇中脱水,石蜡包埋。将石蜡块切成4μm 切片,HE 染色,光镜下放大200倍进行形态学分析。
5.RNA 提取和RT-qPCR 法:按照TRIzol 试剂使用说明书从肾脏中提取总RNA,并使用反转录试剂盒将1000ng 总RNA 反转录为cDNA。 根据试剂盒使用说明书操作,使用UltraSYBR 混合物进行PCR检测。 采用两步法PCR,程序设定:95℃变性15s、60℃延伸1min,共40 个循环。 以GAPDH 基因作为内参,通过2-△△Ct法计算目的基因相对表达量。HDAC6 引物序列:上游引物:5'-TTATGCCCACCTCACCCACCTAC-3',下游引物:5'-GCGATGGACTTGGATGACCTCAC-3'。 GAPDH 引物序列:上游引物:5'-GGAGCGAGATCCCTCCAAAAT-3',下游引物:5'-GGCTGTTGTCATACTTCTCATGG-3'。 实验独立重复3 次。
6.蛋白提取和Western blot 法检测:将细胞裂解,提取总蛋白。 采用BCA 法测定蛋白质浓度。 通过SDS-聚丙烯酰胺凝胶电泳分离蛋白,然后经电泳将蛋白转移到聚偏二氟乙烯(PVDF)膜上,封闭后将膜与一抗GAPDH 抗体(1 ∶20000)、HDAC6 抗体(1 ∶1000)、acetylated tubulin(Lys40) Monoclonal antibody抗体(1 ∶1000)、ATG7 抗体(1 ∶1000)、LC3 抗体(1 ∶1000)、Beclin-1 抗体(1 ∶1000)在4℃下孵育过夜,洗膜后加入二抗溶液在室温下孵育60min,使用ECL化学发光试剂盒显影。 采用Image J 软件对蛋白条带进行灰度分析并对蛋白进行半定量计算。
7.CCK-8 法检测细胞增殖:将对数期BUMPT细胞接种在96 孔板中,每组设置6 个复孔。 在贴壁生长1 天后,细胞缺氧复氧后加入CCK-8 溶液,继续孵育2h,用酶标仪检测各孔在450nm 波长处的吸光度值,以吸光度值代表细胞增殖水平。
8.流式细胞仪检测细胞凋亡率:将各组BUMPT细胞接种于6 孔板内,培养过夜后给予各组相应处理后,严格按照PE AnnexinⅤ双染细胞凋亡检测试剂盒操作,在流式细胞仪上检测细胞凋亡率。 位于右下象限的早期凋亡细胞和位于右上象限的晚期凋亡细胞之和记录为凋亡细胞。
9.统计学方法:使用GraphPad Prism 9.0 软件进行统计分析与绘图;两组比较采用t检验;多组采用多因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1.HDAC6 在小鼠肾缺血再灌注损伤后高表达:如图1 中A、B 所示,与假手术组比较,缺血再灌注组的血清肌酐、尿素氮显著升高。 与正常组比较,缺血再灌注组的肾脏组织病理学改变包括近端小管细胞坏死和脱落、刷状边缘消失、细胞碎片积累、肾小管扩张和蛋白管型形成(图1C)。 通过RT-qPCR 法和Western blot 法检测HDAC6 的表达水平。 结果显示,与假手术组比较,缺血再灌注组中HDAC6 蛋白(图1D)和HDAC6mRNA(图1E)表达均显著升高(P<0.05)。

图1 HDAC6 在缺血再灌注组呈高表达(n =6)
2.TA 可以减轻缺氧复氧导致的细胞损伤,增加细胞活力:用CCK-8 检测正常+ DMSO 组、正常+TA 组、缺氧复氧+ DMSO 组、缺氧复氧+ TA 组增殖情况,结果显示,缺氧复氧组相对正常组吸光度值降低,表示细胞增殖活力降低;而缺氧复氧+ TA 组,吸光度值相对于缺氧复氧+DMSO 组增高,表示细胞增殖活力增强(图2A)。 利用流式细胞术检测凋亡,结果显示, 缺氧复氧组相对正常组细胞凋亡增多;而缺氧复氧+ TA 组细胞凋亡减少(图2 中B、C,P<0.05)。

图2 不同组细胞活力及凋亡情况
3.HDAC6 抑制剂促进α-微管蛋白乙酰化:Western blot 法检测4 组细胞中α-微管蛋白乙酰化表达水平。 结果显示,与正常组比较,在缺氧复氧组细胞中α-微管蛋白乙酰化表达降低,表明HDAC6表达增加,可以抑制α-微管蛋白乙酰化水平;而缺氧复氧+TA 组,α-微管蛋白乙酰化水平增高,表明HDAC6 抑制剂可促进α-微管蛋白乙酰化(图3,P<0.05)。
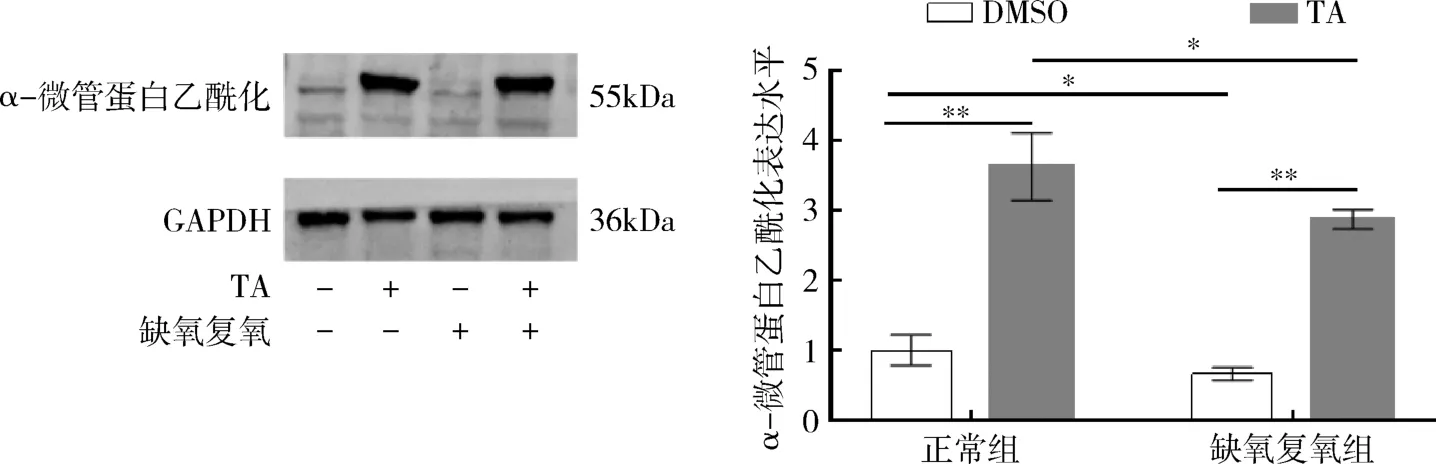
图3 各组细胞α-微管蛋白乙酰化表达水平
4.HDAC6 抑制剂增强自噬:通过Western blot 法检测4 组细胞中自噬相关蛋白表达水平。 结果显示,与正常组比较,在缺氧复氧组细胞中自噬相关蛋白LC3、Beclin-1、ATG7 表达增加,表明在缺氧复氧时细胞自噬激活;而缺氧复氧并加入抑制剂TA 组,自噬相关蛋白LC3、Beclin-1、ATG7 表达水平相对于单纯缺氧复氧组增强,表明HDAC6 抑制剂可增强自噬(P<0.05,图4)。
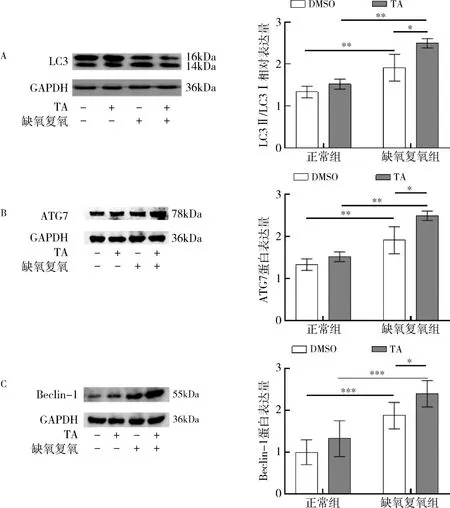
图4 不同组织细胞自噬相关蛋白表达水平
讨 论
HDAC6 是Ⅱb 类组蛋白去乙酰酶,调节许多重要的生物过程,HDAC6 的异常表达也与各种疾病的发展有关,例如癌症、神经退行性疾病、炎症性疾病以及肾脏疾病[19~21]。 有研究指出,HDAC6 与组蛋白和非组蛋白底物相互作用,参与基因转录、DNA 损伤修复和细胞运动。 HDAC6 的表达增加或活性增强,导致致癌细胞的转化和肿瘤细胞的增殖、侵袭、转移和有丝分裂。 使用HDAC6 抑制剂可用抑制肿瘤的发展。 另有研究认为,HDAC6 抑制剂能保护和营养神经细胞,诱导神经元细胞分化,对多种神经退行性疾病都有潜在治疗效果[19]。
有研究表明,选择性HDAC6 抑制剂可以抑制炎症信号通路和减轻内毒素诱导的急性肺炎[20]。 Shi等[21]研究显示,在甘油注射诱导横纹肌溶解小鼠中,HDAC6 表达增加,使用HDAC6 选择性抑制剂TA 可显著降低血清肌酐和血尿素氮水平,减轻肾小管损伤,表明HDAC6 可能促进横纹肌溶解诱导的AKI,而HDAC6 抑制剂对AKI 具有治疗潜力。 本研究通过Western blot 法和RT-qPCR 法检测发现,在缺血再灌注组小鼠肾脏中HDAC6 表达增加。 通过CCK-8及流式细胞术可以发现缺氧复氧组细胞活力降低及凋亡增加,而使用HDAC6 抑制剂可以增加细胞活力减少细胞凋亡。 α-微管蛋白是细胞分裂、形成、运动和细胞内转运所必需的蛋白。 α-微管蛋白乙酰化水平与疾病密切相关。 在Zhang 等[22]研究中,证明了HDAC6 抑制剂能增加α-微管蛋白乙酰化水平,减轻脑缺血再灌注损伤。 Western blot 法检测发现,在缺氧复氧组α-微管蛋白乙酰化水平降低,而使用HDAC6 抑制剂可以增加α-微管蛋白乙酰化水平。
肾脏细胞的基础自噬对于维持肾脏稳态、结构和功能至关重要。 自噬失调能促进急性肾损伤和急性肾损伤后肾脏不完全修复,以及各种各样的慢性肾脏疾病,包括糖尿病肾病、局灶节段性肾小球硬化症和多囊性肾病变[23~25]。 有研究提出,自噬受损,增加肾细胞对糖尿病相关损伤的易感性,会促进糖尿病的进展[25]。 本研究发现,缺氧复氧诱导了肾小管上皮细胞自噬,增加了LC3、Beclin-1、ATG7 表达。 使用HDAC6 选择性抑制剂TA,可进一步增强缺氧复氧组细胞LC3、Beclin-1、ATG7 表达,这表明抑制HDAC6可增强自噬,促进肾小管细胞存活。 α-微管蛋白参与了自噬体的形成、自噬体在细胞质中的运输以及自溶体的形成。 有研究报道,HDAC6 可抑制α-微管蛋白乙酰化水平,影响自噬形成,导致心肌损伤[26]。因此在缺血再灌注损伤中,阻断HDAC6,减轻肾功能损伤可能与增加α-微管蛋白乙酰化水平、增强自噬有关。
综上所述,本研究发现,在缺血再灌注损伤的肾脏组织和缺氧复氧的肾小管上皮细胞中HDAC6表达上调,使用抑制HDAC6 选择性抑制剂TA,可促进缺氧复氧细胞中α-微管蛋白乙酰化和自噬相关蛋白表达,减少细胞损伤。 因此,HDAC6 抑制剂可能具有治疗肾脏缺血再灌注损伤的潜在临床意义。
