宫颈癌患者实施调强放疗与三维适形放疗的疗效比较及安全性评价
2022-11-05沈运昌
沈运昌,陈 辉
(常德市第一中医医院放疗中心,湖南 常德 415000)
宫颈癌作为发生在子宫颈部的恶性肿瘤,是女性生殖道最常见的恶性肿瘤。对于宫颈癌,目前国内临床上主要根据患者的病理类型、肿瘤大小及是否发生扩散转移,并结合患者的年龄及生育需求,以手术治疗、放化疗、靶向治疗及免疫治疗为主。三维适形放疗通过对影像图像进行计算机处理,使得人体内的放疗靶区和邻近的重要组织器官可以进行三维重现,从而使不规则的肿瘤形状也能够得到最合适的放疗区域的设计,但无法进一步针对肿瘤区域分布调整射野内部的剂量,存在一定的不足之处[1];而调强放疗则是在三维适形放疗的基础上进一步发展,将放射束强度依据靶区三维形状与人体内要害脏器的解剖关系进行调节,从而使得放射线能够更为精准地针对体内病灶,且不会伤及周边器官,从而在一定程度上降低放疗的不良反应发生率[2]。本研究旨在探讨调强放疗与三维适形放疗对宫颈癌患者血清基质金属蛋白酶 -9(MMP-9)、血管内皮生长因子C(VEGFC)、转化生长因子 -β1(TGF-β1)、恶性肿瘤特异性生长因子(TSGF)水平的影响,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2018年1月至2020年3月常德市第一中医医院收治的80例宫颈癌患者的临床资料,按照其治疗方法的不同分为三维适形放疗组(38例)与调强放疗组(42例)。三维适形放疗组:年龄38~69岁,平均(51.64±3.67)岁;癌症类型:鳞癌34例,混合癌2例,腺癌2例;国际妇产科学联合会妇科肿瘤(FIGO)[3]分期:Ⅱb 16例,Ⅲa 20例,Ⅲb 2例。调强放疗组:年龄39~70岁,平均(52.13±3.46)岁;癌症类型:鳞癌39例,混合癌1例,腺癌2例;FIGO分期:Ⅱb 17例,Ⅲa 22例,Ⅲb 3例。比较两组患者一般资料(年龄、癌症类型、FIGO分期),差异无统计学意义(P>0.05),组间可比。诊断标准:参照《宫颈病变与宫颈癌》[4]中的相关诊断标准。纳入标准:符合上述诊断标准,且经病理学检测确诊者;FIGO分期为Ⅱb ~ Ⅲb,癌瘤浸润至宫旁、盆壁、阴道者;预计生存时间≥ 6个月者;临床资料完整者等。排除标准:合并其他女性生殖系统疾病者;既往行静脉化疗或靶向治疗导致严重骨髓抑制或胃肠道反应不能耐受放疗者;免疫功能障碍者;存在有血液系统疾病者等。院内医学伦理委员会批准本研究。
1.2 治疗方法两组患者在进行放疗前均接受定位准备与靶区勾画[5]。三维适形放疗组患者在前期准备完成后接受三维适形放疗,以医用直线加速器[瓦里安医疗设备(中国)有限公司,型号:Halcyon]使用6 MV X射线,以4野盒式进行照射,照射角度设定为:270°、180°、90°以及0°,2 Gy/次,5次/周。调强放疗组患者在前期准备完成后接受调强放疗,以医用直线加速器使用6 MV X射线,以5野调强技术,照射角度设定为:270°、216°、144°、72°及0°,2 Gy/次,5次/周。两组患者均在进行23次放疗后接受腔内后装治疗,6 Gy/次,1次/周,总剂量30 Gy,共治疗5周。两组患者均定期随访2年。
1.3 观察指标①临床疗效,治疗后参照《宫颈病变与宫颈癌》[4]中的相关标准进行评估,完全缓解(CR):患者经放疗后所有靶病灶完全消失,且并无新病灶增生迹象,至少维持4周左右;部分缓解(PR):患者经放疗后靶病灶最大径之和较治疗前减少幅度≥ 30%,并至少维持4周左右;疾病稳定(SD):患者经放疗后靶病灶最大径之和较治疗前减少幅度未达到PR标准,但也未增大至疾病进展(PD)标准;PD:患者经放疗后靶病灶最大径之和较治疗前增加幅度≥ 20%,或存在有新病灶增生现象。疾病控制率(DCR) = CR率+PR率+SD率。②分别于治疗前、治疗后,在患者空腹状态下采集静脉血4 mL,将血样置于离心机(转速、时间分别为3 000 r/min、10 min)中,得到血清,使用酶联免疫吸附法检测血清MMP-9、VEGFC、TGF-β1、TSGF水平。③两组患者靶区剂量覆盖指数及危及器官(OAR)最大受照剂量对比,包括膀胱、小肠、直肠、脊髓以及股骨头。④治疗后不良反应发生情况,包括3度以上骨髓抑制、放射性膀胱炎、放射性直肠炎及肝肾损伤;并记录2年内局部复发情况。
1.4 统计学方法使用SPSS 23.0统计学软件分析数据,计数资料以[ 例(%)]表示,采用χ2检验;经K-S法检验证实符合正态分布的计量资料以(±s)表示,采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较治疗后,调强放疗组患者DCR显著高于三维适形放疗组,差异有统计学意义(P<0.05),见表1。
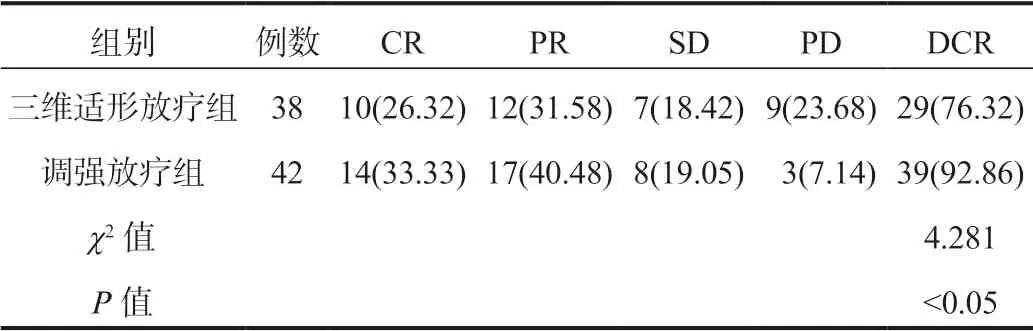
表1 两组患者临床疗效比较[ 例(%)]
2.2 两组患者血清MMP-9、VEGFC、TGF-β1、TSGF水平比较较治疗前,治疗后两组患者血清MMP-9、VEGFC、TGF-β1、TSGF水平均显著降低,且调强放疗组显著低于三维适形放疗组,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者血清MMP-9、VEGFC、TGF-β1、TSGF水平比较(±s)
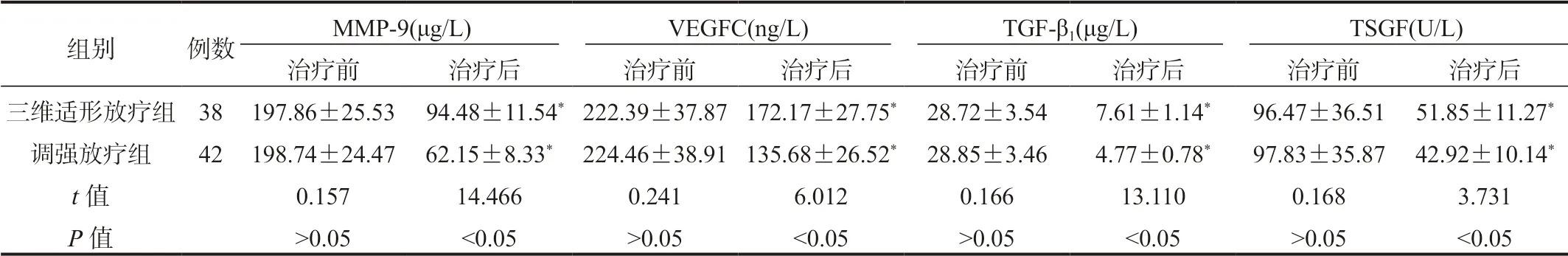
表2 两组患者血清MMP-9、VEGFC、TGF-β1、TSGF水平比较(±s)
注:与治疗前比,*P<0.05。MMP-9:基质金属蛋白酶 -9;VEGFC:血管内皮生长因子C;TGF-β1:转化生长因子 -β1;TSGF:恶性肿瘤特异性生长因子。
组别 例数 MMP-9(μg/L) VEGFC(ng/L) TGF-β1(μg/L) TSGF(U/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后三维适形放疗组38 197.86±25.53 94.48±11.54*222.39±37.87 172.17±27.75*28.72±3.54 7.61±1.14* 96.47±36.51 51.85±11.27*调强放疗组 42 198.74±24.47 62.15±8.33*224.46±38.91 135.68±26.52*28.85±3.46 4.77±0.78* 97.83±35.87 42.92±10.14*t值 0.157 14.466 0.241 6.012 0.166 13.110 0.168 3.731 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者OAR最大受照剂量比较调强放疗组患者小肠、脊髓的最大受照剂量均显著小于三维适形放疗组,差异均有统计学意义(均P<0.05);两组患者膀胱、直肠、股骨头的最大受照剂量相比,差异均无统计学意义(均P>0.05),见表3。
表3 两组患者OAR最大受照剂量比较(±s , cGy)

表3 两组患者OAR最大受照剂量比较(±s , cGy)
注:OAR:危及器官。
组别 例数 膀胱 小肠 直肠 脊髓 股骨头三维适形放疗组 38 5 121.39±733.58 5 357.75±619.58 4 587.87±651.36 3 678.72±458.36 4 585.57±563.37调强放疗组 42 4 852.46±684.45 4 468.82±526.75 4 416.28±682.59 2 984.63±387.25 4 432.14±528.46 t值 1.696 6.933 1.147 7.338 1.257 P值 >0.05 <0.05 >0.05 <0.05 >0.05
2.4 两组患者不良反应发生情况、复发情况比较两组患者各项不良反应发生率与复发率比较,差异均无统计学意义(均P>0.05),见表4。
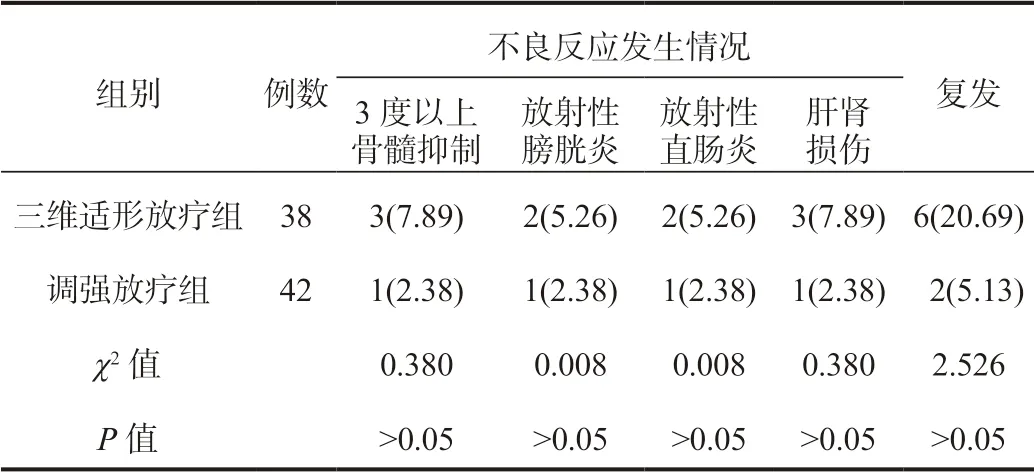
表4 两组患者不良反应发生情况、复发情况比较[ 例(%)]
3 讨论
宫颈癌发病率位于女性肿瘤的第2位,其早期并无明显临床症状,随着病情发展则会逐渐出现接触性出血、异常阴道流血等症状。放疗是癌症治疗的三大手段之一,其主要利用放射线电离辐射作用破坏或灭杀人体内肿瘤细胞,但传统放疗中所用放射线精准性较差,会对空腔脏器造成较大损伤,且靶区周围组织也会承受不必要的照射,从而杀伤破坏正常组织,不良反应较大[6]。三维适形放疗在进行治疗时需要以靶区与周围器官组织的三维解剖为依据调整放射束强度分布再施行治疗,较常规放疗可有效提高了放疗的定位、摆位及照射精度,从而减少放疗中不必要的照射损伤,也可避免照射范围过小而导致的治疗失败,但在治疗部分与重要脏器具有紧密联系的肿瘤,仍旧存在损害脏器的风险[7]。
调强放疗是在三维适形放疗的基础上更精确的放疗,其通过计算机优化,得到高度的剂量适形和更佳的剂量梯度,能够根据要害器官与靶区的具体解剖关系调整放射束强度,使得整个靶区内体积剂量分布更为均匀[8]。本研究结果显示,较三维适形放疗组,调强放疗组患者DCR显著升高,小肠、脊髓的最大受照剂量均显著减小,表明以调强放疗对宫颈癌患者进行治疗能够在一定程度上减小对小肠、脊髓的辐射受照剂量,且疗效更佳。
MMP-9能够与人体中其他酶类相互配合,对血管基底膜及周围基质进行降解,从而促进血管生成,加速肿瘤细胞的转移及侵袭;VEGF能诱导肿瘤内部及肿瘤周围组织淋巴管的新生与扩张,从而导致肿瘤发生淋巴结转移;TGF-β1是生理和病理组织修复反应的关键调节因子,一旦发生偏离即会出现过度病理性修复,从而导致组织纤维化与免疫失调,这同样也是癌症的明显特征之一,因此其水平越高,则代表宫颈癌患者病情恶化;当肿瘤产生时,人体当中TSGF的含量升高,是检测术后、放化疗治疗效果以及检测癌症是否发生转移、复发的重要线索。三维适形放疗是通过高能射线使得人体内肿瘤细胞发生坏死以达到治疗的目的,但正常的人体组织对于辐射剂量存在有一定的耐受量,超过耐受量则会对人体造成较大损害,进而引发骨髓抑制、放射性膀胱、直肠炎及肝肾损伤,严重者甚至会降低患者的生存率[9]。调强放疗利用计算机控制的X光加速器,向恶性肿瘤或肿瘤内的特定区域发射精确的辐射剂量,在保护肿瘤周围临近的正常人体组织的同时,还能够使肿瘤得到最大化的辐射剂量,抗肿瘤效果更为显著[10]。本研究结果显示,治疗后调强放疗组患者血清MMP-9、VEGFC、TGF-β1、TSGF水平均显著低于三维适形放疗组,表明以调强放疗对宫颈癌患者进行治疗能够降低癌症相关血清因子水平,控制病情发展,与余昌等[11]研究结果较为相似。调强放疗能够根据肿瘤的3D形状相对应地调节辐射强度,使得肿瘤周围的正常组织所受的辐射剂量更少,而肿瘤内区域得到的辐射剂量更高,进而使放疗所致的不良反应更少。本研究中,调强放疗组患者各项不良反应发生率与复发率均低于三维适形放疗组,提示相比于三维适形放疗,调强放疗对宫颈癌患者安全性较好,且可预防复发;但组间比较,差异无统计学意义,究其原因可能为本研究样本量较小所致,因此建议后续开展大样本量深入研究。
综上,采用调强放疗对宫颈癌患者进行治疗能够在一定程度上降低对小肠、脊髓的辐射受照剂量,并降低癌症相关因子水平,且安全性良好,肿瘤控制率显著;但由于本研究样本量少、随访周期短,因此仍需临床进一步开展深入研究。
