甘露糖修饰雷公藤红素脂质体处方工艺优化及体外靶向性评价
2022-11-05司佳奇蔡佳雨刘婉滢李沣芮李学涛
司佳奇,刘 洋,蔡佳雨,刘婉滢,李沣芮,孔 亮, 2,李学涛*
甘露糖修饰雷公藤红素脂质体处方工艺优化及体外靶向性评价
司佳奇1,刘 洋1,蔡佳雨1,刘婉滢1,李沣芮1,孔 亮1, 2,李学涛1*
1. 辽宁中医药大学药学院,辽宁 大连 116600 2. 辽宁中医药大学中医脏象理论及应用教育部重点实验室,辽宁 沈阳 110847
制备甘露糖修饰的雷公藤红素脂质体(mannose-celastrol-liposomes,Man-Cel-Lips),对其处方进行优化,并初步评价其体外靶向性。采用薄膜分散法制备Man-Cel-Lips。以包封率为考察指标,采用Box-Behnken设计-响应面法优化处方中胆固醇加入量、Cel加入量和探头超声时间间隔;按最优处方制备3批脂质体,对其进行表征并考察其体外释放情况。以香豆素为荧光探针,采用流式细胞仪和荧光显微镜法考察甘露糖对脂多糖诱导的RAW264.7细胞的摄取和靶向作用。通过Box-Behnken响应面法,确定最优处方工艺为胆固醇4 mg、Cel 1 mg、磷脂22 mg,超声间隔时间5 s,总处方量为5 mL。所制得3批脂质体平均粒径为(93.50±1.04)nm,多分散指数为0.22±1.81,ζ电位为(−5.70±0.26)mV,平均包封率为(92.75±0.61)%,相比于游离Cel,Man-Cel-Lips具有一定缓释效果。体外细胞摄取实验结果表明,Man-Cel-Lips对细胞的摄取效率高于其他组,且呈剂量相关性(<0.05)。成功制备并优化Man-Cel-Lips,经甘露糖修饰的Cel-Lips靶向性增强,为后续研究其抗炎活性奠定基础。
雷公藤红素;甘露糖;处方优化;巨噬细胞;靶向性;脂质体;薄膜分散法;Box-Behnken设计-响应面法;抗炎
类风湿性关节炎(rheumatoid arthritis,RA)是最常见的慢性、全身自身免疫性疾病,以慢性滑膜炎和软骨破化为主要特征,患者常伴有持续性关节疼痛、肿胀、僵硬,严重者则会引发心血管、肺、骨骼等多种并发症,严重影响患者的生活水平与生活质量[1-2]。
雷公藤是卫矛科雷公藤属植物雷公藤Hook. f.的干燥根,其药用最早记载于明朝兰茂所著的《滇南本草》,具有“治禁锢疼痛、风寒湿痹、麻木不仁、瘫痪痿软”等功效[3]。其中雷公藤红素(celastrol,Cel),又名南蛇藤素,是从雷公藤根皮中分离提取得到的天然活性产物,具有抗炎、抗氧化、抗血栓、心脏保护等多种生物活性[4-8],早在2011年已有应用Cel治疗关节炎小鼠的报道[9],虽然Cel具有很好的药理活性,但由于其自身毒性大、口服生物利用度低以及水溶性差,很大程度上限制了其临床应用[10]。
脂质体是以类脂质(如磷脂和胆固醇)构成的双分子层为膜材包合而成的微粒。修饰靶向分子后的脂质体能选择性地分布于某些组织和器官,提高药物在靶部位的质量浓度,既可提高药效、减少剂量,又能降低药物带来的毒副作用,是1种最具有开发潜力的新型纳米给药系统之一[11-12]。甘露糖是唯一用在临床上的糖质营养素,广泛分布于体液和组织中[13]。作为1种具有潜力的靶向基团,甘露糖具有无毒、无免疫原性、生物相容性和生物可降解性良好等诸多优点,并且甘露糖受体在巨噬细胞表面高表达[14]。本研究制备甘露糖修饰的雷公藤红素脂质体(mannose-celastrol-liposomes,Man-Cel-Lips),对其进行处方优化,并初步考察其体外靶向性,为后续抗RA治疗研究提供参考。
1 仪器与材料
1.1 仪器
Agress1100型高效液相色谱仪,大连依利特分析仪器有限公司;T1-S型倒置荧光显微镜,日本Nikon公司;B-220型电热恒温水浴锅、RE52CS型旋转蒸发仪,上海亚荣生化仪器厂;JY92-2D型超声波细胞捣碎机,宁波新芝生物股份有限公司;JEM-1200EX型透射电子显微镜(TEM),日本JEOL公司;ZS90型激光散射粒径测定仪,英国Malvern公司。
1.2 药品与试剂
Cel对照品,批号21081001,质量分数>99%,购自成都普菲德生物技术有限公司;胆固醇(批号N1018A,质量分数>95%)、脂多糖(批号M0509A/ N1120A)均购自大连美仑生物科技有限公司;二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(distearoyl phosphoethanolamine-PEG2000,DSPE-PEG2000,批号RA0221417)、DSPE-PEG2000-Man(批号RF0221713)均由西安瑞禧生物科技有限公司合成;香豆素,批号MKBV4602V,购自美国Sigma-Aldrich公司;卵磷脂,批号120025,购自日本NOF公司;胎牛血清(FBS),批号G211HN,购自浙江天杭生物科技有限公司;DMEM完全培养基(批号20210619)、Sephadex G-100葡聚糖凝胶(批号20190307)、磷酸盐缓冲液(PBS,批号1022Q)均购自北京索莱宝科技有限公司;其余试剂为分析纯,水为纯净水。
1.3 细胞
RAW264.7细胞购自赛百慷(上海)生物技术股份有限公司,培养于含10% FBS、1%双抗的DMEM完全培养基中,置37℃、5% CO2培养箱中培养。
2 方法与结果
2.1 脂质体制备
采用薄膜分散法制备Man-Cel-Lips。精密称取处方量的DSPE-PEG2000、Cel、DSPE-PEG2000-Man、卵磷脂、胆固醇,以适量甲醇溶解并超声片刻,于40℃水浴中减压旋蒸,待烧瓶底部形成一层均匀的薄膜时取下,加入5 mL PBS超声轻摇直至薄膜完全溶解,将混悬液转移至10 mL EP管中,置功率600 W探头下,超声破壁10 min,待混悬液澄清透明,过2次0.22 μm微孔滤膜,收集滤液,即得Man- Cel-Lips。同上述操作,除不加入Cel以制备Man- Lips;除不加入DSPE-PEG2000-Man以制备Cel-Lips。
2.2 Cel含量测定方法的建立
2.2.1 色谱条件 色谱柱为Ultimate XB-C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.05%磷酸盐缓冲液(92∶8);检测器为紫外吸收检测器,检测波长425 nm;柱温25 ℃;体积流量1 mL/min;进样量20 μL。
2.2.2 溶液的制备
(1)对照品溶液:精密称取Cel 2 mg,置10 mL量瓶中,加甲醇定容,混匀,即得质量浓度为0.2 mg/mL的对照品母液。以甲醇为溶剂稀释上述对照品母液,即得质量浓度为10、15、20、25、30、35 μg/mL的对照品溶液。
(2)供试品溶液:精密吸取Man-Cel-Lips 1 mL,加甲醇定容至10 mL,混匀并超声破乳,以0.45 μm微孔滤膜滤过2次,收集滤液,即得。
(3)阴性对照溶液:精密吸取Man-Lips 1 mL,同供试品溶液制备方法操作,即得阴性对照溶液。
2.2.3 专属性实验 分别取适量供试品溶液、对照品溶液(20 μg/mL)和阴性对照溶液,按“2.2.1”项下色谱条件分别进样测定,记录色谱图。如图1所示,Cel在9.4~9.6 min出峰,色谱峰分离度良好,主峰与杂质峰基线分离,阴性对照溶液对Cel测定无干扰,表明本方法专属性良好。
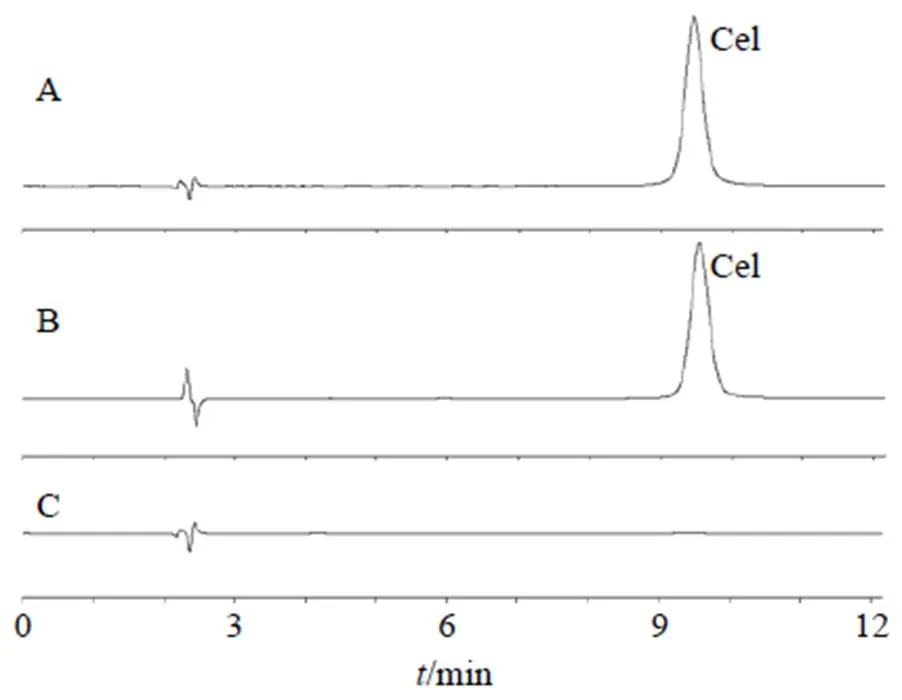
图1 Man-Cel-Lips供试品溶液(A)、Cel对照品溶液(B)和阴性对照溶液(C)的HPLC图
2.2.4 线性关系考察 取“2.2.2(1)”项下各对照品溶液适量,按“2.2.1”项色谱条件进样测定并记录。以Cel质量浓度为横坐标()、峰面积为纵坐标()绘制标准曲线,进行线性回归,得Cel回归方程=35.793-2.232,2=0.999 9,结果表明Cel在10~35 μg/mL线性关系良好。
2.2.5 重复性试验 取Man-Cel-Lips 6份,按“2.2.2(2)”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样测定。结果表明Cel平均质量浓度为20 μg/mL,RSD为0.20%,表明该方法重复性良好。
2.2.6 精密度试验 取“2.2.2”项下Cel对照品溶液,按“2.2.1”项下色谱条件连续测定6次,考察精密度。结果Cel峰面积的RSD为0.23%,表明仪器精密度良好。
2.2.7 稳定性试验 取“2.2.2”项下供试品溶液,分别于室温下放置0、2、4、8、12、24 h,取样按“2.2.1”项下色谱条件进样测定,记录色谱图。结果Cel峰面积的RSD为0.34%,表明供试品溶液在室温下放置24 h内稳定性良好。
2.2.8 加样回收率试验 精密吸取6份Man-Cel- Lips,各1 mL,分别加入Cel对照品溶液(20 μg/mL)1 mL,按“2.2.2(2)”项方法制备供试品溶液,按“2.2.1”项下色谱条件进样测定,计算加样回收率。结果Cel的平均加样回收率为101.90%,RSD为0.18%,表明该方法准确度良好。
2.3 包封率及载药量的测定
取Man-Cel-Lips 2 mL,逐滴加入Sephadex G-100凝胶柱中并以PBS洗脱,收集橘黄色乳光液体,定容至2 mL,按“2.2.2(2)”项方法处理,并按“2.2.1”项下色谱条件进样测定,代回“2.2.4”项回归方程计算Cel质量浓度,并计算其包封率和载药量。
包封率=a/b
载药量=e/m
a为过柱后含量,b为过柱前含量,e为包封于脂质体内的药量,m为载药脂质体的总质量
2.4 脂质体处方工艺的优选
根据课题组前期研究结果[15]及文献方法[16],选定胆固醇质量(1)、Cel质量(2)与超声间隔时间(3)作为考察因素,以包封率()为考察指标,固定处方量5 mL,卵磷脂用量22 mg,确定各考察因素范围,采用Box-Benhken设计-响应面法实验优选脂质体处方工艺。考察因素、实验设计与结果见表1,方差分析见表2。
将表1中包封率数据输入Design-Expert 8.0.6.1软件,得拟合方程=93.81+3.581+2.712-1.403-3.2812-0.7813-0.2023-15.4612-4.6022-2.6132(=0.976 5,<0.05)。通过显著性检验可知,拟合模型中1、2、12、12、22、32对值有显著影响(<0.05),失拟项不显著(≥0.05),各因素对包封率影响的顺序为1>2>3,即胆固醇质量>Cel质量>超声间隔时间。使用Design-Expert 8.0.6.1软件绘制各因素之间效应面图与等高线图,结果见图2。
可见,交互因素中2与3的效应面较平缓,椭圆形不明显,而1与2、1与3的等高线均呈明显椭圆形,说明后2者交互作用更为突出,1与2对值影响显著。根据课题组前期研究结果以及上述实验结果,确定最终的处方工艺为磷脂22 mg、胆固醇4 mg、Cel 1 mg、处方量5 mL、超声时间间隔5 s。按上述最优处方工艺制备3批Man-Cel-Lips,按“2.2”项下HPLC法测定Cel含量,3批脂质体的包封率分别为92.75%、92.14%、93.36%。经计算,Cel平均包封率为(92.75±0.61)%,与模型预测值(94.54%)的相对误差仅为1.93%,平均载药量为(2.99±0.02)%,可见优选处方质量稳定可行。
表1 Box-Behnken设计-响应面法实验设计方案与结果
Table 1 Experimental design scheme and results of Box-Behnken design-response surface method
序号X1/mgX2/mgX3/sY/%序号X1/mgX2/mgX3/sY/%序号X1/mgX2/mgX3/sY/% 17 (+1)1.8 (+1)5 (0)78.69711.0771.301340.27 (+1)84.86 24 (0)1.0595.34841.0594.271471.0774.81 371.03 (−1)81.75941.0594.081541.0592.16 41 (−1)0.2 (−1)562.241070.2578.051641.8788.10 540.2384.701141.0593.201711.8576.01 641.8388.731211.0375.11
表2 方差分析结果
Table 2 Analysis results of variance
来源平方和自由度方差F值P值来源平方和自由度方差F值P值 模型1 411.559156.8432.29<0.000 1X121 006.2011 006.20207.18<0.000 1 X1102.531102.5321.110.002 5X2289.24189.2418.370.003 6 X258.75158.7512.100.010 3X3228.66128.665.900.045 5 X315.74115.743.240.114 9残差34.0074.86 X1X243.10143.108.870.020 5失拟项28.2839.436.590.050 0 X1X32.4512.450.500.500 6纯误差5.7241.43 X2X30.1610.160.0320.862 8总离差1 445.5516
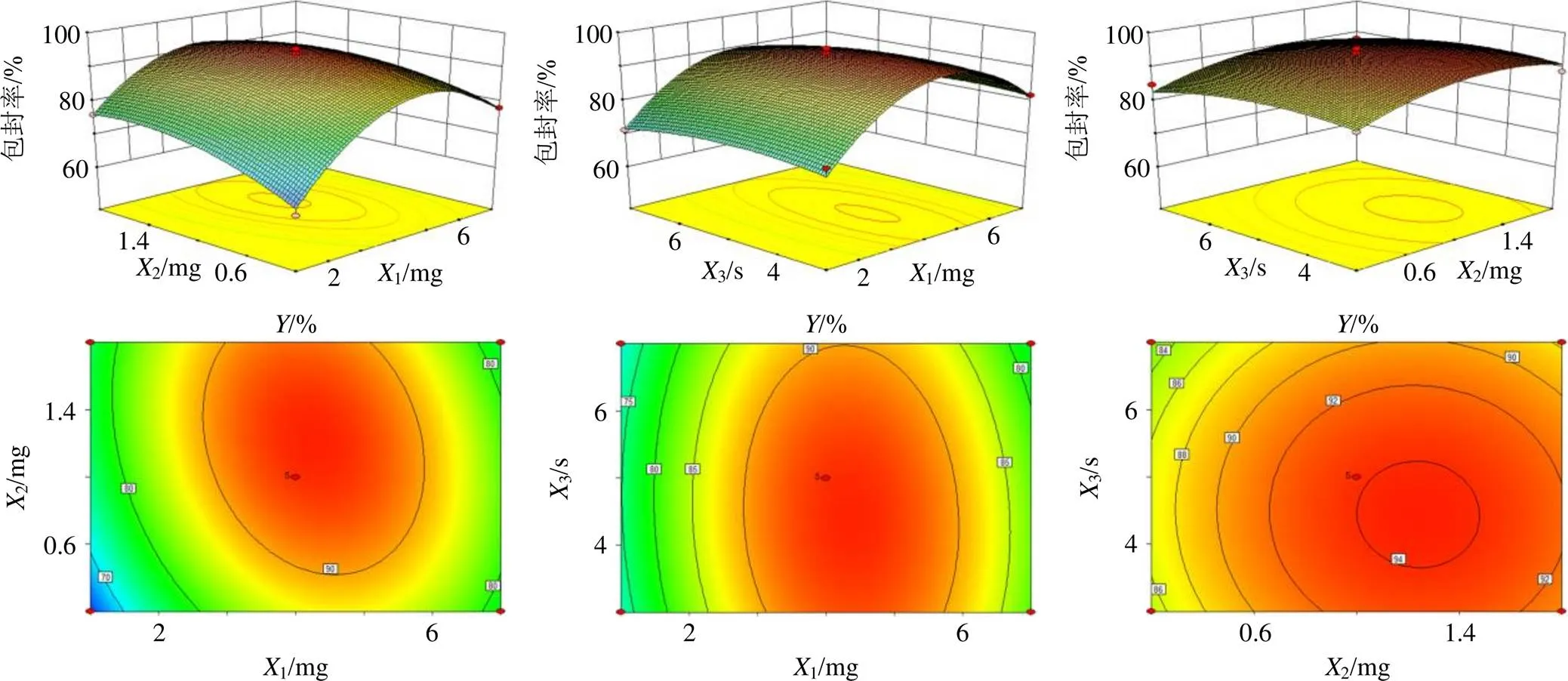
图2 各因素对Man-Cel-Lips包封率影响效应面图和等高线图
2.5 脂质体表征
吸取适量Man-Cel-Lips,滴加至专用铜网,以2%磷钨酸溶液染色,室温晾干,随后置TEM下观察其形态(加速电压120 kV)。另取Man-Cel-Lips适量,置激光散射粒径测定仪测定其粒径、多分散指数及ζ电位。结果如图3、4所示,Man-Cel-Lips呈球状或类球状,分布均匀,平均粒径为(93.50±1.04)nm(=3),多分散指数为0.22±1.81(=3),ζ电位为(−5.70±0.26)mV(=3),表明该脂质体粒径分布均匀且稳定不易絮凝。

图3 Man-Cel-Lips的TEM图

图4 Man-Cel-Lips粒径分布(A)和ζ电位 (B)
2.6 体外释放研究
取2 mL Man-Cel-Lips置透析袋(截留相对分子质量8000~14 000)中,放入15 mL PBS(pH 7.4)释放介质中,37 ℃、100 r/min低速搅拌,分别于2、4、6、8、12、24、48 h取样1 mL,并补充等量等温释放介质。取液加1 mL甲醇混匀,按“2.2.1”项色谱条件测定,计算各时间点累积释放率(=3),同时考察相同条件下游离Cel与Cel-Lips体外释放行为。结果如图5所示,游离Cel在8 h内释放速度较快,12 h后药物释放基本平稳,而Cel-Lips与Man-Cel-Lips呈缓慢释放,表明经制备成的脂质体具有缓释作用。
2.7 细胞摄取
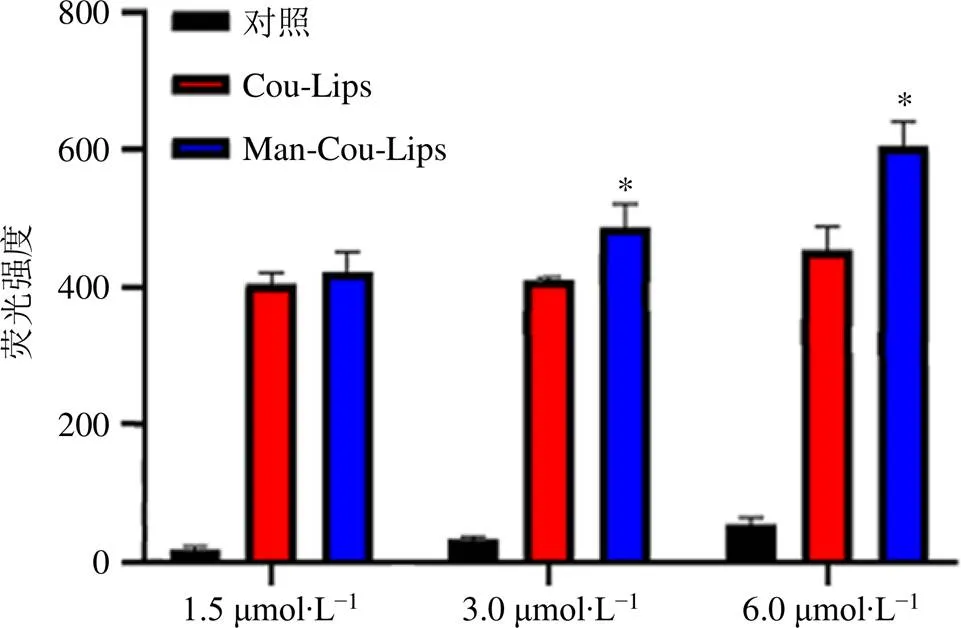
2.7.1 荧光显微镜观察脂质体摄取情况 精密称取处方量的胆固醇、卵磷脂、DSPE-PEG2000-Man、DSPE-PEG2000以及荧光探针香豆素(coumarin,Cou),按“2.1”项下方法制得Man-Cou-Lips,除不加DSPE-PEG2000-Man以制备Cou-Lips。取对数生长的RAW264.7细胞以每孔密度1×104个接种于48孔板中,于37 ℃、5% CO2条件下培养,待其贴壁后,向每孔加入2 μg/mL的脂多糖诱导12 h,随后分别加入Man-Lips(对照)、Man-Cou-Lips与Cou-Lips,给药组浓度分别为1.5、3.0、6.0 μmol/L。2 h后弃培养基,以PBS冲洗3次,4%多聚甲醛固定15 min,弃固定液用PBS洗板2次,每孔加DAPI染液避光染色15 min,弃染液用PBS洗板2次,在荧光显微镜下观察并记录各组成像。结果如图6所示,对照组未见绿色荧光,Man-Cou- Lips组细胞内荧光明显。
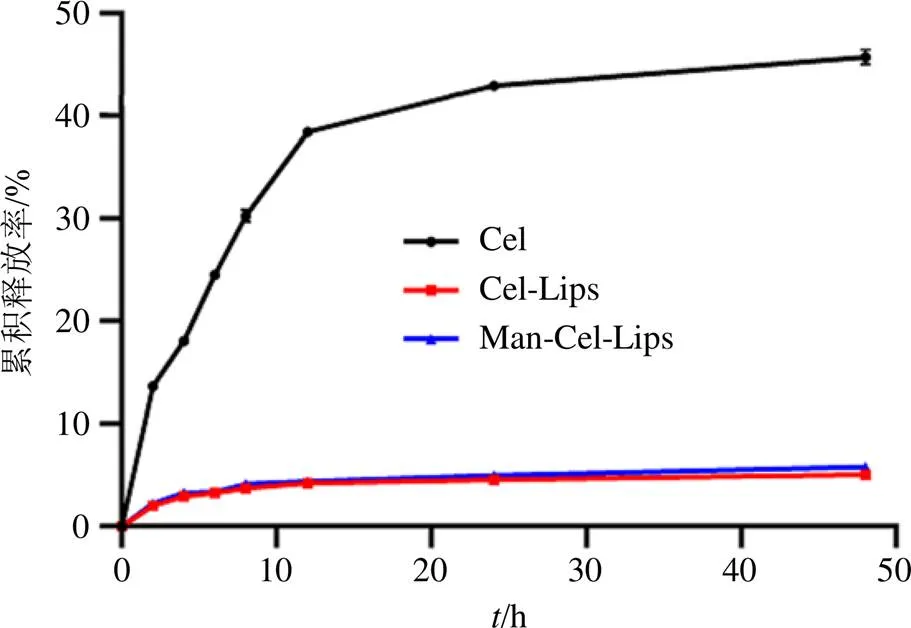
图5 Man-Cel-Lips释放曲线
使用Image J软件对图片进行荧光强度统计分析,相邻组间比较采用检验分析。结果如图7所示,与Cou-Lips相比,Man-Cou-Lips 3.0、6.0 μmol/L组荧光强度增强(<0.05),表明脂质体经过甘露糖修饰可增强其对RAW264.7细胞的靶向性,且荧光强度随剂量增加逐渐增强。
2.7.2 流式细胞仪检测脂质体摄取情况 取对数生长的RAW264.7细胞以每孔密度3×105个接种于6孔板中,同“2.7.1”项操作处理。给药2 h后弃培养基,加入新鲜培养基,并用移液枪轻吹使细胞脱落,离心收集细胞,以PBS洗1次,再加适量PBS复悬并移至流式管,用流式细胞仪检测并记录,相邻组间比采用检验分析。
结果如图8、9所示,Man-Cou-Lips 3.0、6.0 μmol/L组细胞的荧光强度显著高于其他组(<0.05),且荧光强度随剂量增加而逐渐增强,与荧光显微镜观察结果一致。

A~C分别为1.5、3.0、6.0 μmol∙L−1药物对应的荧光强度图
3 讨论
RA是最严重的自身免疫性疾病之一,风湿性关节炎在全球的患病率为1%,女性的发病率是男性的2~3倍[17],被称为“不死的癌症”。目前常用于治疗RA的药物主要有非甾体类抗炎药、糖皮质激素药及其他化学合成类抗风湿药等,这几类药物虽能有效缓解炎症引起的临床症状和体征,但无法根治疾病,且体内特异性低,毒副作用较为明显[18]。传统中药具有多成分、多靶点协同且不良反应小等优势,目前成为研发抗RA新药热点之一[19-21]。作为一种新型给药系统,脂质体具有包封亲脂性药物和亲水性药物的能力,因其生物相容性、生物可降解性、无毒和免疫原性而具有多种优势[22-23]。

与Cou-Lips组比较:*P<0.05
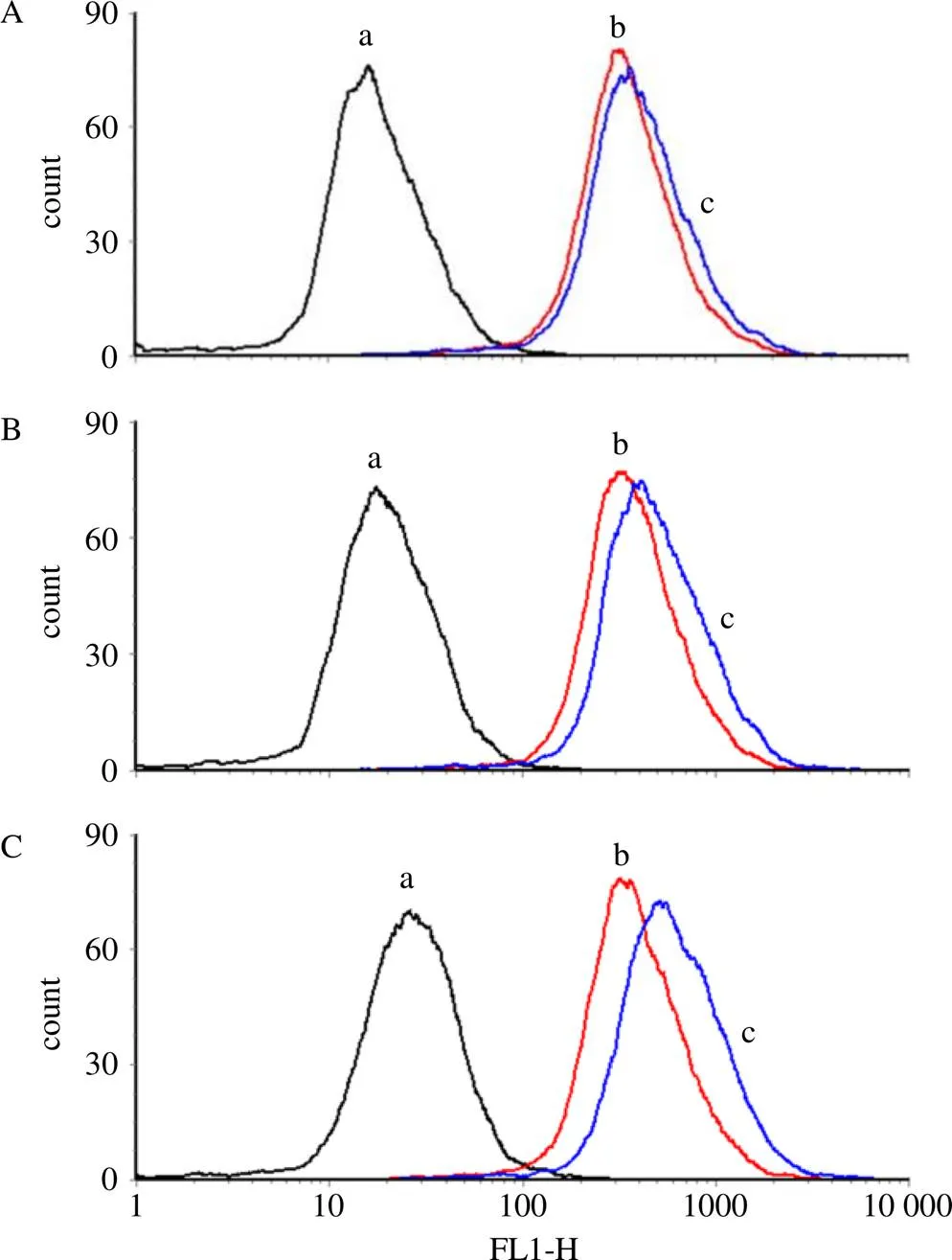
a-对照组 b-Cou-Lips组 c-Man-Cou-Lips组 A~C分别为1.5、3.0、6.0 μmol∙L−1药物对应的荧光强度图
与Cou-Lips组比较:*P<0.05
当机体产生炎症反应时,会激活大量巨噬细胞,已有学者研究发现,Cel可通过调节核因子-κB和Notch1通路抑制巨噬细胞复极化,减少多种促炎细胞因子分泌来治疗RA,并且甘露糖受体(MR)在活化的巨噬细胞表面高表达[24-25]。使用纳米技术作为载体将Cel送达体内后,可使Cel治疗RA的功效最大化且降低其全身不良反应[26]。本研究将中药天然产物与靶向分子结合,采用薄膜分散法构建Man-Cel-Lips,制备工艺简单可行。
Box-Behnken设计-响应面法是一种多因素之间关系考察的设计方法,其特点是建立因素与响应值之间数学预测模型,确定各因素及其相互作用对响应值的影响,从而选择最佳工艺参数,准确度高、验证次数少、效率高[27-29],因而本研究采用该方法优化Man-Cel-Lips处方。按上述最优处方制备的脂质体,包封率较高,稳定性较好,具有一定缓释作用,且加入DSPE-PEG2000有助于脂质体躲避网状内皮系统的清除,符合《中国药典》2020年版四部的要求[30]。
Cel本身不具有荧光特性,课题组选用具有荧光活性的香豆素作为荧光探针,采用脂多糖诱导RAW264.7细胞模拟关节炎细胞环境,结合荧光显微镜和流式细胞仪结果对不同脂质体进行定性定量比较。结果表明,经甘露糖修饰的脂质体组荧光强度显著增强,且荧光强度随剂量增加而逐渐增强,说明甘露糖与活化巨噬细胞表面MR特异性结合,经甘露糖修饰可增加载药脂质体在炎症细胞内的分布,提高药物的靶向性,增强炎症细胞对药物的摄取能力,使脂质体发挥更好的抗炎效果,且荧光显微镜和流式细胞仪结果一致。
综上所述,本研究成功制备Man-Cel-Lips,筛选其最优处方,同时测定脂质体中药物含量,并通过体外摄取实验考察靶向性,为后续深入研究Man-Cel-Lips抗炎机制提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Scherer H U, Häupl T, Burmester G R. The etiology of rheumatoid arthritis [J]., 2020, 110: 102400.
[2] Wang Q, Qin X Y, Fang J Y,. Nanomedicines for the treatment of rheumatoid arthritis: State of art and potential therapeutic strategies [J]., 2021, 11(5): 1158-1174.
[3] 白雪, 付瑞嘉, 乐世俊, 等. 雷公藤治疗类风湿性关节炎研究进展 [J]. 中草药, 2020, 51(1): 265-275.
[4] Hou W, Liu B, Xu H T. Celastrol: Progresses in structure- modifications, structure-activity relationships, pharmacology and toxicology [J]., 2020, 189: 112081.
[5] Lan G C, Zhang J, Ye W B,. Celastrol as a tool forthe study of the biological events of metabolic diseases [J]., 2019, 62(4): 409-416.
[6] Ng S W, Chan Y H, Chellappan D K,. Molecular modulators of celastrol as the keystones for its diverse pharmacological activities [J]., 2019, 109: 1785-1792.
[7] 徐资怡, 石金凤, 鲜静, 等. 雷公藤红素单用和联用抗肿瘤作用机制的研究进展 [J]. 中草药, 2021, 52(14): 4372-4385.
[8] 景铭, 王美灵, 张媛媛, 等. 雷公藤红素调控NLRP3炎症小体改善大鼠代谢相关脂肪性肝病研究[J]. 药物评价研究, 2022, 45(4): 624-632.
[9] Venkatesha S H, Yu H, Rajaiah R,.-derived celastrol suppresses autoimmune arthritis by modulating antigen-induced cellular and humoral effector responses [J]., 2011, 286(17): 15138-15146.
[10] 梁柳春, 杨亚玺, 郭夫江. 雷公藤红素药理作用及结构修饰研究进展 [J]. 中国药物化学杂志, 2020, 30(10): 622-635.
[11] 杨明. 中药药剂学 [M]. 第4版. 北京: 中国中医药出版社, 2021: 415-417.
[12] 宋婷婷, 蔡荣珊, 王宏, 等. TPGS修饰的地榆皂苷I长循环脂质体的制备及质量评价 [J]. 中草药, 2021, 52(12): 3522-3529.
[13] 滕碧蔚. 甘露糖的制备及其功能性保健作用 [J]. 轻工科技, 2014, 30(7): 67-68.
[14] Nielsen M C, Hvidbjerg Gantzel R, Clària J,. Macrophage activation markers, CD163 and CD206, in acute-on-chronic liver failure [J]., 2020, 9(5): 1175.
[15] Zhang L, Kong L, He S Y,. The anti-ovarian cancer effect of RPV modified paclitaxel plus schisandra B liposomes in SK-OV-3 cells and tumor-bearing mice [J]., 2021, 285: 120013.
[16] 韩德恩, 辛玉凤, 位恒超, 等. Box-Behnken效应面法优化大黄素纳米结构脂质载体处方工艺及体外质量评价 [J]. 中国中药杂志, 2022, 47(4): 913-921.
[17] Thakur S, Riyaz B, Patil A,. Novel drug delivery systems for NSAIDs in management of rheumatoid arthritis: An overview [J]., 2018, 106: 1011-1023.
[18] 王静, 赵庆杰, 卓小斌, 等. 类风湿性关节炎的治疗药物研究进展 [J]. 药学实践杂志, 2019, 37(6): 485-490.
[19] 杨丽, 刘荣华, 黄四碧, 等. 类风湿性关节炎的发病机制及治疗药物研究进展 [J]. 中国药房, 2021, 32(17): 2154-2159.
[20] Jing R, Ban Y F, Xu W H,. Therapeutic effects of the total lignans fromseeds on collagen- induced arthritis in rats [J]., 2019, 58: 152825.
[21] Baig S, DiRenzo D D. Complementary and alternative medicine use in rheumatoid arthritis [J]., 2020, 22(10): 61.
[22] Sheoran R, Khokra S L, Chawla V,. Recent patents, formulation techniques, classification and characterization of liposomes [J]., 2019, 13(1): 17-27.
[23] 杨一帆, 梁艺瑶, 刘保保, 等. 转铁蛋白修饰雷公藤甲素脂质体的制备与体外评价 [J]. 中草药, 2022, 53(3): 687-695.
[24] An L M, Li Z R, Shi L Q,. Inflammation-targeted celastrol nanodrug attenuates collagen-induced arthritis through NF-κB and Notch1 pathways [J]., 2020, 20(10): 7728-7736.
[25] 严丽丽, 谢勇, 闵卫平. 甘露糖化壳聚糖纳米粒靶向巨噬细胞的应用研究进展 [J]. 中国免疫学杂志, 2021, 37(21): 2575-2579.
[26] 刘梦亚, 赵向峰. 雷公藤红素治疗类风湿关节炎的研究进展 [J]. 风湿病与关节炎, 2020, 9(1): 72-75.
[27] 张小荣, 耿广琴, 赵沙沙, 等. Box-Behnken响应面法优化红芪多糖水提醇沉工艺研究 [J]. 中兽医医药杂志, 2022, 41(2): 7-14.
[28] 韩德恩, 申延利, 田萍, 等. Box-Behnken响应面法优化白藜芦醇Labrasol/P407混合胶束处方工艺及体外评价[J]. 中草药, 2021, 52(11): 3209-3215.
[29] Goo Y T, Sa C K, Choi J Y,. Development of a solid supersaturable micelle of revaprazan for improved dissolution and oral bioavailability using Box-Behnken design [J]., 2021, 16: 1245-1259.
[30] 中国药典[S]. 四部. 2020: 474-476.
Optimization of mannose-modified celastrol liposome formulation and targeting evaluation
SI Jia-qi1, LIU Yang1, CAI Jia-yu1, LIU Wan-ying1, LI Feng-rui1, KONG Liang1, 2, LI Xue-tao1
1. School of Pharmacy, Liaoning University of Traditional Chinese Medicine, Dalian 116600, China 2. Key Laboratory of TCM Viscera-State Theory and Applications, Ministry of Education, Liaoning University of Traditional Chinese Medicine, Shenyang 110847, China
To optimize the prepared prescription of Mannose celastrol liposomes (Man-Cel-Lips) and preliminarily evaluate itstargeting.Man-Cel-Lips was prepared by thin-film dispersion method. Box-Behnken design-response surface methodology was used to optimize the dosage of cholesterol, the dosage of Cel and the ultrasonic time interval using encapsulation efficiency as index. Three batches of liposomes were prepared according to the optimal formula, and the liposomes were characterized and their releasewas investigated. The uptake and targeting effects of MAN on lipopolysaccharide induced RAW264.7 cells were investigated by flow cytometry and fluorescence microscopy using coumarin as fluorescence probe.Box-Behnken design-response surface method was used to determine the optimal prescription process: 4 mg cholesterol, 1 mg Cel, 22 mg phospholipid, 5 s ultrasonic interval and 5 mL total prescription. The average particle size, polydispersion index, ζ potential and encapsulation efficiency of the three batches of liposomes were (93.50 ± 1.04) nm, 0.22 ± 1.81, (−5.70 ± 0.26) mV and (92.75 ± 0.61)% respectively. Compared with free Cel, MAN-Cel-lips had a certain sustained release effect.cell uptake experiment results showed that the uptake efficiency of Man-Cel- Lips was higher than that of other groups (< 0.05), and increased with the increase of dose (< 0.05).Man-Cel-Lips were successfully prepared and optimized, and the targeting activity of Man-Cel-Lips was enhanced, which laid a foundation for the follow-up study of its anti-inflammatory activity.
celastrol; mannose; prescription optimization; macrophage; targeting; liposomes; membrane dispersion method; Box- Behnken design-response surface method; anti-inflammation
R283.6
A
0253 - 2670(2022)21 - 6726 - 08
10.7501/j.issn.0253-2670.2022.21.009
2022-05-18
中国医药教育学会“2020年重大科学攻关问题和医药技术难题”项目(2020KTS004);辽宁中医药大学中医脏象理论及应用教育部重点实验室开放基金(zyzx2102)
司佳奇(1998—),女,硕士研究生,研究方向为新型给药系统。Tel: (0411)85890145 E-mail: 2667544783@qq.com
李学涛(1979—),男,教授,博士生导师,研究方向为新型给药系统。Tel: (0411)85890145 E-mail: lixuetao1979@163.com
[责任编辑 郑礼胜]
