35岁及以下患者子宫内膜息肉摘除术后复发因素分析
2022-11-04林凯璇郭红玉
林凯璇,郭红玉,张 秦
0 引 言
子宫内膜息肉(endometrial polyps,EPs)是女性常见的妇科疾病,表现为局部内膜组织(包含内膜腺体、间质和血管)过度增殖,形成有蒂或无蒂的宫腔赘生物。EPs主要临床表现为阴道不规则出血、不孕症等,严重影响患者的生活质量及生命健康[1-2]。流行病学数据显示,EPs患病率为7.8%~34.9%,育龄期至绝经后女性,均为EPs高发人群,是危害女性健康的重要疾病[3]。随着现代人晚婚晚育、健康意识增加和超声水平的提高,EPs的检出率逐渐升高,引起了临床高度关注[4]。宫腔镜手术为治疗EPs有效方式,损伤性小、术中操作简单、息肉切除效果佳为其优点,亦逐渐成为EPs治疗的首选术式[5-6]。但患者在术后依旧有复发可能性,且一旦复发,需再次进行手术治疗,对患者身心健康、生活质量均存在一定负面影响;且术后复发患者生育能力亦受到影响,临床需提高对EPs术后复发的重视[7-8]。随着生育政策的放开及现代生活模式的改变,平均生育年龄普遍推迟,35岁及以下的女性成为生育主力军[9]。本研究通过回顾性分析年龄在35岁及以下行宫腔镜下子宫内膜息肉摘除术治疗的患者一般资料,探讨育龄期EPs复发的相关因素,以期为该年龄段EPs患者提供个性化治疗及术后随访干预依据。
1 资料与方法
1.1 一般资料回顾性分析2016年1月至2017年12月江苏省中医院妇科收治的117例经病理证实的≤35岁EPs患者临床资料。纳入标准:①年龄≤35岁;②严格符合EPs手术指征;③我院进行子宫内膜息肉切除术(trans-cervical resection of polyps,TCRP),术后病理诊断明确;④除外子宫恶性肿瘤。排除标准:①术后失访;②术后无法判断是否有残留及复发;③合并恶性肿瘤。根据纳入和排除标准,最终入选病例共113例,依据患者术后是否复发分为复发组(n=20)及未复发组(n=93)。其中复发组年龄28~35岁,平均(33.24±1.51)岁;未复发组年龄29~35岁,平均(33.60±1.71)岁。2组患者年龄比较差异无统计学意义(P>0.05)。
1.2复发标准术后3个月经周期以上新发现的宫腔占位,经超声、CT、MRI或手术证实,且术后至EPs复发之前至少1次影像学评估为阴性,否则为残留[10]。
1.3研究方法记录患者病历资料,包括初潮年龄、临床症状(是否有月经间期出血、经期延长、月经量过多、不孕、白带增多等症状)、孕次、产次、流产史、术前治疗、息肉大小、息肉类型、合并妇科良性疾病(合并盆腔炎、合并子宫肌瘤、合并多囊卵巢综合征)、术后避孕药治疗。
1.4随访通过复查或电话随访,记录患者术后一般情况,相关症状,受孕情况以及息肉残留或复发时间。随访期为手术结束后至少24个月,所有患者随访至2020年12月。
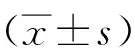
2 结 果
2.1 影响EPs患者术后复发的单因素分析本组113例患者中, 20例患者出现术后复发,复发率为17.7%。2组患者初潮年龄、临床症状、孕次、产次、流产史、术前治疗、息肉大小、合并盆腔粘连、合并子宫肌瘤、合并子宫内膜异位症比较差异无统计学意义(P>0.05);两组息肉类型与术后孕激素治疗比较,差异有统计学意义(P<0.05)。见表1。

表 1 影响 EPs患者术后复发的单因素分析
2.2影响 EPs术后复发的多因素分析将以上单因素按照表2进行赋值,并行logistic回归分析发现,息肉多发与术后未使用孕激素治疗是影响 EPs术后复发的独立危险因素,见表2、表3。

表 2 Logistic回归赋值方法
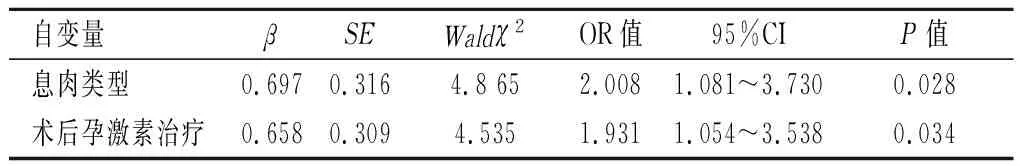
表 3 影响 EPs术后复发的多因素分析
2.3预测模型构建ROC曲线分析发现,联合息肉类型与术后孕激素治疗的预测模型对于EPs患者术后复发中的预测敏感度为85.46%、特异度为76.39%,AUC为0.731,见表4。
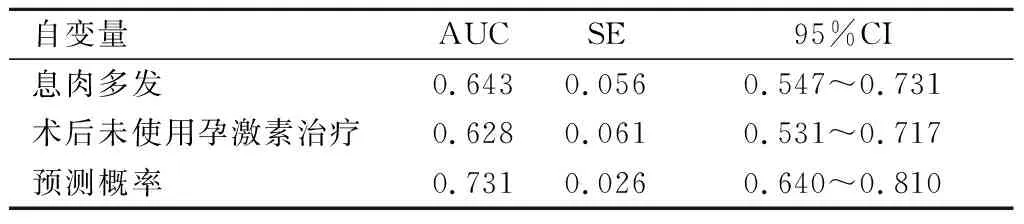
表 4 不同预测模型效能比较
3 讨 论
子宫内膜的正常生长发育周期与雌孕激素密切相关。雌、孕激素及其受体失衡可导致EPs的发生[11]。绝大多数Eps是良性病变,且有25%的息肉可自发消退,尤其<10mm的息肉消退率更高。因此,无症状的小息肉患者是可以通过定期复查随访的[12]。更多的患者因出现阴道不规则出血或不孕症就诊而发现EPs。大多数有症状的Eps表现为异常子宫出血(abnormal uterus bleeding, AUB),即AUB-P,在高达40%的绝经前出血的女性中发现了Eps存在[13]。除此之外,不育女性中,EPs的患病率似乎有所增加:在一项包括1000名计划进行体外受精的不孕症女性的大型前瞻性试验中,发现EPs的患病率为32%[14]。不孕妇女EPs的高患病率表明EPs的存在与不孕之间存在因果关系。因此,临床逐渐提高对EPs的关注度[15]。EPs单纯的药物疗效并不理想。随着微创技术的发展,TCRP成了治疗的首选。尤其对于年轻且具有生育要求的女性而言,宫腔镜直视下切除病灶,除了能有效改善出血症状,不产生宫腔黏连,而且可有效恢复生殖能力,然而,由于EPs的生物特性,术后复发并不少见[16]。
关于EPs复发,本研究中,多发性EPs是复发的独立危险因素,分析可能是因为EPs宫腔周围过度生长,高数量的EPs构成一个明显的高风险亚群,增加术后复发风险。因此在临床治疗中,应充分告知多发EPs患者,术后复发频率,并指导有受孕需求的女性在术后尽快怀孕,无怀孕需求者,在术后则需口服含孕激素的避孕药或含孕激素的宫内节育器进行预防性治疗[17]。以往研究提出,合并妇科疾病,多会加重对患者子宫内膜的炎症损伤,导致机体内激素水平紊乱,进一步增加EPs复发风险[18-19];但本研究中尚未发现合并其他妇科疾病对EPs术后复发的影响,可能与研究样本量较少有关,因此后续应扩大研究样本量进行验证。现在基本认为,很多子宫良性疾病包括EPs、子宫平滑肌瘤和子宫腺肌病的发生跟激素水平失衡有关。EPs的发病机理和确切病因其实尚不明确,但现在较为认可其发生跟激素有关。研究发现,EPs中雌激素受体表达增加,而孕激素受体表达下降[20]。由于雌激素和孕激素是维持正常子宫内膜增殖与凋亡平衡的重要调节因子,使用具有高抗雌激素活性的孕激素以及口服避孕药可能对EPs的发展具有保护作用,因此在临床运用中,常用孕激素和避孕药来治疗EPs[21]。研究证明,宫腔镜后孕激素疗法治疗EPs具有良好的临床效果,可有效预防复发,降低血红蛋白水平,减少子宫内膜厚度,可能是因为孕激素可在一定程度上诱导雌激素作用增殖的子宫内膜转化为分泌期,并调节下丘脑-垂体-卵巢轴反馈机制,抑制子宫内膜生长,并促进子宫内膜修复,进一步改善月经、减少息肉复发[22]。对于短时间内没有生育要求的女性,选择放置左炔诺孕酮宫内节育系统进行内膜保护,是用来预防EPs复发的治疗手段[23]。另外本研究中还发现术后未使用孕激素治疗是影响35岁及以下 EPs术后复发的独立危险因素,提示临床针对无生育需求者,可选择选择孕激素、避孕药或左炔诺孕酮宫内节育系统降低EPs术后复发风险;而对于有生育需求的妇女应给予合理激素治疗方案,降低术后复发。本研究中将息肉多发、术后未使用孕激素治疗代入logistic预测模型中发现,上述因素在EPs患者术后复发中的预测效能较佳,提示临床可对以上因素进行监测,并为EPs患者术后复发进行风险预测,为临床降低术后复发风险提供客观依据。
综上所述,多发性EPs可能是≤35岁EPs术后复发的独立危险因素。对于有生育要求的患者,应建议其尽早完成生育。如短时间内无生育要求,TCRP术后应该选择孕激素、含孕激素避孕药、左炔诺孕酮宫内节育系统预防复发。针对合并妇科疾病者,需及早进行治疗干预,可降低术后复发风险。未来仍需扩大样本量、延长随诊时间、进行前瞻的队列研究等,以进一步明确影响≤35岁EPs患者TCRP术后复发的相关因素,从而更好地评估复发风险,指导患者生育时机及治疗方式选择。
