橙皮苷调控Jagged1/Notch1通路对巨噬细胞极化及细支气管炎小鼠肺损伤的影响
2022-11-03赵兴艳汤正珍谭宗苹
赵兴艳,汤正珍,岳 春,谭宗苹,黄 波
遵义医科大学第三附属医院 遵义市第一人民医院儿科,贵州遵义 563000
细支气管炎是一种常见且较严重的小儿急性下呼吸道感染性疾病,呼吸道合胞病毒(respiratory syncytial virus,RSV)是其主要病原体,该疾病的特点是气道炎症、黏液分泌增多,有时还会出现气道上皮细胞坏死[1]。据估计,有RSV细支气管炎病史的个体患哮喘的风险要高2~12倍[2]。肺泡巨噬细胞在RSV感染引起的肺损伤疾病进展中起到关键作用[3]。有研究显示,细支气管炎患儿血清巨噬细胞炎性蛋白1α、单核细胞趋化蛋白1和白细胞介素(interleukin,IL)4水平升高,且与疾病的严重程度密切相关[4-5]。RSV感染呼吸道上皮细胞可引起细胞因子和趋化因子如单核细胞趋化蛋白1、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和IL-1β水平的上调以及炎症细胞聚集到肺部,而巨噬细胞向M2亚型极化会减轻Th2炎症反应[6],其机制可能与激活Jagged1/Notch1通路促进气道微环境中Th2淋巴细胞的分化有关[7]。Notch信号通路是介导巨噬细胞极化的关键通路,激活Notch信号通路促进巨噬细胞向M1型极化,并阻碍其向M2型极化[8]。Zeng等[9]研究显示抑制Notch信号通路可明显改善气道炎症。橙皮苷是一种具有广泛生物学活性的天然酚类化合物[10-12]。研究表明,橙皮苷作为潜在的Th2细胞因子拮抗剂,具有抗哮喘作用,可降低炎症细胞和Th2细胞因子的数量,抑制卵清蛋白诱导的气道炎症[13-14]。然而,橙皮苷对RSV引起的细支气管炎是否具有保护作用尚不清楚。因此,本研究通过构建RSV细支气管炎小鼠模型,探究橙皮苷对细支气管炎小鼠肺损伤的影响及可能的作用机制。
材料和方法
主要试剂与仪器橙皮苷(纯度>95%,货号:C-006)购自成都瑞芬思生物科技有限公司;RSV购自山东省医药生物技术研究中心;人宫颈癌HeLa细胞购自武汉普诺赛生命科技有限公司;重组小鼠Jagged1蛋白(货号:ab109346)购自英国Abcam公司;BCA试剂盒(货号:P0012S)购自上海碧云天生物技术有限公司;小鼠IL-6(货号:ml002293)、TNF-α(货号:ml002095)、IL-10(货号:ml002285)、IL-4(货号:ml063156)ELISA试剂盒均购自上海酶联生物科技有限公司;兔抗CD11b-FITC抗体(货号:561688)、F4/80-PerCP-Cy5.5抗体(货号:567202)、CD86-PE抗体(货号:561963)均购自美国BD Bioscience公司;CD206-APC抗体(货号:PA5-46879)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体(货号:PA3-030A)、精氨酸酶1(arginase-1,Arg-1)抗体(货号:PA5-85267)、Jagged1抗体(货号:PA5-86057)、Notch1抗体(货号:MA5-32080)、GAPDH抗体(货号:PA1-16777)、山羊抗兔IgG(H+L)抗体(货号:A32734)均购自美国Thermo Scientific公司。FACSCanto Ⅱ流式细胞仪购自美国BD公司;BX61电动显微镜购自日本Olympus公司。
RSV混悬液的制备将RSV冻存液于37 ℃快速融化,按照0.05病毒感染复数计算病毒接种量,接种于Hela细胞上,收集感染病毒的细胞,在-80 ℃冰箱中反复冻融3次,然后在4 ℃下以1000 r/min(r=13.5 cm)的速率离心10 min,取上清液,空斑法测定病毒滴度,并调整病毒滴度为1×106PFU/ml,置于-80 ℃冰箱中保存备用。
实验动物与分组6~8周龄SPF级BALB/c雄性小鼠60只(体重18~22 g)购自济南朋悦实验动物繁殖有限公司,合格证号为SCXK(鲁)2019 0003。在标准条件下进行喂养,保持12 h光照/12 h黑暗循环,温度(25±2) ℃,湿度50%~70%,自由进食和饮水。参照文献[15]方法制备细支气管炎小鼠模型:于小鼠两侧鼻内滴入100 μl RSV混悬液,对照组于相同部位滴入100 μl Hela细胞培养液,1 次/d,连滴2 d,第3天观察到滴入RSV混悬液的小鼠出现咳喘、呼吸急促、活动减少,且口唇和四肢发绀的现象,说明模型制备成功。采用随机数字表法将60只BALB/c小鼠分为对照组、模型组、低剂量橙皮苷组(18 mg/kg)、高剂量橙皮苷组(36 mg/kg)[16]、高剂量橙皮苷(36 mg/kg)+Jagged1(1 mg/kg)组[17],每组12只。低、高剂量橙皮苷组小鼠分别灌胃18、36 mg/kg橙皮苷,高剂量橙皮苷+Jagged1组小鼠在灌胃36 mg/kg橙皮苷的同时腹腔注射1 mg/kg Jagged1,对照组与模型组小鼠灌胃等量生理盐水,1次/d,连续给药7 d。
肺泡巨噬细胞分离小鼠使用10%水合氯醛麻醉,暴露气管并在中间切开,通过气管插管用0.8 ml无菌PBS灌洗肺3次,并收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF),每只小鼠约1.5 ml。以1500 r/min(r=13.5 cm)转速离心10 min,取上清液于-20 ℃保存,同时将沉淀的细胞用含10%胎牛血清和1%双抗(100 U/ml青霉素和100 μg/ml链霉素)的DMEM/F12培养基重悬,置于37 ℃、5% CO2饱和湿度的培养箱中培养。
ELISA检测BALF中炎症相关因子水平取-20 ℃保存的各组小鼠BALF上清液,按照ELISA试剂盒说明书检测IL-6、IL-10、IL-4、TNF-α的表达水平。
流式细胞术检测巨噬细胞M1/M2型极化取原代小鼠肺泡巨噬细胞调整浓度为1×107个/ml细胞悬液,4%多聚甲醛固定15 min。分别加入兔抗CD11b-FITC抗体(10 μl)、F4/80-PerCP-Cy5.5抗体(10 μl)、CD86-PE抗体(10 μl)和CD206-APC抗体(10 μl)4 ℃避光孵育10 min。采用流式细胞仪检测M1和M2型巨噬细胞的比例。M1型巨噬细胞为F4/80、CD11b、CD86表达阳性,而CD206呈阴性表达;M2型巨噬细胞为F4/80、CD11b、CD206表达阳性,而CD86呈阴性表达。
HE染色与过碘酸希夫染色小鼠处死后取出肺组织,4%多聚甲醛固定24 h后石蜡包埋、切片,常规HE染色,评估气道周围炎症细胞的浸润情况。采用5级评分标准:0分:无炎症;1分:少量炎症细胞浸润;2分:炎症细胞形成环状,1个细胞层深,肺泡壁轻度增厚;3分:炎症细胞形成环状,2~4个细胞层深,肺泡壁显著增厚;4分:炎症细胞形成环状,超过4个细胞层深,肺泡壁显著增厚。采用过碘酸希夫(periodic acid-Schiff,PAS)染色评估杯状细胞分泌黏液的情况。评分标准:0分:阴性或染色面积<5%;1分:染色面积5%~25%;2分:染色面积26%~50%;3分:染色面积51%~75%;4分:染色面积>75%。
qRT-PCR检测肺组织iNOS、Arg-1、Jagged1和Notch1 mRNA的表达qRT-PCR测定肺组织iNOS、Arg-1、Jagged1、Notch1 mRNA的表达,引物序列见表1。采用Trizol法提取肺组织总RNA,使用逆转录试剂盒将RNA反转录为cDNA,进行PCR扩增,以GAPDH为内参进行相对定量。反应条件:95 ℃预变性10 min,1个循环;95 ℃ 10 s、60 ℃ 20 s、72 ℃ 34 s,40个循环。采用2-ΔΔCt法计算相对定量值。ΔΔCt=ΔCt(实验组)-ΔCt(对照组),其中ΔCt=目的基因Ct-内参基因Ct。

表1 qRT-PCR引物序列Table 1 Primer sequences for qRT-PCR
Western blot检测肺组织iNOS、Arg-1和Jagged1/Notch1通路相关蛋白的表达使用含有1%蛋白酶抑制剂的RIPA裂解液制备肺组织裂解物,提取总蛋白,BCA法测定蛋白浓度。在10% SDS-PAGE上分离等量蛋白质(30 μg/孔),转膜,分别加入一抗iNOS(1∶1000)、Arg-1(1∶1000)、Jagged1(1∶500)、Notch1(1∶500)、GAPDH(1∶2000)4 ℃孵育过夜,洗涤后再加入辣根过氧化物酶标记的山羊抗兔IgG(1∶4000),室温孵育1 h,采用ECL化学发光法显色,利用Image J软件分析蛋白条带灰度值。以GAPDH为内参,计算目的条带的相对表达水平。
统计学处理采用SPSS 22.0统计软件,符合正态分布的计量资料以均值±标准差表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
结 果
BALF中IL-6、TNF-α、IL-4、IL-10的表达水平与对照组相比,模型组小鼠BALF中IL-4[(3.65±0.29)pg/ml比(0.87±0.13)pg/ml;q=38.234,P<0.001]、IL-6[(54.07±3.72)pg/ml比(11.36±2.04)pg/ml;q=48.280,P<0.001]、TNF-α[(46.95±4.21)pg/ml比(10.42±1.55)pg/ml;q=40.261,P<0.001]水平显著升高,IL-10水平显著降低[(1.37±0.21)pg/ml比(2.56±0.30)pg/ml;q=17.049,P<0.001];与模型组相比,低、高剂量橙皮苷组小鼠BALF中IL-4[(2.77±0.31)pg/ml比(3.65±0.29)pg/ml;q=12.103,P<0.001和(1.86±0.24)pg/ml比(3.65±0.29)pg/ml;q=24.619,P<0.001]、IL-6[(38.53±3.29)pg/ml比(54.07±3.72)pg/ml;q=17.567,P<0.001和(23.61±2.55)pg/ml比(54.07±3.72)pg/ml;q=34.432,P<0.001]、TNF-α[(34.08±3.36)pg/ml比(46.95±4.21)pg/ml;q=14.185,P<0.001和(21.63±2.52)pg/ml比(46.95±4.21)pg/ml;q=27.906,P<0.001]水平显著降低,IL-10水平显著升高[(2.04±0.23)pg/ml比(1.37±0.21)pg/ml;q=9.599,P<0.001和(2.52±0.27)pg/ml比(1.37±0.21)pg/ml;q=16.476,P<0.001];与高剂量橙皮苷组相比,高剂量橙皮苷+Jagged1组小鼠BALF中IL-4[(2.54±0.25)pg/ml比(1.86±0.24)pg/ml;q=9.352,P<0.001]、IL-6[(35.98±3.41)pg/ml比(23.61±2.55)pg/ml;q=13.983,P<0.001]、TNF-α[(32.21±3.41)pg/ml比(21.63±2.52)pg/ml;q=11.661,P<0.001]水平显著升高,IL-10水平显著降低[(1.91±0.1)pg/ml比(2.52±0.27)pg/ml;q=8.740,P<0.001]。
M1/M2型巨噬细胞比例与对照组相比,模型组小鼠M1型巨噬细胞比例显著升高[(31.00±2.46)%比(0.52±0.07)%;q=51.061,P<0.001],M2型巨噬细胞比例显著降低[(5.12±0.70)%比(14.95±1.62)%;q=22.699,P<0.001];与模型组相比,低、高剂量橙皮苷组小鼠M1型巨噬细胞比例显著降低[(20.24±2.15)%比(31.00±2.46)%;q=18.025,P<0.001和(11.61±1.89)%比(31.00±2.46)%;q=32.483,P<0.001],M2型巨噬细胞比例显著升高[(12.56±1.37)%比(5.12±0.70)%;q=17.180,P<0.001和(20.80±2.15)%比(5.12±0.70)%;q=36.208,P<0.001];与高剂量橙皮苷组相比,高剂量橙皮苷+Jagged1组小鼠M1型巨噬细胞比例显著升高[(18.53±2.67)%比(11.61±1.89)%;q=11.593,P<0.001],M2型巨噬细胞比例显著降低[(11.42±1.28)%比(20.80±2.15)%;q=21.660,P<0.001](图1)。
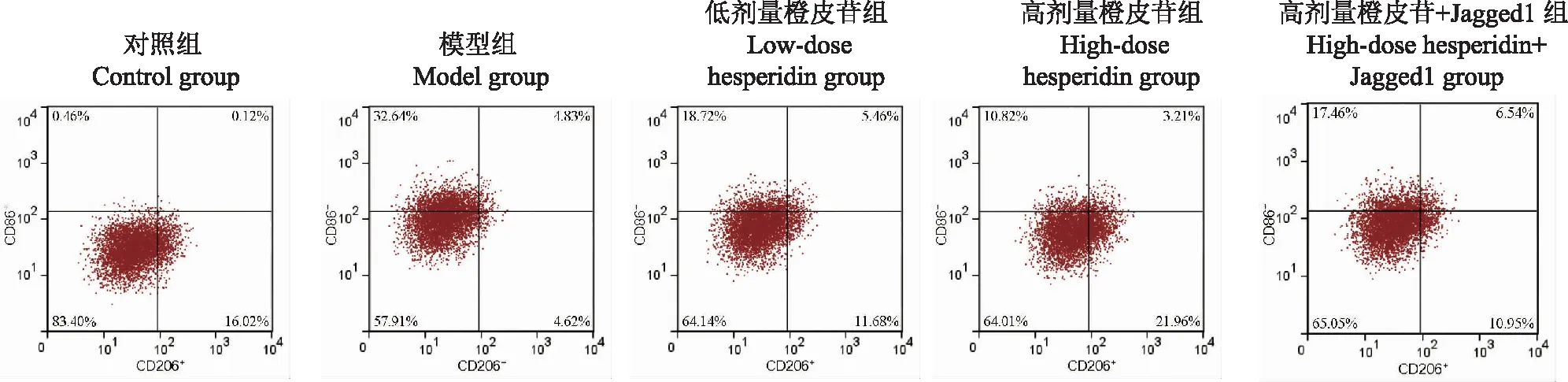
图1 流式细胞仪测定M1和M2型巨噬细胞的比例Fig 1 Proportions of M1-and M2-type macrophages determined by flow cytometry
肺组织病理变化HE和PAS染色结果显示,与对照组相比,模型组小鼠肺组织炎症细胞数量明显增多,伴有大量的支气管周围炎症细胞浸润和杯状细胞增生,且黏液分泌增加,炎症评分(3.26±0.35比0;q=45.078,P<0.001)和黏液分泌评分(2.34±0.25比0;q=44.182,P<0.001)显著升高;与模型组相比,低、高剂量橙皮苷组小鼠肺组织支气管周围炎症细胞浸润和杯状细胞增生明显减轻,黏液分泌减少,炎症评分(2.45±0.28比3.26±0.35;q=11.200,P<0.001和1.62±0.20比3.26±0.35;q=22.677,P<0.001)和黏液分泌评分(1.82±0.21比2.34±0.25;q=9.818,P<0.001和1.29±0.16比2.34±0.25;q=19.825,P<0.001)显著降低;与高剂量橙皮苷组相比,高剂量橙皮苷+Jagged1组小鼠肺组织炎症评分(2.31±0.27比1.62±0.20;q=9.541,P<0.001)和黏液分泌评分(1.75±0.19比1.29±0.16;q=8.685,P<0.001)显著升高(图2)。

图2 HE与过碘酸希夫染色检测肺组织病理变化(×200)Fig 2 Pathological changes in lung tissue detected by HE and periodic acid-Schiff staining (×200)
肺组织iNOS、Arg-1、Jagged1和Notch1 mRNA表达水平与对照组相比,模型组小鼠肺组织iNOS(2.41±0.28比1.00±0.00;q=23.913,P<0.001)、Jagged1(2.85±0.33比1.00±0.00;q=28.028,P<0.001)和Notch1(3.32±0.40比1.00±0.00;q=27.089,P<0.001)mRNA表达水平显著升高,而Arg-1 mRNA表达水平显著降低(0.37±0.06比1.00±0.00;q=29.699,P<0.001);与模型组相比,低、高剂量橙皮苷组小鼠肺组织iNOS(1.89±0.23比2.41±0.28;q=8.819,P<0.001和1.32±0.17比2.41±0.28;q=18.486,P<0.001)、Jagged1(2.21±0.24比2.85±0.33;q=9.696,P<0.001和1.46±0.18比2.85±0.33;q=21.059,P<0.001)和Notch1(2.70±0.35比3.32±0.40;q=7.239,P<0.001和1.84±0.26比3.32±0.40;q=17.281,P<0.001)mRNA表达水平显著降低,而Arg-1 mRNA表达水平显著升高(0.62±0.07比0.37±0.06;q=11.785,P<0.001和1.24±0.11比0.37±0.06;q=41.012,P<0.001);与高剂量橙皮苷组相比,高剂量橙皮苷+Jagged1组小鼠肺组织iNOS(1.81±0.22比1.32±0.17;q=8.310,P<0.001)、Jagged1(2.09±0.25比1.46±0.18;q=9.545,P<0.001)和Notch1(2.63±0.30比1.84±0.26;q=9.224,P<0.001)mRNA表达水平显著升高,而Arg-1 mRNA表达水平显著降低(0.59±0.08比1.24±0.11;q=30.641,P<0.001)。
肺组织iNOS、Arg-1、Jagged1和Notch1蛋白表达水平与对照组相比,模型组小鼠肺组织iNOS(0.45±0.06比0.12±0.02;q=24.828,P<0.001)、Jagged1(0.63±0.08比0.26±0.04;q=21.542,P<0.001)、和Notch1(0.81±0.11比0.40±0.07;q=24.828,P<0.001)蛋白表达水平显著升高,而Arg-1蛋白表达水平显著降低(0.11±0.03比0.29±0.05;q=14.305,P<0.001);与模型组相比,低、高剂量橙皮苷组小鼠肺组织iNOS(0.33±0.05比0.45±0.06;q=9.028,P<0.001和0.20±0.04比0.45±0.06;q=18.809,P<0.001)、Jagged1(0.50±0.06比0.63±0.08;q=7.569,P<0.001和0.35±0.05比0.63±0.08;q=16.302,P<0.001和Notch1(0.70±0.08比0.81±0.11;q=4.771,P=0.012和0.52±0.06比0.81±0.11;q=12.577,P<0.001)蛋白表达水平显著降低,而Arg-1蛋白表达水平显著升高(0.21±0.04比0.11±0.03;q=7.947,P<0.001和0.38±0.06比0.11±0.03;q=21.457,P<0.001);与高剂量橙皮苷组相比,高剂量橙皮苷+Jagged1组小鼠肺组织iNOS(0.32±0.05比0.20±0.04;q=9.028,P<0.001)、Jagged1(0.47±0.06比0.35±0.05;q=6.987,P<0.001)和Notch1(0.64±0.07比0.52±0.06;q=5.204,P=0.005)蛋白表达水平显著升高,而Arg-1蛋白表达水平显著降低(0.20±0.03比0.38±0.06;q=14.305,P<0.001)(图3)。
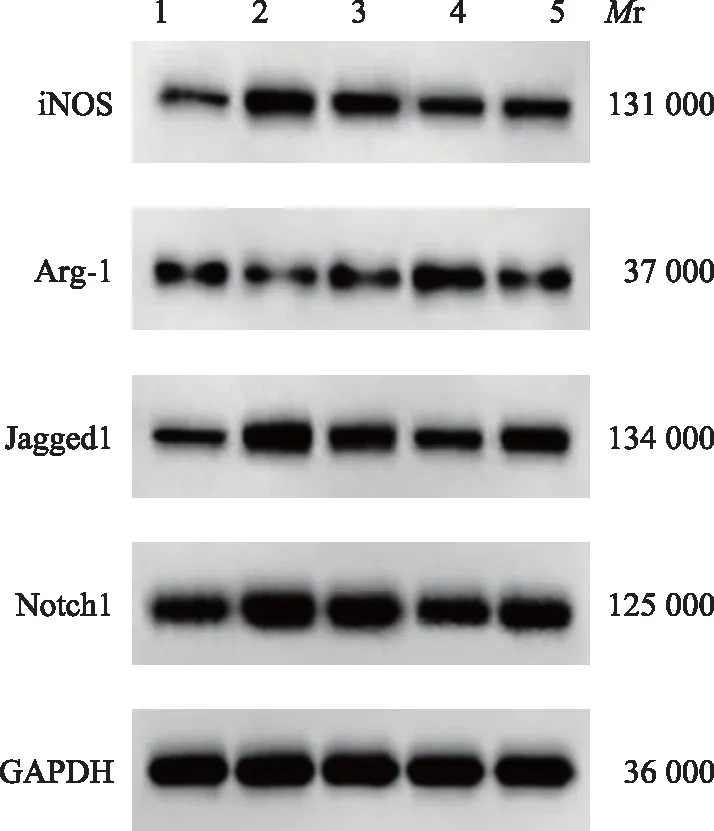
iNOS:诱导型一氧化氮合酶;Arg-1:精氨酸酶1;1:对照组;2:模型组;3:低剂量橙皮苷组;4:高剂量橙皮苷组;5:高剂量橙皮苷+Jagged1组;Mr:相对分子质量iNOS:inducible nitric oxide synthase;Arg-1:arginase 1;1:control group;2:model group;3:low-dose hesperidin group;4:high-dose hesperidin group;5:high-dose hesperidin+Jagged1 group;Mr:relative molecular mass图3 Western blot检测肺组织iNOS、Arg-1、Jagged1和Notch1的表达水平Fig 3 Western blot of the expression of iNOS,Arg-1,Jagged1,and Notch1 in lung tissue
讨 论
据报道,RSV引起的细支气管炎与哮喘的发病机制相似,超过55%的因细支气管炎住院的婴儿在出院后5年内易发展为哮喘[18]。巨噬细胞是肺组织中最丰富的免疫细胞,约占免疫细胞的70%,其在维持肺组织免疫稳态和宿主防御方面发挥着重要作用。巨噬细胞可分为两类,即经典活化型巨噬细胞(M1型)和替代活化型巨噬细胞(M2型),分别表现出促炎和抗炎作用。M1型巨噬细胞可上调与病原体清除有关的基因表达,促进体内促炎症细胞因子IL-6、IL-12和TNF-α等的表达;而由IL-4和IL-13诱导的M2型巨噬细胞上调与伤口愈合、清除凋亡细胞以及组织修复有关的基因表达,参与抗炎反应,其特征是产生细胞因子IL-10和Arg-1、CD206[19-20]。本研究结果显示,在RSV感染诱导的细支气管炎小鼠模型中,BALF中IL-4、IL-6和TNF-α水平升高,而IL-10水平降低,且肺泡巨噬细胞中M1型巨噬细胞比例升高,M2型巨噬细胞比例降低,说明细支气管炎小鼠模型中M1/M2型巨噬细胞极化失衡;同时炎症细胞明显聚集到肺组织,伴有大量的支气管周围炎症细胞浸润和杯状细胞增生,说明RSV感染小鼠肺组织出现严重损伤。有研究显示调节巨噬细胞极化可减轻哮喘小鼠的气道炎症反应,并改善肺组织炎症损伤[21-22]。提示调节M1/M2型巨噬细胞极化可能是细支气管炎重要的治疗靶点。
橙皮苷主要存在于柑橘类水果中,具有显著的抗炎作用,前期研究发现,橙皮苷可作为Th2细胞因子拮抗剂,改善哮喘气道炎症[14,16];并且可抑制脂多糖诱导的小鼠巨噬细胞中环氧合酶-2、iNOS蛋白的过度表达和前列腺素E2、一氧化氮的大量生成[23-24]。本研究结果显示,橙皮苷干预后,细支气管炎模型小鼠肺泡巨噬细胞中M1型巨噬细胞比例降低,M2型巨噬细胞比例升高,且BALF中IL-10水平升高,肺组织支气管周围炎症细胞浸润和杯状细胞增生明显减轻;同时,qRT-PCR和Western blot结果也证实,肺组织M1型巨噬细胞标志物iNOS的mRNA和蛋白水平降低,M2型巨噬细胞标志物Arg-1水平升高,提示橙皮苷可促进M2型巨噬细胞极化以及IL-10的产生,减轻RSV引起的肺组织感染和损伤,但其具体作用机制尚不明确。
研究表明,在RSV感染的小鼠模型中,肺组织Notch1和其配体Jagged1的表达增加,并可通过激活Jagged/Notch1信号通路促进Th2细胞分化[7]。Notch信号可调节胚胎和成体组织中祖细胞和干细胞的自我更新。在哺乳动物中,有4个Notch受体(Notch1~4)可以和5种不同的配体(Jagged1、Jagged2、DLL1、DLL3、DLL4)相互作用,其中Notch1所有配体均可在支气管上皮细胞中检测到。Notch信号在巨噬细胞M1/M2型极化中起着关键作用,激活Notch信号通路可诱导巨噬细胞极化为M1表型[8,25],而阻断Notch信号通路则诱导巨噬细胞极化为M2表型[26]。本研究结果显示,RSV感染诱导的细支气管炎小鼠模型肺组织中Notch1和Jagged1的表达升高,说明Notch信号通路被激活;橙皮苷干预后,Notch1和Jagged1的表达均下降;而在橙皮苷干预的基础上,使用重组Jagged1蛋白激活Notch信号通路,可显著减弱高剂量橙皮苷对M2型巨噬细胞极化的促进作用和对肺组织炎症损伤的改善效果,这表明橙皮苷可能通过抑制Notch信号通路,诱导巨噬细胞极化为M2表型,进而减轻RSV引起的肺组织损伤。
综上,本研究结果表明,橙皮苷可减轻RSV引起的细支气管炎小鼠肺组织炎症损伤,其作用机制可能与抑制Jagged1/Notch1信号通路、促进巨噬细胞M2型极化有关。但是橙皮苷对巨噬细胞极化的调控机制仍有待进一步研究。
