改性花生壳纤维素对水中Ni(Ⅱ)的吸附研究
2022-11-03张丽芳
张 乐,张丽芳,武 欢
(沈阳理工大学 环境与化学工程学院,沈阳 110159)
近年来,随着矿业、电镀、制革等与金属相关工业的快速发展,大量含重金属的工业废弃物、工业污水通过各种途径进入生物圈内,引发了一系列环境问题[1]。重金属污染因其不可降解性和在水体中的富集性而被认为是最严重的危害[2]。现有重金属处理方法主要有化学沉淀法、电解法、膜过滤法、离子交换法等[3-4]。传统化学法和物理化学法具有处理效率较高的优势,但存在处理成本高和二次污染等问题[5]。相比其他处理方法,吸附法具有操作简便、吸附材料来源广泛、适用范围广等特点[6],是公认的具有广阔应用前景的一种水处理技术。
高效吸附剂的设计和制备是吸附法的关键。纤维素是可再生天然聚合物,其储量巨大、来源广泛,年产量高达750亿吨[7]。天然纤维素可用于吸附重金属离子,但吸附容量偏低,且不具有选择性[8],经改性后则可高效吸附重金属离子[9],如胺基改性纤维素能够实现对Cu(Ⅱ)、Zn(Ⅱ)、Cd(Ⅱ)等金属阳离子的吸附[10]。花生壳纤维属于果实纤维的一种,我国每年约产生近500万吨的花生壳[11-12],除少部分花生壳被用于提取其内含功能性物质、加工成饲料或用作燃料,其余大多被丢弃或烧毁,浪费资源的同时也引起了污染问题。
本文以农业废弃物花生壳为研究对象,采用氢氧化钠-亚氯酸钠法[13]提取纤维素,为提高其对Ni(Ⅱ)的吸附能力,选用三乙烯四胺对其改性,引入胺基,制备改性花生壳纤维素吸附剂。利用扫描电镜、傅里叶红外光谱仪对制备的吸附材料进行表征,并探究其对Ni(Ⅱ)的吸附行为。
1 实验部分
1.1 实验材料和主要试剂
花生壳,购自山东潍坊;氢氧化钠、无水碳酸钠、无水乙醇、丁二酮肟、冰乙酸、硝酸镍、三乙烯四胺,均为分析纯,国药集团化学试剂有限公司;环氧氯丙烷,分析纯,天津市大茂化学试剂厂;亚氯酸钠,分析纯,上海阿拉丁生化科技有限公司。
1.2 实验方法
1.2.1 花生壳纤维素的提取
采用氢氧化钠-亚氯酸钠法提取纤维素。花生壳用自来水清洗,浸泡24h,恒温干燥箱(101-2AB型,天津市泰斯特仪器有限公司)中烘干水分,使用粉碎机(878A型,常州国华电器有限公司)粉碎成粉末,过100目筛,得花生壳粉末。将5.00g花生壳粉末与300mL浓度为1mol/L的NaOH溶液混合,置于75℃、130r/min的恒温水浴振荡器(SHA-C型,常州国华电器有限公司)中振荡反应30min;移出冷却至40℃左右,超声破碎5min,继续水浴反应90min,过滤,碱洗3次,去离子水洗涤至中性,碱洗的目的主要是去除花生壳中的半纤维素。加入150mL体积比为1∶1的31mL/L乙酸和15g/L亚氯酸钠混合溶液,75℃水浴反应60min,结束后抽滤,重复上述过程(通常3~4次)至样品显白色为止;去离子水多次洗涤至中性,无水乙醇脱水,风干,制得白色花生壳纤维素粉末。
1.2.2 改性花生壳纤维素的制备
称取1.00g提取的花生壳纤维素,置于150mL锥形瓶中,加入2mol/L的NaOH溶液30mL,再缓慢滴加一定体积的环氧氯丙烷和10mL乙醇,50℃、130r/min下进行水浴振荡反应5h;去离子水洗涤,过滤,加入50mL去离子水,加入一定体积的三乙烯四胺,再加入1.00g无水碳酸钠起催化作用,50℃恒温水浴反应5h;抽滤、洗涤至中性,烘干,研磨,制得改性纤维素吸附剂。
1.2.3 吸附实验
移取50mL浓度为20mg/L、pH值为7的Ni(Ⅱ)溶液于150mL锥形瓶中,加入50mg三乙烯四胺改性花生壳纤维素,密封瓶口防止溅出。在30℃、130r/min下恒温振荡吸附2h,使用0.45μm滤膜过滤,采用可见分光光度计(721-E型,上海光谱仪器有限公司),按照丁二酮肟分光光度法[14]测定上清液残留的Ni(Ⅱ)浓度,平行测定三次取平均值。计算吸附去除率R和平衡吸附量qe,公式如下。
(1)
(2)
式中:C0为初始Ni(Ⅱ)浓度,mg/L;Ce为吸附平衡时Ni(Ⅱ)浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。
1.2.4 材料的表征
采用日立S-3400N型扫描电镜(SEM)观测改性前后花生壳纤维素的结构和形貌特征;采用北分瑞利WQF-410型傅里叶红外光谱仪(FT-IR)对改性前后花生壳纤维素进行表征,测试时将样品烘干,按照一定比例与光谱纯级溴化钾研磨均匀,压片制样,测量波数范围为4000~500cm-1,设置分辨率为4cm-1,扫描32次。
2 结果与讨论
2.1 改性花生壳纤维素制备条件对去除率的影响
2.1.1 环氧氯丙烷用量的影响
固定三乙烯四胺用量为2mL(以1g花生壳纤维素为基准),改变环氧氯丙烷用量(分别取为2.5、5.0、7.5、10.0mL),制得改性花生壳纤维素,并用于吸附水中Ni(Ⅱ),测得Ni(Ⅱ)的去除率,结果如图1所示。

图1 环氧氯丙烷用量对Ni(Ⅱ)去除率的影响
由图1可知,随着环氧氯丙烷的用量不断增加,Ni(Ⅱ)的去除率呈先增加后降低的趋势。当环氧氯丙烷用量增加至5mL时,改性花生壳纤维素吸附效果最佳,此后继续增加环氧氯丙烷的用量,去除率反而降低。在三乙烯四胺改性花生壳纤维素的过程中,环氧氯丙烷充当交联剂,起架桥的作用。环氧氯丙烷用量过低时,花生壳纤维素上环氧基团含量不高,影响后续接枝胺基,对Ni(Ⅱ)去除率偏低;环氧氯丙烷用量超过一定程度,可能产生自聚,也会影响吸附效果。因此,环氧氯丙烷的最佳用量取为5mL。
2.1.2 三乙烯四胺用量的影响
固定环氧氯丙烷的用量为5mL(以1g花生壳纤维素为基准),改变三乙烯四胺用量(分别取为1.0、2.0、3.0、4.0、5.0mL),制得改性花生壳纤维素,并用于吸附Ni(Ⅱ),测得Ni(Ⅱ)的去除率,结果如图2所示。

图2 三乙烯四胺用量对Ni(Ⅱ)去除率的影响
由图2可看出,随着三乙烯四胺用量的不断增加,改性花生壳纤维素对Ni(Ⅱ)的去除率先升高后降低。当三乙烯四胺用量为2mL时,Ni(Ⅱ)的去除率最高。在碳酸钠催化作用下,三乙烯四胺与环氧纤维素发生反应,将胺基接枝在纤维素上。随着三乙烯四胺用量的增加,纤维素上接枝的胺基量也会逐渐增多,吸附位点增加,去除率升高;三乙烯四胺过多则可能交联部分高分子链,使得产物凝胶化[15],不利于对Ni(Ⅱ)的吸附,去除率反而下降。因此,三乙烯四胺的最佳用量取为2mL。
2.2 改性花生壳纤维素的表征
2.2.1 扫描电镜分析
为考察改性前后花生壳纤维素的表面形貌结构及变化,利用扫描电镜进行表征,结果如图3所示。
由图3a可见,改性前花生壳纤维素表面较光滑,呈现细长棒状结构;由图3b和图3c可见,改性后的花生壳纤维素形貌发生明显变化,表面较为粗糙,凹凸不平,空隙较多,呈现类蜂巢状结构,该结构可为三乙烯四胺改性纤维素提供更多吸附位点。

图3 花生壳纤维素改性前后SEM图
2.2.2 红外光谱分析
为考察花生壳纤维素经三乙烯四胺改性后结构的变化,对其进行FT-IR分析,结果如图4所示。
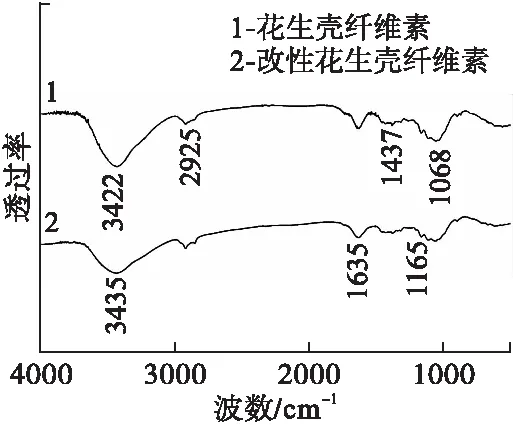
图4 花生壳纤维素改性前后FT-IR图
由图4可知,改性前花生壳纤维素的FT-IR谱线在波数3422cm-1处为—OH伸缩振动峰,2925cm-1和1437cm-1处分别对应—CH2伸缩振动峰和弯曲振动峰,在1068cm-1处为C—O伸缩振动峰[16]。三乙烯四胺改性花生壳纤维素的主要特征峰与改性前基本一致,但在波数3435cm-1处的吸收峰变宽且发生偏移,此为纤维素中—OH伸缩振动和改性后N—H伸缩振动的重叠峰。此外,改性花生壳纤维素的FT-IR谱线在波数1635cm-1处存在N—H弯曲振动峰,1165cm-1处存在C—N伸缩振动峰,该两种峰均为三乙烯四胺上胺基的特征吸收峰[17]。由此说明,三乙烯四胺被成功接枝在花生壳纤维素表面。
2.3 吸附条件对去除率的影响
2.3.1 pH的影响
在最佳条件下制备改性花生壳纤维素,并按照1.2.3实验方法用于吸附水中Ni(Ⅱ)。改变Ni(Ⅱ)溶液的初始pH值(分别取为2、3、4、5、6、7、8),测得Ni(Ⅱ)的去除率,结果如图5所示。

图5 pH对Ni(Ⅱ)去除率的影响
由图5可见,当pH值处于2~7范围内时,改性纤维素对Ni(Ⅱ)的去除率随着pH值的增加而不断升高,在pH值为7时,去除率最高,可达50.3%,此后pH值再增加,去除率有所下降。当pH值比较低时,溶液中的氢离子会占据吸附位点,阻碍对Ni(Ⅱ)的吸附;随着pH值的升高,活性位点会释放氢离子,能够吸附Ni(Ⅱ)的活性位点增多,故吸附去除率增大;当pH值大于7时,Ni(Ⅱ)可能会与OH-发生反应生成沉淀或络合物[18],不利于改性花生壳纤维素的吸附,导致去除率下降。因此,选择适宜的pH值为7。
2.3.2 吸附时间的影响
采用最佳条件下制备的改性花生壳纤维素,按照1.2.3实验方法用于吸附Ni(Ⅱ),改变吸附时间(分别取为5、10、20、30、60、120、180min),测得Ni(Ⅱ)的去除率,结果如图6所示。
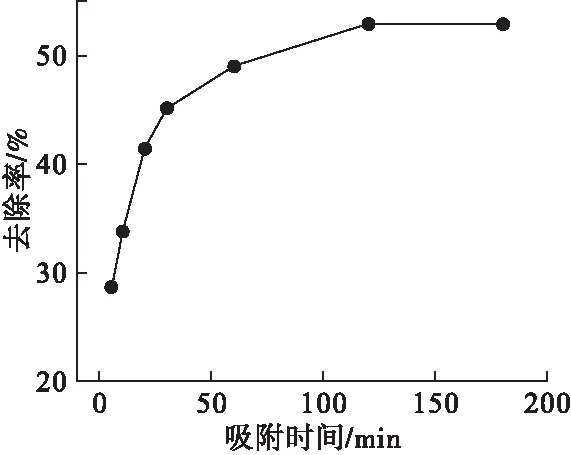
图6 吸附时间对Ni(Ⅱ)去除率的影响
由图6可见,随着吸附时间由5min增加到120min,改性花生壳纤维素吸附剂对Ni(Ⅱ)的去除率持续升高,吸附时间超过120min之后,去除率没有明显变化,此时吸附基本达到平衡状态。吸附时间在5~60min时,吸附剂对Ni(Ⅱ)的吸附较快,去除率从28.70%增加到49.00%,之后去除率增加变得缓慢并逐渐接近平衡,吸附时间达到120min后去除率基本不变。其原因是,在吸附初始阶段改性花生壳纤维素存在大量吸附位点,随着时间的增加,越来越多的Ni(Ⅱ)聚集在吸附剂表面,吸附位点逐渐被占据和耗尽,吸附反应也逐渐趋于平衡。故适宜的吸附时间取为120min,此时Ni(Ⅱ)的去除率为51.90%。
2.3.3 吸附剂投加量的影响
采用最佳条件下制备的改性花生壳纤维素,按照1.2.3实验方法用于吸附Ni(Ⅱ),改变吸附剂的投加量(分别取为10、20、30、40、50、60、70、80、90、100mg),测得Ni(Ⅱ)的去除率,结果如图7所示。
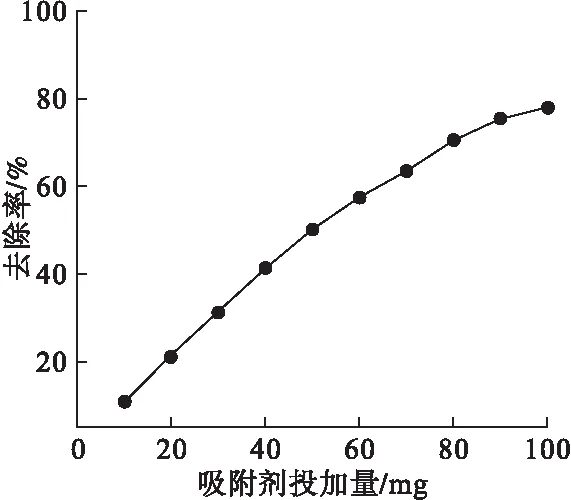
图7 吸附剂投加量对Ni(Ⅱ)去除率的影响
由图7可见,当吸附剂的投加量为10mg时,改性花生壳纤维素对Ni(Ⅱ)的去除率仅为10.90%,增加吸附剂的投加量,Ni(Ⅱ)的去除率也随之升高。由于吸附剂量的增加可提供更多的吸附位点[19],溶液中Ni(Ⅱ)能被吸附的机会也有所增加,故去除率随之升高。当投加量为80mg时,去除率可达70.60%;此后再增加投加量,Ni(Ⅱ)的去除率增加趋势有所变缓,这是由于溶液中大量的Ni(Ⅱ)已被吸附剂所吸附,且吸附过程逐渐达到平衡。为节省吸附剂用量,适宜的吸附剂投加量取为80mg。
2.4 等温吸附模型
调节溶液初始pH值为7,吸附剂投加量为50mg,改变Ni(Ⅱ)的初始浓度(取为5、10、20、30、40、50、60mg/L),分别在293.15、303.15、313.15K下振荡吸附120min,测试并计算得到Ni(Ⅱ)的平衡浓度和平衡吸附量,结果如图8所示。
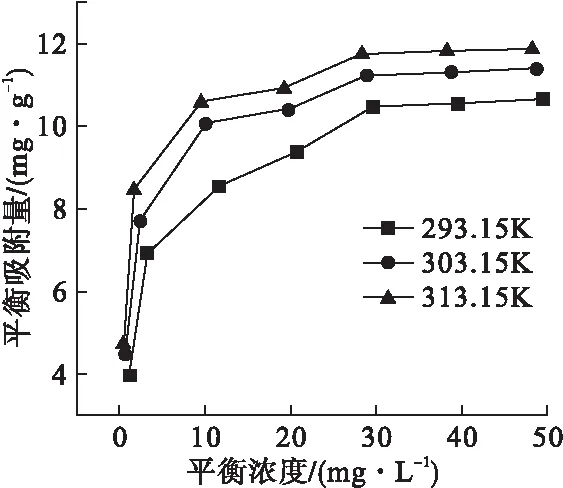
图8 吸附剂对Ni(Ⅱ)的吸附等温线
由图8可知,在实验温度范围内,吸附剂对Ni(Ⅱ)的吸附量随着Ni(Ⅱ)初始浓度的增大而升高;在相同浓度下,温度越高,Ni(Ⅱ)的吸附量越大。当Ni(Ⅱ)的初始浓度增至40mg/L时,测得293.15、303.15和313.15K的平衡浓度分别为29.53、28.77和28.26mg/L,对应图8中的平衡吸附量分别为10.47、11.23和11.74mg/g;之后再增加Ni(Ⅱ)的初始浓度,吸附量基本不变,说明吸附剂吸附容量趋于饱和状态。
根据Langmuir和Freundlich模型[20]对等温吸附数据进行拟合,结果如表1所示,表中T为吸附温度。Langmuir方程和Freundlich方程的线性化形式分别为
(3)
(4)
式中:q0为饱和吸附量,mg/g;KF、b、n均为常数。
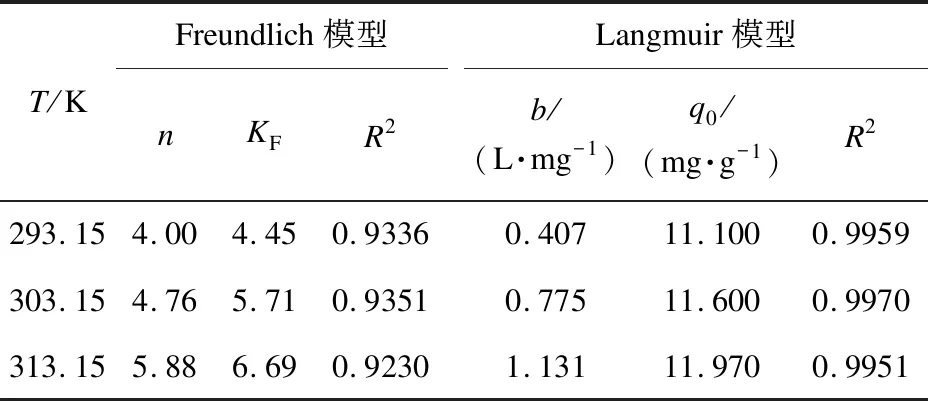
表1 等温吸附模型相关参数
由表1可知,在不同温度下,采用Langmuir模型拟合的线性相关系数R2均高于0.99,且明显高于Freundlich模型。表明本实验条件下改性花生壳纤维素对Ni(Ⅱ)的等温吸附更符合Langmuir模型。
2.5 吸附热力学
利用等温吸附实验数据,根据式(5)计算不同温度下(293.15、303.15、313.15K)的吸附分配系数Kd。将热力学关系式(6)代入式(7),得到式(8),根据式(8)以lnKd对1/T作图,进行线性拟合,根据拟合直线的截距和斜率求得吸附熵变ΔS0和吸附焓变ΔH0[21],再根据式(6)计算吉布斯自由能ΔG0。
(5)
ΔG0=-RTlnKd
(6)
ΔG0=ΔH0-TΔS0
(7)
(8)
计算得到相关热力学参数如表2所示。

表2 吸附热力学相关参数
由表2可知,改性花生壳纤维素对水中Ni(Ⅱ)吸附的ΔG0均小于0,表明此吸附过程自发进行。随着温度升高,|ΔG0|增大,说明反应的推动力增大。熵变ΔS0为154.09J/(mol·K),其值为正,说明改性花生壳纤维素对Ni(Ⅱ)的吸附过程是熵增过程,固液界面上分子运动比吸附前更加混乱。焓变ΔH0为44.51kJ/mol,为正值,表明吸附过程吸热,即在研究温度范围内,升高温度有利于对Ni(Ⅱ)的吸附。
3 结论
(1)改性花生壳纤维素红外谱线可见胺基特征峰,成功制备了三乙烯四胺改性花生壳纤维素,其表面粗糙,呈类蜂巢状,利于吸附。
(2)环氧氯丙烷用量为5mL/g、三乙烯四胺的用量为2mL/g时,制备得到的三乙烯四胺改性花生壳纤维素对Ni(Ⅱ)的吸附效果最佳。
(3)确定适宜的吸附条件为:Ni(Ⅱ)溶液初始pH值为7,吸附时间为120min,吸附剂投加量为80mg,该吸附条件下对Ni(Ⅱ)的去除率可达到70.60%。
(4)在实验温度范围内,吸附剂对Ni(Ⅱ)的等温吸附过程符合Langmuir模型。改性花生壳纤维素对Ni(Ⅱ)的吸附过程为自发的吸热过程,温度升高有利于吸附的进行。
