IFI35 介导细胞凋亡抑制新城疫病毒增殖的分子机制研究
2022-11-03贾燕青仇薪鑫张蓉杨增岐
贾燕青仇薪鑫张 蓉杨增岐
(1.杨凌职业技术学院动物工程分院/动物疫病防控陕西省高校工程研究中心,陕西杨凌 712100;2.西北农林科技大学动物医学院,陕西杨凌 712100)
新城疫病毒(Newcastle Disease Virus,NDV)是严重危害全球养禽业的重要病原之一,其强毒能够导致家禽90%以上的死亡,给养禽业带来了巨大的经济损失[1-2]。研究病毒与宿主之间的作用关系,可以有效帮助阐明病毒感染及宿主免疫反应的关系,有利于帮助新城疫防控和新疫苗研发[3-5]。高通量测序技术的快速发展促进了NDV 感染时对宿主基因变化规律的研究,本研究前期通过转录组测序全面深入了解NDV 感染无特定病原体(Specific pathogen free,SPF)鸡胚后内脏组织mRNAs表达谱的变化,比较不同毒力NDV 毒株对鸡胚组织基因表达的影响,并对NDV 感染引起的差异表达基因进行功能注释和生物学通路分析,筛选与天然免疫反应相关的关键基因及通路[3-4]。
在干扰素(Interferon,IFN)相关差异表达基因中,选择一些基因进行深入研究,发现干扰素诱导蛋白35(Interferon induced protein 35,IFI35)抗NDV 效果较好,因此对该分子进行深入研究并发现该分子可以通过增强IFNs表达来发挥抗NDV 作用。然而有研究报道发现,不同的基因可以通过改变细胞生长状态来影响NDV 在细胞中的增殖[6-8],本研究通过探索IFI35基因在抗NDV 感染过程中是否还存在除了干扰素通路以外的其他途径来抑制病毒的增殖,阐明IFI35抗NDV 感染的其他分子机制,以期为NDV 的防治提供新的靶点与思路。
1 材料与方法
1.1 材料
1.1.1 细胞与病毒 鸡成纤维细胞系(DF-1)、NDV 强度株F48E9和弱毒株La Sota-GFP均来自于西北农林科技大学动物医学院传染病实验室。
1.1.2 主要试剂 RNAiso Plus、T4 DNA 连接酶、限制性内切酶、高保真酶Prime STAR MAX为宝生物工程(大连)有限公司产品;反转录试剂盒、荧光定量试剂盒为北京GenStar公司产品;质粒提取试剂盒和胶回收试剂盒为天根生化科技(北京)有限公司产品;改良Eagle培养基(Dulbecco’s modification of Eagle’s medium,DMEM)细胞培养液和胎牛血清为GIBCO 公司产品;TurboFect转染试剂盒购自Thermo Scientific公司;鼠源HA 单抗、GAPDH 单抗、羊抗鼠IgG-HRP为天津三箭生物公司产品;鼠源Flag单抗、兔源HA 多抗、羊抗鼠绿色荧光抗体和羊抗兔红色荧光抗体为生工生物工程(上海)股份有限公司产品;聚二偏氟乙烯(Polyvinylidene fluoride,PVDF)膜为美国GE 公司产品;凋亡检测试剂盒为北京康为世纪生物科技有限公司产品;其他试剂均为国产或进口分析纯试剂。
1.2 方法
1.2.1 实时荧光定量PCR 按照RNAiso Plus提取细胞或组织总RNA,按照StarScript ⅡFirst-strand cDNA Synthesis Mix试剂盒进行反转录。根据2×RealStar Green Power kit说明进行实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)分析,以28S 为内参,检测目的基因的表达,引物序列见表1。反应体系(20μL)为:cDNA 1μL,上游引物(10μmol/L)0.4μL,下游引物(10μmol/L)0.4μL,2×RealStar Green Fast Mixture 10μL,dd H2O 8.2μL;混匀后,进行PCR 反应,反应程序为:95 ℃,2 min;95 ℃,15 s,60 ℃,30 s,45个循环。

表1 试验所用引物Table 1 Primers used in this study
1.2.2 基因扩增、质粒构建及细胞转染 根据RNA-Seq测序结果及NCBI数据库中IFI35基因的预测序列(GenBank登录号:XM_418132.5)设计扩增鸡源IFI35基因片段的引物。收集F48E9感染的鸡胚成纤维原代细胞(Chicken embryo fibroblast,CEF),提取RNA 并进行反转录,合成的cDNA 用于扩增IFI35基因片段。使用高保真酶Prime STAR MAX 进行扩增,反应程序为95 ℃,预变性5 min;95 ℃15 s,55 ℃15 s,72 ℃45 s,40个循环。PCR 产物测序正确后,连接至p CMV-3HA 载体上,构建p CMV-3HA-IFI35 质粒。 以同种方法成功构建p CAGGS-Flag-IFI35等质粒,并经双酶切及测序进行验证。
将状态良好的DF-1 细胞生长于24 孔板中(105/孔),待细胞生长至80%融合时,进行质粒转染,按照TurboFect转染试剂说明进行细胞转染。转染24 h 后,收集细胞,检测目的基因的m RNA 和蛋白表达变化。
1.2.3 NDV 感染细胞及病毒滴度测定 对病毒增殖主要采用半数组织感染剂量(50%tissue culture infectious dose,TCID50)和荧光密度进行测定。DF-1细胞在96孔或24孔板培养24 h,将收集的待测病毒上清进行10倍连续稀释,以100 μL/孔或300μL/孔依次加入96孔板或24孔板中。在病毒感染后连续5 d进行观察直至没有新的病变出现,统计并记录每孔病毒的感染情况。TCID50用Reed-Muench方法进行计算,平均每个视野下荧光强度计算参考文献所用方法[9]。
1.2.4 蛋白免疫印迹 DF-1细胞均匀铺于24孔细胞板中,待单层细胞生长至85%融合时进行质粒转染。将p CMV-3HA-IFI35、p CMV-3HA、p CAGGS-Flag-IFI35 及p CAGGS 质粒进行单转,每种质粒各转1μg/孔,24 h 后收集蛋白样品,用蛋白免疫印迹(Western blot)方法检测IFI35表达量。用磷酸盐缓冲溶液(Phosphate buffered solution,PBS)将细胞洗涤3遍,在细胞中加入含苯甲基磺酰氟(Phenylmethanesulfonyl fluoride,PMSF)的RIPA(Radio immunoprecipitation assay)裂解液,然后置于冰上充分裂解30 min。将细胞裂解液收集到1.5 m L 离心管中,4 ℃、12 000 r/min 离心10 min,收取上清加入5×蛋白上样缓冲液,煮沸10 min。制备浓度为12%SDS-PAGE 的分离胶,每孔加入等量蛋白,在80 V 进行电泳30 min,当染料跑出浓缩胶时,120 V 继续电泳,直到样品电泳至胶底即可结束电泳。将PVDF膜在甲醇中浸泡20 s,取出电泳胶,按顺序装好转膜夹,100 m A 恒流电泳1 h。电泳结束,将PVDF膜浸泡在浓度为10%的脱脂奶粉中,室温封闭2 h。封闭结束后,将膜放入一抗孵育液中,4 ℃过夜孵育。用TBS+Tween缓冲溶液(Tris-HCl and Tween,TBST)清洗PVDF膜5次,每次10 min。结束后,在摇床上缓慢孵育二抗1 h,用TBST 缓冲液清洗PVDF膜5次,每次10 min。洗涤结束后,在蛋白曝光仪上进行曝光,并记录结果。
1.2.5 细胞凋亡检测 待DF-1细胞生长密度达80% 左右时,用Turbofect 转染pCAGGSFlag-IFI35与Vec质粒,转染24 h 后,一组接种0.1MOI F48E9,另一组不接毒,每组3 个重复,并设置空白对照组。接毒24 h 后按照Annexin V-FITC/PI凋亡检测试剂盒进行检测样品准备。用不含乙二胺四乙酸(Ethylene diamine tetraacetie acid,EDTA)的胰酶消化细胞,1 000 g离心3 min,弃上清,用预冷PBS重悬细胞,重复清洗细胞两次;用Binding Buffer重悬细胞,调节细胞密度约为1×106/m L;取100μL细胞悬液,加5μL Annexin V-FITC和10μL 碘化丙啶(Propidium Iodide,PI)染色液;避光孵育15 min,流式细胞仪进行分析。第二象限显示晚期凋亡细胞,第四象限显示早期凋亡细胞。同时利用RT-qPCR 方法检测IFI35对线粒体凋亡相关基因m RNA 水平的影响,主要包括p53、Caspase3和FasL,引物如表1所示。
1.2.6 统计学分析 试验均进行3次生物学重复,用GraphPad prism 5进行数据分析及作图。结果采用student’sttest进行显著性检验,数值以“平均值±标准偏差”表示。
2 结果与分析
2.1 mRNAs表达差异分析及RT-qPCR 结果验证
前期NDV 转录组测序研究中发现,F48E9感染后获得2 035个差异表达基因,其中1 190个基因的表达量上调,845个基因的表达量下调;La Sota感染后获得1 604 个差异表达基因,其中992个基因的表达量上调,612个基因的表达量下调;La Sota感染组与F48E9 感染组比较,获得1 028个差异表达基因,其中360 个基因的表达量上调,668 个基因的表达量下调。利用RTqPCR 技术对随机选取的10个差异表达基因进行验证,荧光定量PCR 结果与转录组测序结果相似,干扰素刺激基因12(Interferon-stimulated gene 12-2,ISG12-2)、IFI35、莫罗尼白血病病毒10(Moloneyleukemiavirus 10,Mov10)、遗传和生理学实验室蛋白2基因(Laboratory of genetics and physiology 2,LGP2)、干扰素调节因子3(Interferon regulatory Factor 3,IRF3)、黏病毒抵抗蛋白(Myxovirus resistance,Mx)基因、寡腺苷酸合成酶样蛋白(Oligonucleotide synthaselike protein synthetase,OASL)基因、三重基序蛋白25(Tripartite motif-containing protein 25,TRIM25)基因、组织型转谷氨酰胺酶(Transglutaminase type 2,TGM2)及8号染色体开放阅读框4 抗体(Chromosome 8 open reading frame,C8ORF4)均为表达上调差异基因且在强弱毒株感染时有差异(图1),这些验证结果表明测序结果比较可靠,可用于数据分析。
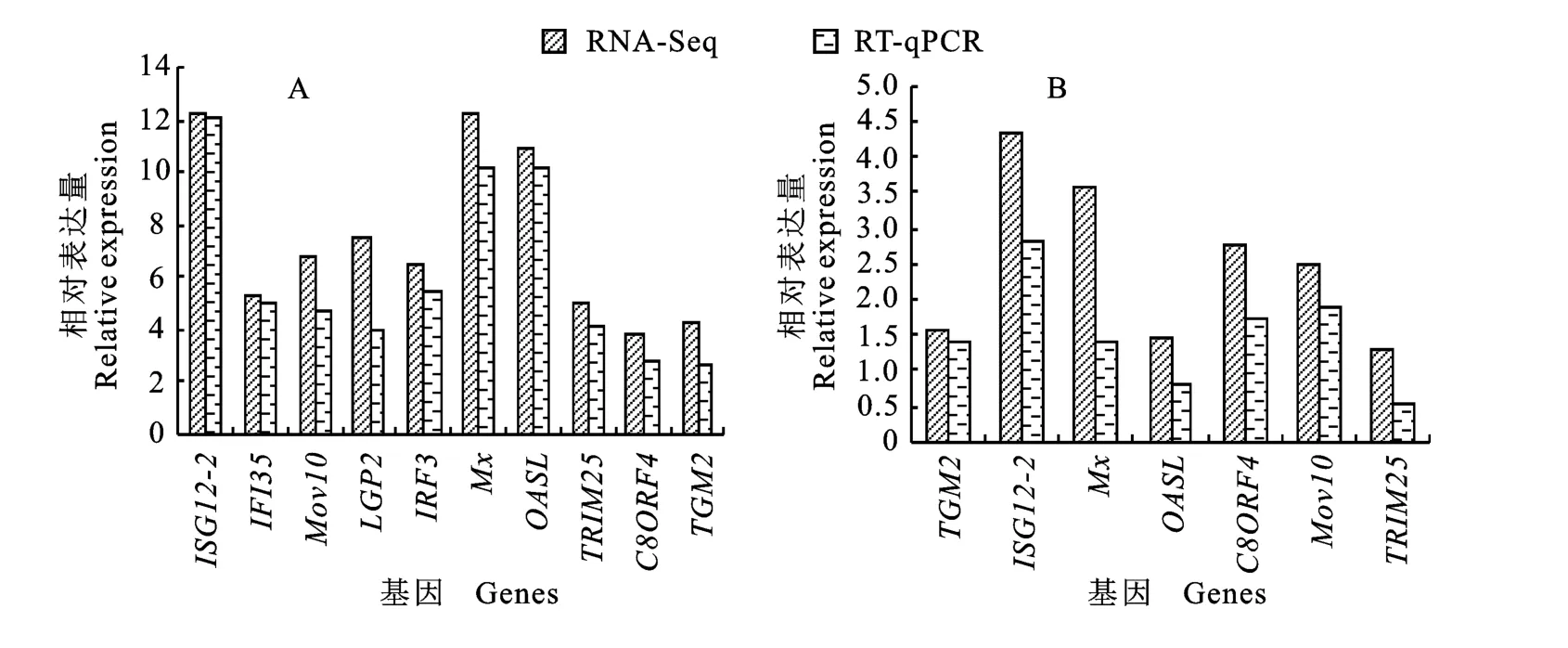
图1 RNA-Seq测序及RT-qPCR 验证分析Fig.1 Analysis of RNA-Seq and RT-qPCR verification
2.2 IFI35 对NDV增殖的影响
选取部分差异表达基因,将其克隆连接至载体上,进行NDV 感染研究,这些基因包括IFI35、ISG12-2、C2orf40、C8orf4、TCF21和TIRM25。在质粒转染24 h后接种La Sota-GFP病毒,并在接毒后12 h、24 h、36 h和48 h观察La Sota-GFP感染细胞荧光强毒,结果发现IFI35抗NDV 效果较好(图2),因此对该分子进行深入研究。
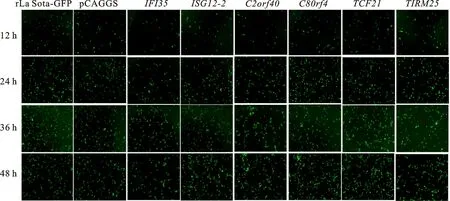
图2 基因过表达对La Sota-GFP增殖的影响Fig.2 Effect of gene overexpression on the proliferation of La Sota-GFP
构建IFI35过表达重组质粒,并用western bolt进行检测,发现构建的质粒可以有效增加IFI35的表达。在DF-1细胞中过表达IFI3524 h(图3),再感染F48E9或La Sota-GFP后,取接毒后9、12、24、36和48 h样品检测病毒增殖,发现IFI35过表达可以有效地抑制NDV 的复制,在接毒后9、12、24、36和48 h La Sota-GFP分别被抑制2.5、5.03、5.83、9.17和6.67倍,F48E9分别被抑制3.33、10、10、7.5和9.17倍,以上结果表明IFI35可有效抑制NDV 的增殖。
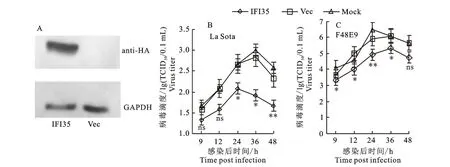
图3 过表达IFI35 可抑制NDV增殖Fig.3 Overexpression of IFI35 inhibit the proliferation of NDV
2.3 IFI35 抗NDV机制研究
为了阐明IFI35抗病毒机制,在DF-1 细胞中过表达IFI3524 h后感染NDV 病毒,通过流式细胞术分析细胞凋亡情况。结果发现,过表达IFI35可以促进细胞凋亡,IFI35过表达时可显著增强NDV 诱导的DF-1细胞的凋亡,早晚期凋亡细胞百分比约是对照组的2倍(图4-A),进一步验证了NDV 可引起细胞凋亡。利用RTqPCR 方法检测m RNA 水平,结果发现过表达IFI35可促凋亡基因p53、Caspase3和Fas L显著上调,这些数据表明,过表达IFI35可以促进细胞凋亡和NDV 诱导的细胞凋亡,IFI35可以通过激活细胞凋亡通路来抵抗NDV 的增殖。

图4 IFI35 过表达时能促进细胞凋亡Fig.4 Overexpressed IFI35 could promote cell apoptosis
3 讨论
本试验筛选了NDV 感染后的差异表达基因进行抗病毒研究,发现IFI35基因在抗NDV 感染中效果较好,因此对该基因进行了深入的分析和研究。IFI35是1994年在IFNγ处理的HeLa细胞中首次发现的[10],随后IFI35序列在鼠、牛及鱼类相继报道[11-13],到目前为止,IFI35的分子功能仅在哺乳类和甲骨鱼中报道,IFI35对病毒增殖的影响研究较少,据报道IFI35可通过直接与猪流感病毒(H3N2)的病毒蛋白NS1相互作用来抑制病毒的复制,使视黄酸(维甲酸)诱导基因蛋白Ⅰ(Retinoic acid-inducible gene-Ⅰ,RIG-Ⅰ)从IFI35介导的K48连接泛素化和降解中释放出来,产生抗病毒作用,而IFI35不能与禽流感病毒(H7N9)NS1蛋白作用,导致在H7N9感染时发挥相反的作用[14]。IFI35可以通过保持RIG-I的磷酸化并对其进行泛素化降解达到天然免疫反应信号通路的负调节作用,进而促进VSV病毒的复制[12]。在本研究中,过表达IFI35可以抑制F48E9和La Sota的增殖,这与抑制牛泡沫病毒(Bovine foamy virus,BFV)和口蹄疫病毒(Foot-and-mouth disease virus,FMDV)增殖的报道相似[11,15-16]。众所周知,在鸡上缺少RIG-I分子,这可能是导致IFI35在VSV 和NDV 感染中有差异的原因,虽然黑色素瘤分化相关基因5(Melanoma differentiation associated gene 5,MDA5)与RIG-I的部分功能相似,但是他们在对病毒应答和降解方式上还是存在着差异[16]。IFI35是一种IFN诱导基因,笔者已经证明了IFI35与IFN 之间的表达变化,发现IFI35可以调节IFNs的产生,进而发挥抗NDV 的作用[17]。
细胞凋亡是由多种基因调控的一种程序性细胞死亡方式,也是宿主抵抗病毒感染的一种防御策略[18]。在本研究中,笔者发现鸡源IFI35过表达后,在凋亡检测中早晚期凋亡细胞明显增多,这表明IFI35可以促进细胞凋亡,也可以促进NDV感染诱导的细胞凋亡。在从m RNA 水平进行检测,结果发现无论是否有NDV 感染,都可以引起FasL表达量增加,而在NDV 感染时可促进p53和Caspase3表达增加。FasL作为细胞膜表面分子,过表达时可触发靶细胞内部凋亡程序,引起靶细胞程序性凋亡,研究发现NDV V 蛋白过表达可抑制该基因的表达,从而抑制细胞凋亡[7]。p53基因可以抑制肿瘤发生,也能促进细胞凋亡,研究表明当过量表达时可以抑制NDV 和IBDV 的增殖[19]。Caspase3基因是引起细胞凋亡的重要调节基因,当线粒体凋亡途径激活后,可改变线粒体的膜通透性,导致Cyt c等大分子蛋白质释放,可以激活Caspase3/Caspase9,最终导致细胞凋亡发生[20]。ISG12(1)过表达可以引起Bak、Cyt c和Caspase3/Caspase9表达增加,通过细胞凋亡方式,来抑制NDV 的增殖[21]。在HK-2细胞中,miR-146b-5p可靶向IFI35介导JAK1/STAT1信号抑制炎症反应和细胞凋亡,IFI35过表达可促进LPS引起的炎症反应和细胞凋亡,而敲低IFI35可导致相反的趋势[22]。本研究结果初步表明,IFI35可以通过促进细胞凋亡来抑制NDV的增殖,但是具体的激活路径还需要进一步再深入研究,为深入了解NDV 与宿主的相互作用提供新的见解,也为NDV 防治提供新的靶点。
4 小结
利用高通量测序技术对NDV 感染的鸡胚内脏组织转录谱进行测序分析,与对照组相比,F48E9感染组和La Sota感染组分别有2 035和1 604个差异表达基因,对部分差异表达基因进行抗NDV 增殖研究,鸡源差异表达基因IFI35抗病毒效果较好,除了IFN 信号通路抑制病毒增殖以外,本研究发现IFI35可显著促进细胞凋亡,促进凋亡相关基因表达增加,对NDV 增殖发挥抑制作用,这些研究丰富了宿主抗NDV 的分子机制研究,也为新城疫防治和疫苗研发提供新的思路。
