GPC-3和Arg-1在肝细胞性肝癌中的表达及其诊断价值
2022-11-03曹梦高广甫
曹梦,高广甫
(郑州大学第五附属医院 消化内科,河南 郑州 450000)
肝癌是影响全球的公共卫生问题,据2020全球肿瘤流行病统计数据(GLOBOCAN 2020)统计,原发性肝癌是全球第六大常见癌症和第三大癌症死亡原因,2020年,全球肝癌新增病例约90.6万人,死亡83.0万人。中国人群肝癌新发病例和死亡病例分别占全世界的45.3%和47.1%[1]。肝癌包括原发性肝癌和肝转移癌,其中肝细胞性肝癌占原发性肝癌的85%~90%。肝细胞性肝癌和转移癌的治疗和预后有显著差异,因此,两者之间的鉴别诊断是至关重要的。尽管影像方法的进步和临床研究方法的改进使很多病例不再需要组织诊断,但细针穿刺(fine-needle aspiration,FNA)活检仍然是评估和诊断局灶性肝结节和肿块的重要方法。
通过对苏木精和伊红等特殊染色剂染色的标本进行显微镜观察进行组织学评估,对于肿瘤的病理诊断具有重要意义。然而,在某些情况下,仅通过组织学评估无法获得明确诊断,特别是标本取材较小时,免疫组化染色就尤其重要[2]。本文旨在探讨超声引导下FNA技术结合磷脂酰肌醇蛋白聚糖3(glypican-3,GPC-3)、精氨酸酶1(arginase-1,Arg-1)免疫组化染色在肝细胞性肝癌及其鉴别诊断中的作用。
1 材料与方法
1.1 一般资料本研究回顾性分析郑州大学第五附属医院2016年1月至2021年12月接受FNA的214例患者的病例资料,其中,男153例,女61例;年龄27~89岁,平均(58.6±11.1)岁。纳入标准:(1)影像学检查提示肝脏占位性病变,需要穿刺活检明确病变性质并鉴别诊断;(2)临床资料完整;(3)无凝血功能障碍。排除标准:(1)患者既往肝部肿瘤接受过放疗、全身化疗等;(2)有明显出血倾向,存在凝血功能障碍或大量腹水;(3)昏迷不能配合;(4)穿刺路径有感染病灶。所有患者在操作前签署知情同意书。
1.2 穿刺方法
1.2.1术前准备 所有患者术前完善影像学、血常规、凝血功能等检查,影像检查明确病变的具体位置、大小,以及邻近血管、器官,确定穿刺部位并在皮肤上做标记,确定最佳穿刺路径及穿刺角度。使用18G穿刺活检针行组织活检。
1.2.2超声引导穿刺活检 患者禁食水6 h,取仰卧位或侧卧位,常规消毒,铺巾,采用无菌塑料套包裹探头后再次确定进针点及穿刺路径,20 g·L-1利多卡因局部麻醉;超声引导下进针,针头到达腹膜时嘱患者屏住呼吸,术者持穿刺针刺入肝实质,到达病灶前沿后击发,拔出同轴针芯,活检针通过同轴外鞘从不同方向进行多次活检,取材结束后,在屏气状态下拔出同轴针。穿刺结束后,穿刺点消毒,无菌纱布覆盖固定,多头腹带加压包扎上腹部,卧床6 h以上,监测血压和心率。
1.3 免疫组化
1.3.1检测方法 采用质量浓度为100 g·L-1的中性甲醛溶液固定组织,常规脱水,石蜡包埋,制成4 μm切片,光镜下观察。采用EnVision两步法进行免疫组化染色,所用抗体GPC-3、Arg-1均购自福州迈新生物技术开发有限公司,DAB显色和实验步骤参照试剂盒说明书进行。用已知阳性组织作为阳性对照,采用PBS代替一抗作为阴性对照。
1.3.2结果判读 患者最终诊断结果以病理学诊断联合细胞学、影像学及血清肿瘤标志物等综合判断结果为准。所有切片均经2位以上高年资病理医生反复仔细阅片分析。随机选择5个高倍镜(400×)视野,每个视野计数200个肿瘤细胞,从染色强度和阳性细胞所占百分比综合判断。染色强度评分:无色(0分)、浅黄色(1分)、棕黄色(2分)、棕褐色(3分);阳性细胞百分比:无阳性细胞(0分),阳性细胞数<10%(1分),阳性细胞数10%~50%(2分),阳性细胞数>50%(3分)。两项得分相乘≥2分即判为阳性。
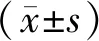
2 结果
2.1 GPC-3在不同组织中的表达Glypican-3阳性表达定位于胞浆和胞膜,偶尔呈核周强化,呈棕黄色(见图1)。110例肝细胞性肝癌中免疫细胞化学阳性89例(80.91%),64例肝脏转移癌中阳性3例(4.69%),40例肝脏非恶性肿瘤中,仅1例高度异型增生中见GPC-3局灶胞质内染色,低度异型增生及腺瘤中均未见着色。肝细胞性肝癌中GPC-3阳性率高于肝脏非恶性肿瘤和肝脏转移癌,差异有统计学意义(χ2=75.142、94.336,P<0.001)。见表1。
2.2 Arg-1在不同组织中的表达Arg-1阳性表达部位为胞浆和(或)胞核(见图1),110例肝细胞性肝癌中Arg-1免疫细胞化学阳性95例(86.36%),64例转移性肝癌中阳性仅1例(1.56%),40例肝脏非恶性肿瘤中Arg-1阳性表达97.50%(肝腺瘤、低度异型增生结节、高度异型增生结节中均显示肝细胞内有强烈的弥漫性胞浆反应)。肝脏非恶性肿瘤与肝细胞性肝癌中Arg-1阳性率比较,差异无统计学意义(P=0.070);肝细胞性肝癌中Arg-1阳性率高于转移癌,差异有统计学意义(χ2=117.641,P<0.001)。见表1。
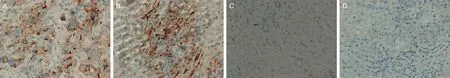
A为肝细胞性肝癌(GPC-3呈阳性,400×);B为肝细胞性肝癌(Arg-1呈阳性,400×);C为肝脏转移癌(GPC-3呈阴性,400×);D为肝脏转移癌(Arg-1呈阴性,400×)。
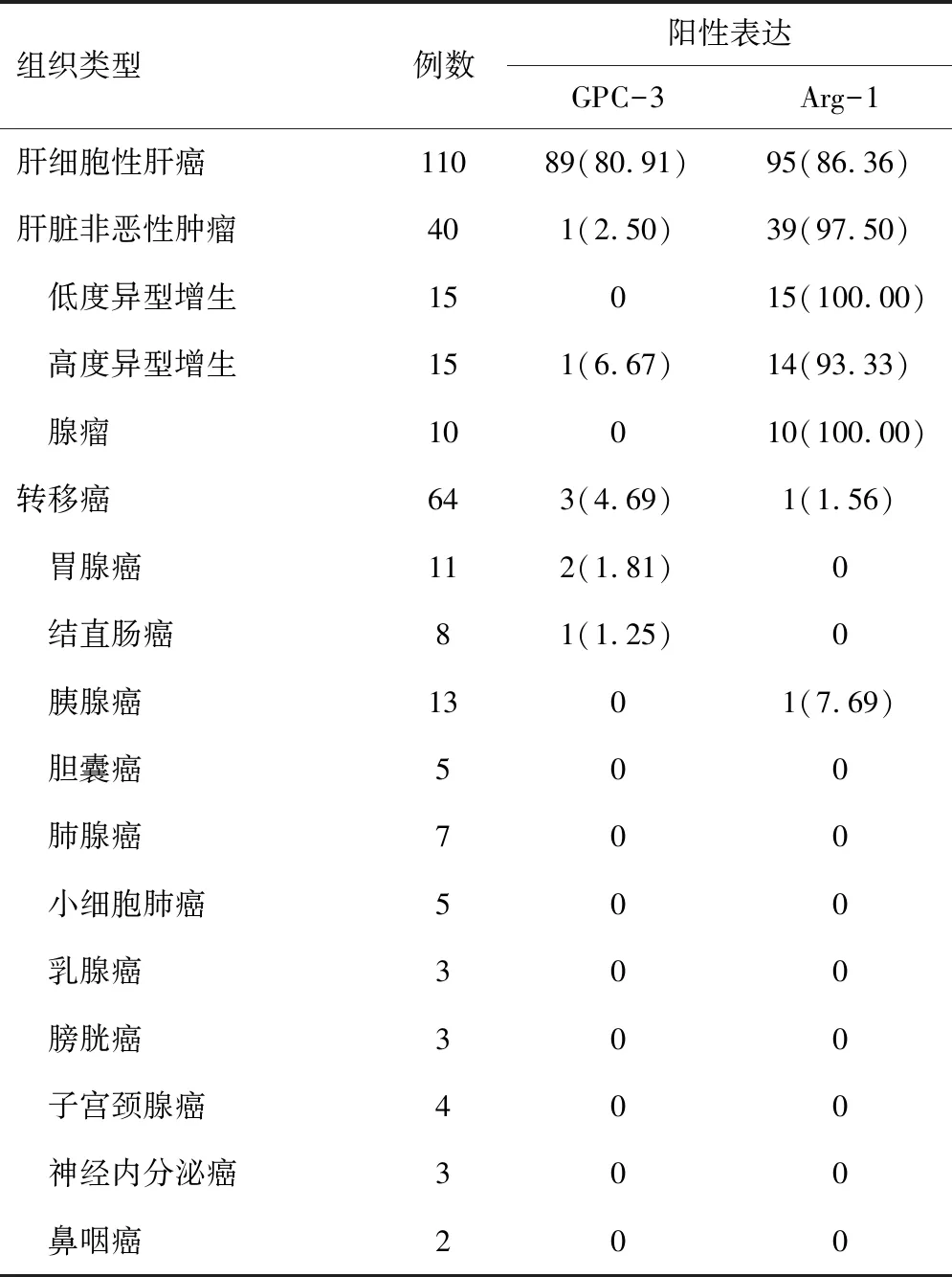
表1 GPC-3、Arg-1在不同组织类型中的表达率[n(%)]
2.3 GPC-3和Arg-1在不同分化程度肝细胞性肝癌中的表达110例肝细胞性肝癌中高分化36例(32.72%),中分化44例(40.00%),低分化30例(27.27%)。高中低分化肝细胞性肝癌中GPC-3的阳性表达率分别为66.67%,86.36%,90.00%,GPC-3在低分化肝细胞性肝癌中敏感度最高,高分化肝细胞性肝癌中敏感度最低,差异有统计学意义(χ2=7.180,P<0.05)。高中低分化肝细胞性肝癌中Arg-1的阳性表达率为100.00%,90.91%,63.33%,肿瘤分化程度越高,敏感度越高,差异有统计学意义(χ2=19.967,P<0.001)。
2.4 GPC-3和Arg-1在不同组织类型中对肝细胞性肝癌的诊断效能GPC-3在鉴别肝细胞性肝癌与非肝细胞性肝癌中的敏感度和特异度分别为80.91%、97.50%;Arg-1在鉴别肝细胞性肝癌与肝脏转移癌中的敏感度和特异度为86.36%、98.44%。见表2。

表2 GPC-3、Arg-1在不同组织中对肝细胞性肝癌的诊断效能(%)
3 讨论
肝细胞性肝癌是原发性肝癌中最常见的组织学类型,不同类型的肝脏占位病变的治疗方法和预后也不尽相同,如对肝细胞性肝癌常采用手术切除、射频消融、肝移植等方式[3],而转移癌要依据原发肿瘤的恶性程度、部位、患者全身情况等制定治疗方案,因此,诊断和鉴别肝细胞性肝癌与肝脏转移癌、肝脏非恶性肿瘤等对于有效的疾病治疗和预后评估是极其重要的。目前临床上常用的血清标志物、影像学等检查手段对于肝癌的诊断有一定的价值,尤其是随着影像技术的进步,微小肝癌检出率逐渐增高[2],然而,对于临床和影像学特征不典型的病例,病理学检查仍然是诊断的金标准。
在CT或超声引导下进行的经皮肝脏穿刺活检是一种创伤小、高效、低成本的诊断方法,经皮肝脏穿刺活检结合细胞病理学评估在肝脏占位性病变中的诊断作用被广泛认可[4-5]。有研究表明,经皮肝脏穿刺活检诊断恶性肿瘤的敏感度为67%~100%,特异度超过95%[6-8]。许多免疫组化标志物可用于确定肝细胞性肝癌的诊断,如甲胎蛋白、肝细胞石蜡抗原、多克隆癌胚抗原、Ki-67等,但这些肿瘤标志物诊断肝细胞性肝癌都有其局限性,尤其是在FNA活检时,穿刺的肿瘤组织有限,上述标志物表现出较低的敏感度,在应用于诊断时具有很大的挑战,而GPC-3和Arg-1近几年来被认为是鉴别诊断肝细胞性肝癌敏感度较高的标志物[9]。
GPC-3是一种膜性硫酸乙酰肝素多糖蛋白,通过磷脂酰肌醇锚定在细胞膜上,在机体的生长、发育中起重要作用[10]。GPC-3通常在胎盘组织、成人卵巢、乳腺、间皮细胞、肺和肾脏中正常表达,在健康成人的肝脏中表达缺失,但GPC-3蛋白在肝癌组织中高表达[11-12],在肝细胞性肝癌组织中,GPC-3通过增加细胞膜上的Wnt蛋白的表达,再与其受体Frizzled形成复合物从而激活Wnt信号通路,该通路的异常激活促进肿瘤细胞增殖[13]。国内外研究报道,GPC-3在63%~91%的肝细胞性肝癌组织中表达[14-17]。本研究纳入214例异常肝组织,采用免疫组织化学法检测到GPC-3在肝细胞性肝癌中阳性表达率为80.91%,与上述文献报道一致。Timek等[16]的研究结果显示,GPC-3在鉴别肝细胞性肝癌与肝转移癌中的敏感度、特异度分别为83.00%、96.70%。本研究的敏感度、特异度为80.91%、95.31%,由此可见,GPC-3对于鉴别肝细胞性肝癌与转移癌有较高的敏感度和特异度;GPC-3在鉴别诊断肝细胞性肝癌与肝脏非肿瘤性病变方面亦有一定的应用价值。本研究发现GPC-3在鉴别诊断肝细胞性肝癌与肝脏非恶性肿瘤的敏感度、特异度为80.91%、97.50%,因此,GPC-3在鉴别肝脏良恶性结节中也表现出较高的敏感度和特异度,但GPC-3免疫反应也可以是局灶性的。免疫染色阴性不能排除肝细胞癌的诊断,还需结合临床、生化、影像学检查结果综合判定。GPC-3不仅是一种高度特异的诊断肝细胞性肝癌的生物标志物,同时也是肝细胞性肝癌免疫治疗的有效靶点。目前,使用人源化抗GPC-3细胞毒抗体、治疗肽/DNA疫苗、免疫毒素疗法和基因疗法正表现出很好的发展前景[10]。
精氨酸有两种不同的亚型,分别为精氨酸酶-1(Arg-1)和精氨酸酶-2(Arg-2),他们催化相同的生化反应,但在细胞表达、调节和定位方面不同。Arg-1是一种催化精氨酸在尿素循环中水解为鸟氨酸和尿素的酶,正常情况下主要在肝细胞中表达,在肝尿素循环中扮演着重要角色;Arg-2是一种线粒体酶,主要在肾、小肠、前列腺、乳腺和巨噬细胞中表达[18-19]。有研究表明,Arg-1对于肝细胞性肝癌的诊断具有较高的敏感度和特异度,尤其是在高分化肝细胞性肝癌中,是肝组织标志物的最佳选择,敏感度在79%~100%[20-24]。本研究发现,Arg-1在86.36%的肝细胞性肝癌中表达,与文献报道基本一致,在肝脏转移癌中,仅1例胰腺癌中Arg-1局灶表达,余转移癌均未检测到Arg-1阳性表达。Atta和Fujiwara等[22-23]也报道了这一现象,即在胰腺癌中检测到Arg-1局灶弱阳性表达。Yan等[21]及其团队在1例前列腺癌和1例胆管癌中检测到Arg-1阳性表达。这些结果都证实了Arg-1是肝脏分化的一个高度敏感的标志物,并且在鉴别诊断肝细胞性肝癌与肝脏转移癌表现出高的敏感度和特异度。
目前肝细胞癌病理诊断的主要困难包括:(1)异型增生结节、腺瘤等非恶性肿瘤与分化良好的肝细胞性肝癌的鉴别;(2)低分化肝细胞性肝癌与转移癌的鉴别。GPC-3对于以上两个问题的解决均有帮助,而Arg-1在腺瘤等良性肝细胞和肝细胞性肝癌中均有表达,因此它只对鉴别低分化肝细胞性肝癌与转移癌有意义。在实际工作中,应联合应用不同的免疫组化抗体组合,并结合临床表现、生化、影像等检查综合判定,以提高诊断的准确性。
