5-磷酸核糖醇转移酶fukutin抑制HeLa细胞中α-dystroglycan的分泌
2022-11-03李彩红朱昉修范礼斌
周 恒,乔 兵,李彩红,李 强,朱昉修,范礼斌
抗肌萎缩相关糖蛋白(dystroglycan,DG)由α和β两个亚基构成[1],位于胞外的α亚基通过与跨膜的β亚基非共价连接,而将胞外基质组分(如层粘连蛋白)与胞内组分(如dystrophin)连接起来[2]。研究[2]表明α-DG在中枢神经系统的结构和功能、上皮的形态发生、细胞黏附、突触的发生和信号转导等方面发挥重要作用。
研究[3]表明α-DG的结构和功能与该蛋白复杂的糖基化修饰密切相关。FKTN是5-磷酸核糖醇转移酶家族成员之一,可将5-磷酸核糖醇共价连接到α-DGO-糖基化的M3核心,而fukutin相关蛋白(fukutin-related protein,FKRP)将5-磷酸核糖醇添加到前一个5-磷酸核糖醇后,后续的糖基转移酶在串联的5-磷酸核糖醇上继续延伸糖链[4]。α-DG的杂多糖链上的木糖-葡萄糖醛酸二糖重复单元是许多胞外基质蛋白结合的区域,而5-磷酸核糖醇是这个重复结构形成的必不可少的引物[4]。课题组拟通过在HeLa细胞中过表达FKTN后探究其对细胞周期、凋亡、迁移和α-DG分泌的影响。
1 材料与方法
1.1 细胞、菌株和质粒HeLa细胞、TG1菌株、pcDNA3.1载体、质粒pcDNA3.1-α-DAG-FLAG为范礼斌课题组保存[5],质粒pcDNA3.1-FKTN-3xFlag购自湖南优宝生物科技有限公司(货号:F138577)。
1.2 主要仪器BSC-Ⅱ级生物安全柜(1300)、微量核酸检测仪[赛默飞世尔科技(中国)有限公司];小型梯度PCR仪、电泳仪(美国伯乐生物科技有限公司);全自动化学发光成像仪、小型垂直转移槽(上海天能生物科技有限公司);倒置显微镜(日本奥林巴斯株式会社);CytoFLEX流式细胞仪、高速冷冻离心机[贝克曼库尔特商贸(中国)有限公司];光吸收酶标仪[美谷分子仪器(上海)有限公司]。
1.3 主要试剂胎牛血清(美国Clark Bioscience公司);Opti-MEM[赛默飞世尔科技(中国)有限公司];Lipo8000TM转染试剂、苯甲基磺酰氟(PMSF)、胰酶细胞消化液(含EDTA)、Western细胞裂解液、一抗稀释液(上海碧云天生物技术有限公司);蛋白酶抑制剂混合物(美国MedChemExpress);改良型Bradford法蛋白浓度测定试剂盒、EcoRⅠ、XbaⅠ限制性内切酶、T4连接酶(上海生工生物有限公司);DNA聚合酶[宝日医生物技术(北京)有限公司];胶回收、质粒提取试剂盒(广州飞扬生物工程有限公司);PI染液(美国BD Biosciences);Annexin Ⅴ-FITC细胞凋亡试剂(上海贝博生物科技有限公司);0.2 μm PVDF膜(美国伯乐生物科技有限公司);WGA-agarose(美国Vector Laboratories);FLAG抗体[西格玛奥德里奇(上海)贸易有限公司];HA抗体[圣克鲁斯生物技术(上海)有限公司];GAPDH抗体(武汉三鹰生物技术有限公司);IIH6 C4抗体(美国爱荷华大学Campbell, K.P教授赠送);辣根过氧化物酶标记山羊抗鼠IgG(北京中杉金桥生物技术有限公司);辣根过氧化物酶标记山羊抗鼠IgM(北京博奥森生物技术有限公司)。
1.4 方法
1.4.1质粒构建 PCR引物由通用生物系统(安徽)有限公司合成,α-DAG-HA正向引物序列:GGAATTCCGCCACCATGAGGATGTCTGT,反向引物序列:GCTCTAGAGCTTAAGCGTAATCTGGAACATC-GTATGGGTAGCCCCGGGTGATATTCT。以pcDNA3.1-α-DAG-FLAG质粒为模板,PCR扩增出含HA标签的α-DAG,将PCR产物进行琼脂糖凝胶电泳,使用胶回收试剂盒进行回收,得到其PCR纯化产物。使用EcoRⅠ、XbaⅠ限制酶分别酶切PCR纯化产物和pcDNA3.1载体,用T4连接酶将两者的酶切产物进行连接。连接产物转化至TG1感受态细胞中,37 ℃培养约10 h,分别挑取数个单克隆进行扩大培养约12 h,提取质粒后,用EcoRⅠ和XbaⅠ进行酶切鉴定,最后将酶切正确的重组质粒送通用生物系统(安徽)有限公司进行测序。
1.4.2细胞培养与转染 用完全培养基(10%FBS+90%DMEM高糖培养基+100 U/ml青霉素+ 100 μg/ml链霉素)于37 ℃、5% CO2的恒温培养箱中培养HeLa细胞,待细胞生长至90%汇合度时即可进行细胞传代。提前一天接种1.5×106个HeLa细胞至6 cm培养皿中,使第2天细胞汇合度为70%~90%。取一个无菌的离心管,加入250 μl Opti-MEM,加入5 μg质粒和8 μl Lipo8000TM转染试剂,混合后加至培养皿中,培养至48 h时用于后续实验。
1.4.3流式细胞术检测细胞周期 将pcDNA3.1-FKTN-3xFlag转染至HeLa细胞中,培养48 h后收集细胞沉淀。用预冷的PBS清洗后,加入500 μl预冷的70%乙醇并-20 ℃固定过夜。离心后用预冷的PBS清洗,再加入500 μl PI染液,4 ℃避光孵育15 min后,流式细胞仪检测细胞周期,FlowJo软件用于分析细胞周期各时相百分比。
1.4.4流式细胞术检测细胞凋亡 将pcDNA3.1-FKTN-3xFlag转染至HeLa细胞中,培养48 h后收集细胞沉淀。用预冷的PBS清洗后,加入400 μl Annexin V结合液使细胞悬浮(密度大约为106/ml)。再加入5 μl Annexin V-FITC染色液,4 ℃避光孵育15 min,最后加入10 μl PI染色液,4 ℃避光孵育5 min后立即用流式细胞仪检测细胞凋亡,用Flow Jo软件分析凋亡率。
1.4.5细胞划痕实验 先用笔在12孔板背后均匀划3条横线,每条线间隔0.5 cm横穿过孔,接种3.5×105个HeLa细胞至12孔板中,第2天细胞单层铺满。将pcDNA3.1-FKTN-3xFlag和pcDNA3.1分别转染至HeLa细胞中(设置复孔),转染6~8 h后用100 μl枪头垂直于背面的横线于汇合完全的单细胞层中划线。用PBS清洗后,加无血清培养基。显微镜下观察并记录,此为0 h,继续培养至24 h时观察并记录。
1.4.6WGA富集实验 将相关质粒分别转染至HeLa细胞中,培养48 h后收集培养液,立即放置冰上并加入PMSF和蛋白酶抑制剂混合物。离心后取少量上清液用于改良型Bradford试剂盒测定总蛋白浓度,其余加入10 μl WGA-agarose,4 ℃孵育过夜。上述溶液离心后,沉淀用清洗液(PBS+0.1% TritonX-100)清洗,沉淀用于Western blot检测。
1.4.7Western blot法检测蛋白表达 SDS-PAGE后的凝胶用电转仪(252 mA恒流1.5 h)将目的蛋白转移到PVDF膜上。膜置于5%脱脂牛奶中室温封闭1.5 h,然后分别于相应的一抗(稀释比为1 ∶1 000)4 ℃孵育过夜,二抗(稀释比为1 ∶2 500)室温孵育1.5 h,用ECL试剂盒进行显色,再用化学发光仪拍摄。

2 结果
2.1 真核表达质粒构建将构建的pcDNA3.1-α-DAG-HA质粒进行酶切鉴定,酶切鉴定正确的质粒送通用生物系统(安徽)有限公司测序。结果表明:构建的质粒含有插入片段(图1A泳道2、3、4),测序结果显示载体上的插入片段是正确的(图1B)。
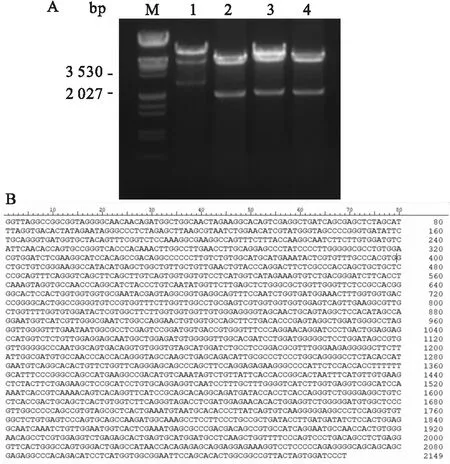
图1 pcDNA3.1-α-DAG-HA重组质粒的酶切鉴定与测序结果A:pcDNA3.1-α-DAG-HA重组质粒酶切鉴定图;1:pcDNA3.1-DAG1-HA酶切产物;2~4:pcDNA3.1-α-DAG-HA酶切产物;M:Marker;B:pcDNA3.1-DAG1-HA测序结果图
2.2 HeLa细胞过表达FKTNHeLa细胞转染FKTN后,进行Western blot检测。结果显示:FKTN可见相应的目的条带,而对照组未见任何条带,表明FKTN在HeLa细胞中可表达(图2泳道3)。
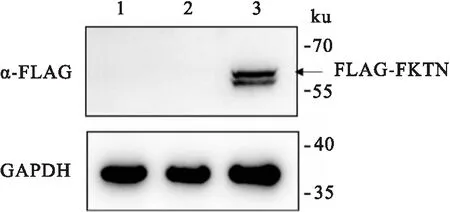
图2 FKTN在HeLa细胞中的过表达1:未转染的HeLa细胞裂解液;2:转染pcDNA3.1的HeLa细胞裂解液;3:转染pcDNA3.1-FKTN-3xFlag的HeLa细胞裂解液
2.3 FKTN阻滞细胞周期HeLa细胞过表达FKTN后,使用流式细胞仪检测细胞周期(表1)。结果显示:与对照组相比,FKTN过表达组S期百分比下降(P<0.001),G2期百分比升高(P<0.05),G1期百分比无变化(P>0.05)。表明过表达的FKTN使HeLa细胞S期减少、G2期增加,因而阻滞了细胞周期(图3)。
表1 FKTN对细胞周期各时相平均百分比的影响
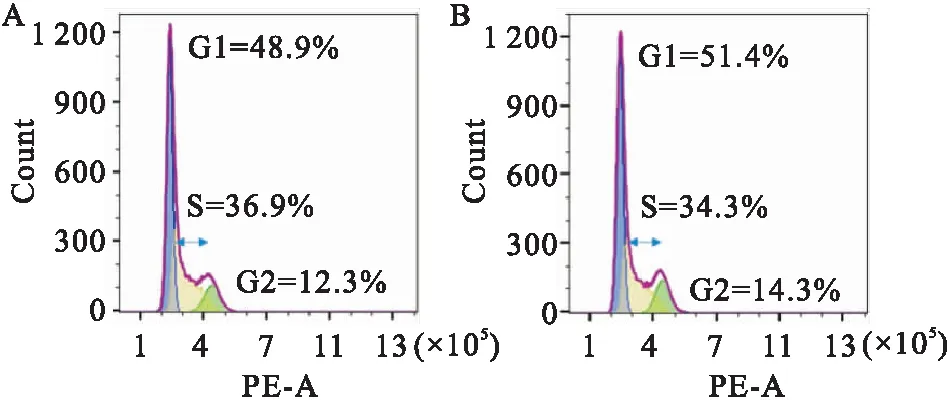
图3 FKTN过表达后HeLa细胞的细胞周期图A:转染pcDNA3.1的对照组;B:转染pcDNA3.1-FKTN-3xFlag的过表达组
2.4 FKTN对细胞凋亡的影响HeLa细胞过表达FKTN后,使用流式细胞仪检测凋亡情况(表2)。结果显示:与对照组相比,FKTN过表达组细胞凋亡率无变化(P>0.05)。表明FKTN对HeLa细胞凋亡无影响(图4)。
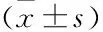
表2 FKTN对细胞凋亡的影响
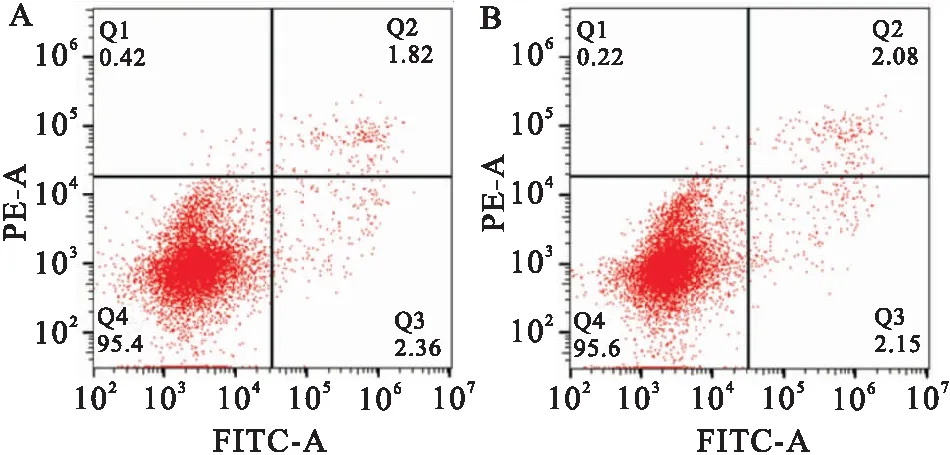
图4 FKTN过表达后HeLa细胞的凋亡情况A:转染pcDNA3.1的对照组;B:转染pcDNA3.1-FKTN-3xFlag的过表达组
2.5 FKTN对细胞迁移的影响HeLa细胞过表达FKTN后,采用细胞划痕实验检测细胞迁移速率。S0表示0 h时两条线之间的面积,S24表示24 h时两条线之间的面积,迁移速率=(S0-S24)/S0。结果显示:与对照组相比,FKTN过表达组细胞迁移速率无变化(P>0.05),如表3所示。表明FKTN对HeLa细胞迁移无影响(图5)。

图5 FKTN过表达后HeLa细胞的迁移图 ×100
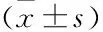
表3 FKTN对细胞迁移的影响
2.6 FKTN对α-DG分泌的影响HeLa细胞过表达pcDNA3.1-FKTN-3xFlag和pcDNA3.1-α-DAG-HA,pcDNA3.1和pcDNA3.1-α-DAG-HA后,进行WGA富集实验和Western blot。结果显示:细胞培养液中与对照组相比,FKTN过表达组α-DG分泌量减少(图6A泳道2、3)。细胞裂解液孵育HA抗体后,对照组和FKTN过表达组均有目的条带,但HA-α-DG表达量无变化(图6B泳道5、6);孵育IIH6 C4抗体(此抗体特异性识别α-DG的糖链)后,FKTN过表达组α-DG糖基化程度高于对照组(图6B泳道5、6)。表明在HeLa细胞中过表达FKTN促进α-DG糖基化,抑制α-DG分泌(图6)。
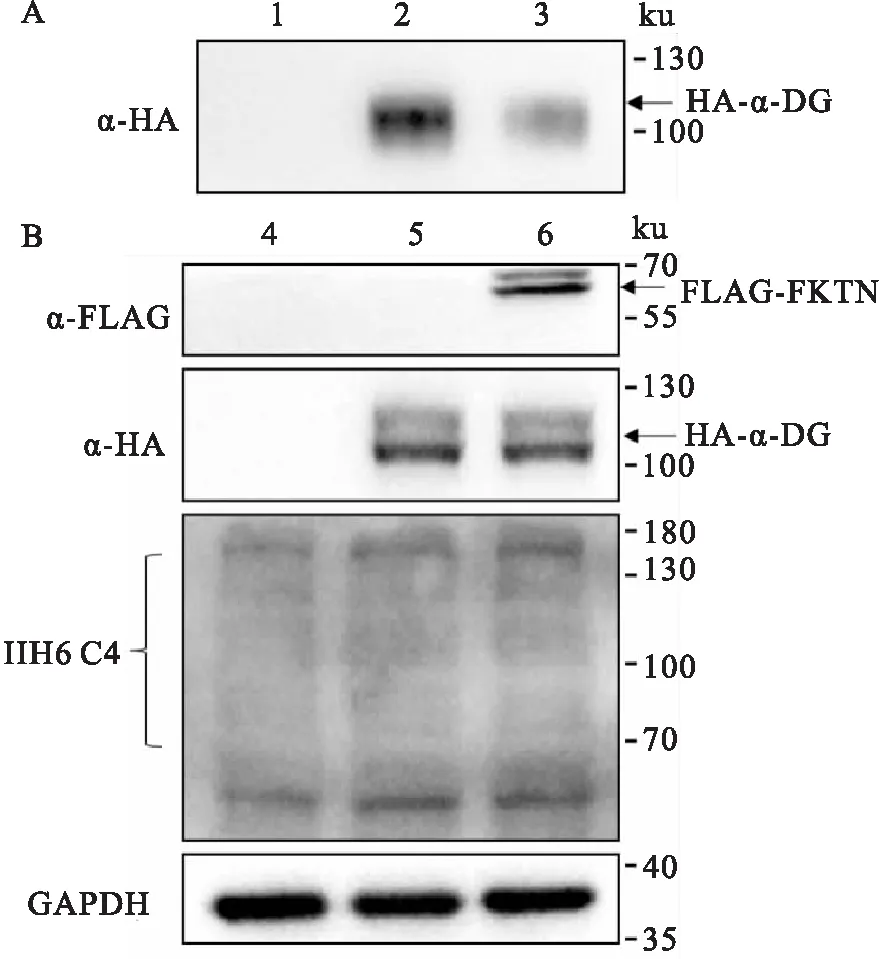
图6 FKTN过表达对α-DG分泌的影响A:过表达FKTN后分泌的α-DG;1:转染pcDNA3.1的HeLa细胞培养液;2:转染pcDNA3.1和pcDNA3.1-α-DAG-HA的HeLa细胞培养液;3:转染pcDNA3.1-FKTN-3xFlag和pcDNA3.1-α-DAG-HA的HeLa细胞培养液;B:过表达FKTN后细胞裂解液中α-DG及其相关蛋白;4:转染pcDNA3.1的HeLa细胞裂解液;5:转染pcDNA3.1和pcDNA3.1-α-DAG-HA的HeLa细胞裂解液;6:转染pcDNA3.1-FKTN-3xFlag和pcDNA3.1-α-DAG-HA的HeLa细胞裂解液
3 讨论
肿瘤进展的标志是侵袭和转移,肿瘤细胞为了远处转移,必须先从基膜中释放出来[6]。细胞与细胞或基质之间的黏附对于细胞增殖、迁移、分化以及组织的稳定性具有关键性作用[7],典型的黏附分子包括整合素(integrin)和DG。位于胞外的α-DG是高度糖基化的受体,它与胞外基质配体和跨膜的β抗肌萎缩相关糖蛋白(β-dystroglycan,β-DG)结合从而紧密连接基膜与细胞膜[7]。FKTN是福山型先天性肌营养不良病的致病基因,这种疾病属于常染色体隐性遗传病,患者表现为先天性肌无力、小脑发育不全以及严重的智力缺陷[8]。FKTN的功能可能是通过影响α-DG的糖基化从而对细胞的功能(如迁移)产生影响,siRNA抑制FKTN表达后,星形细胞瘤细胞系出现明显的胞质突起[9]。
FKTN与细胞增殖的关系已经有报道。例如在胃癌细胞系中siRNA抑制FKTN表达后,细胞增殖能力下降[10]。在星形胶质细胞中,FKTN与激活蛋白1(activator protein-1,AP1)结合,从而促进cyclin D1表达,有利于细胞增殖[11]。而稳定表达DG的乳腺癌细胞中,细胞周期阻滞在G0/G1期,且α-DG表达量无明显变化,β-DG表达水平明显增加[12]。本研究表明过表达FKTN后,HeLa细胞的细胞周期S期百分比下降,阻滞细胞周期进程。在不同的细胞中FKTN对细胞增殖的影响不同,可能与组织和细胞类型的特异性有关。在前列腺癌和乳腺癌细胞中,β3-N-乙酰氨基葡萄糖基转移酶1(β3-N-acetylglucosaminyltransferase 1,β3GnT1)与类乙酰氨基葡萄糖基转移酶(like acetylglucosaminyltransferase,LARGE)结合共同调节α-DG糖基化,随后糖基化的α-DG与laminin的相互作用可拮抗胞外基质组分诱导的ERK/AKT磷酸化,从而抑制肿瘤细胞迁移,抑制肿瘤形成[13]。本研究虽然表明过表达FKTN后,细胞迁移速率增加,但差异无统计学意义(图5)。
目前暂无文献描述FKTN与细胞凋亡之间的关系,但5-磷酸核糖醇转移酶家族的另一成员FKRP与细胞凋亡密切相关。在FKRP基因突变患者的多功能干细胞来源的肌管细胞中,ERK1/2活性降低,细胞凋亡增加[14]。本研究表明在HeLa细胞中过表达FKTN后,细胞凋亡率无变化(图4)。DG在胞内合成后,被内质网及高尔基体中的一系列糖基转移酶修饰,从而成为细胞膜中的α-DG和β-DG或分泌到胞外(α-DG)[2]。WGA富集实验常用来分离、鉴定糖基化的α-DG[15]。本研究用此方法富集了HeLa细胞和培养液,并分析胞内和分泌的α-DG的含量,结果表明过表达的FKTN抑制α-DG的分泌。
综上所述,本研究表明在HeLa细胞中过表达FKTN阻滞细胞周期,抑制α-DG分泌,但对细胞凋亡和细胞迁移无影响。
