右美托咪定对铁超载诱导的小鼠海马神经元损伤的保护作用
2022-11-03王京燕钟薇薇鲁显福李元海
丁 慧,王京燕,黄 艳,钟薇薇,鲁显福,李元海,
铁死亡[1]是依赖铁的脂质过氧化物积累到毒性水平导致细胞死亡的非凋亡的程序性死亡,铁是否过量是铁死亡发生的关键[2]。脑中铁沉积足以引发脑出血[3],免疫组化检测显示脑内的铁沉积随年龄增加[4]。脑铁水平过高会引起脂质氧化水平升高造成神经中毒[5]。mTOR(mammalian target of rapamycin)可以调节转铁蛋白受体1 (transferrin receptor1,TFR1)的稳定性,维持细胞内铁的平衡状态[6]。在脑出血疾病的发病机制中发现mTOR介导的铁代谢的证据,缺失会引起铁代谢紊乱,引起氧化应激,产生细胞毒性。
右美托咪定(dexmedetomidine, Dex)作为高选择性α2肾上腺素能受体激动剂,能改善神经退行性疾病和脑外伤中的氧化应激水平的异常增高[7]。小鼠海马神经元(hippocampal neurons, HT22)作为中枢神经执行认知功能的神经元易受到应激刺激—尤其是铁离子刺激,诱发氧化应激引起铁死亡,导致神经系统疾病的发生[8]。该研究拟探讨Dex对铁超载造成的HT22细胞损伤的保护作用及其机制,为麻醉药物治疗神经系统疾病提供实验依据。
1 材料与方法
1.1 细胞与主要试剂小鼠海马神经元细胞系、HT22专用完全培养基购自中国武汉普诺赛(Procell)生命科技有限公司;0.25%胰酶消化液购自Gibco公司;右美托咪定购自扬子江药业(集团)有限公司;DHE荧光探针购自yeasen公司;丙二醛 (malondialdehyde,MDA)试剂盒购自碧云天生物技术研究所;Mito-FerroOrange亚铁离子探针购自日本Dojindo分子技术有限公司;兔抗长链酯酰辅酶A合成酶4(acyl-CoA synthetase long-chain family member 4,ACSL4)、兔抗TFR1、兔抗mTOR购自美国Abcam公司。兔抗p-mTOR、抗β-actin和抗前列腺素内过氧化物合酶2 (prostaglandin-endoperoxide synthase 2,PTGS2)抗体、山羊抗兔免疫球蛋白(IgG)辣根过氧化物酶(HRP)二抗购自中国武汉爱博泰克(Abclonal)生物科技有限公司。mTOR、TFR1、ACSL4、PTGS2 和 GAPDH 引物由中国安徽通用生物科技公司合成。
1.2 仪器荧光倒置显微镜(德国Zeiss公司);Centrifuge 5424 R冷冻离心机(德国eppendorf公司);Synergy2酶标仪(美国BioTek仪器公司);Bioshine ChemiQ化学发光成像系统、CFX Connect 实时定量 PCR 仪(美国Bio-Rad公司); Talos L120C G2透射电子显微镜(美国Thermoscientific公司)。
1.3 方法
1.3.1细胞分组 HT22细胞随机分为4组:① 对照组(Ctrl组):HT22细胞使用HT22细胞专用培养基进行培养;② FAC处理组(FAC组):使用终浓度为125 μmol/L的FAC处理HT22细胞后培养24 h;③ Dex处理组(Dex组):使用终浓度为5 μmol/L Dex预处理HT22细胞2 h后,使用终浓度为125 μmol/L FAC处理HT22细胞后培养24 h;④ 铁死亡抑制剂Fer-1处理组(Fer-1组):使用终浓度为1 μmol/L Fer-1预处理HT22细胞2 h后,使用终浓度为125 μmol/L FAC处理HT22细胞后培养24 h。
1.3.2CCK-8法检测HT22细胞活力 选取对数生长期的HT22细胞,以1×104个/孔接种于96孔板上,培养12 h后,加入不同浓度Dex (0.2、1、5、25 μmol/L),此外设置对照组(Ctrl组)和空白组(等量细胞培养基和CCK-8试剂),每孔再设置4个复孔。置于细胞培养箱中孵育12 h后,每孔加入10 μl CCK-8试剂(每孔内加入100 μl培养基),于培养箱中孵育2 h后使用酶标仪在450 nm处测量吸光度(absorbance, A)值,以此计算各孔的细胞相对存活率。相对存活率=(A实验组-A空白组)/(A对照组-A空白组),实验重复3次。
1.3.3Western blot法检测蛋白表达 HT22细胞以1×105个/孔接种于6孔板,培养12 h后,按照上述实验分组方法加入药物处理。制取样品,经PBS冲洗2次,加入含有蛋白酶抑制剂和磷酸酶抑制剂的细胞裂解液,冰上裂解30 min,细胞刮刮下细胞,置于1.5 ml EP管中,12 000 r/min离心30 min。取上清液,将蛋白样品与5×SDS上样缓冲液按1 ∶4体积混合,100 ℃煮沸10 min变性,使温度降至室温。以每孔10 μl的蛋白样品量进行蛋白电泳,将蛋白转至PVDF膜上,使用5%脱脂奶粉室温封闭2 h,TBST洗涤3次,每次10 min。PTGS2、ACSL4、p-mTOR、mTOR、TFR1抗体按1 ∶1 000稀释,置于4 ℃过夜后,使用TBST洗涤3次,每次10 min。加入1 ∶10 000稀释的二抗室温孵育1 h,使用ECL发光试剂盒显影。
1.3.4qPCR检测PTGS2和ACSL4表达水平 HT22细胞以1×105个/孔接种于6孔板,培养12 h后,按照上述实验分组方法加入药物处理。制取样品,加入RNA裂解液裂解30 min,吹下细胞转至无酶EP管中,加入氯仿萃取,12 000 r/min离心30 min。取上清液加入等量异丙醇,置于-20 ℃助沉2 h。随后12 000 r/min离心15 min得到RNA沉淀,洗涤干燥后定量,随后加入Mix进行逆转录合成cDNA。根据仪器的操作说明,利用特异性引物对单个细胞样本的cDNA进行qPCR扩增。以β-actin作为内参,比较分析各组mRNA的表达,见表1。采用最优稀释和熔化曲线,以确保每一套引物扩增产物的特异性。所有表达式均使用2-ΔΔCt方法计算。数据分析使用qBase+ (Version 3.0, Bio Gazelle, Gent, Belgium)。
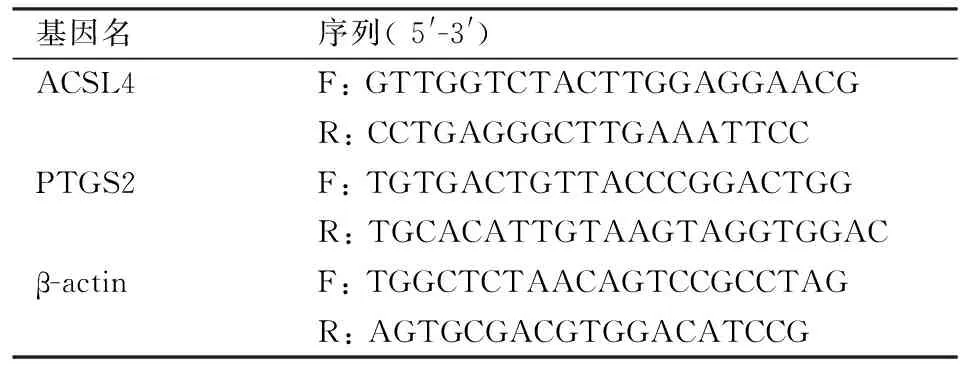
表1 引物序列
1.3.5MDA试剂盒测定脂质过氧化产物 将HT22细胞以1×105/孔接种在6孔板上,培养12 h后, 按照上述实验分组方法加入药物处理,置于37 ℃、5%CO2细胞孵育箱内孵育24 h,收集细胞至EP管中,1 200 r/min离心10 min,取上清液于冰上待测,吸取300 μl上清液于96孔板,使用酶标仪在532 nm处检测细胞的吸光度,根据标准曲线计算MDA浓度。
1.3.6DHE免疫荧光染色检测ROS生成 将HT22细胞以1×105/孔接种在6孔板上,培养12 h后,按照上述细胞分组方法加入药物处理,置于37 ℃、5%CO2细胞培养箱中孵育24 h后,使用PBS洗2次,将终浓度为10 μmol/L的DHE荧光染料加到PBS中,放入细胞培养箱中孵育30 min后用倒置荧光显微镜进行观察并拍照。选择Image J软件进行荧光半定量分析,实验重复3次,对结果进行统计学分析。
1.3.7Mito-FerroOrange荧光探针检测细胞内Fe2+的变化 以1×105/孔接种在6孔板上,培养12 h后, 按照上述细胞分组方法加入药物处理。使用DMSO将Mito-FerroOrange荧光探针溶解为1 μmol/L的储存液,于6孔板上处理细胞,使用HBSS洗3次后,每孔加入储存液使其终浓度为1 μmol/L,于培养箱孵育30 min后,置于共聚焦显微镜下观察各组的荧光强度。
1.3.8电镜检测细胞超微结构的变化 将HT22细胞以1×106个/孔接种于培养瓶中,培养12 h至细胞汇集到80%~90%,按上述实验分组方法处理后孵育24 h,提取电镜样品,细胞刮刮下细胞置于EP管中,1 500 r/min离心5 min,加入戊二醛固定液固定细胞沉淀。将标本置于电镜下观察各组线粒体嵴、线粒体膜密度及细胞核的变化。
1.3.9低表达mTOR 时TFR1蛋白水平变化 将HT22细胞随机分为3组:① 对照组(Ctrl组):HT22细胞使用HT22细胞专用培养基进行培养;② FAC处理组(FAC组):使用终浓度为125 μmol/L FAC处理HT22细胞后培养24 h;③ FAC+AZD8055组:使用终浓度为125 μmol/L FAC和终浓度为80 nmol/L AZD8055处理HT22细胞后培养24 h。根据1.3.3项方法,使用Western blot检测p-mTOR和TFR1的蛋白表达水平。
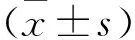
2 结果
2.1 Dex对FAC暴露下HT22细胞存活率的影响CCK-8实验表明,0.2、1、5 μmol/L Dex对HT22细胞活力有促进作用,而25 μmol/L Dex作用不显著(F=13.31,P<0.05),见图1A。FAC降低HT22细胞的活力,而1、5 μmol/L Dex预处理抑制了HT22细胞活力的降低(F=0.57,P<0.05) ,见图1B。因此选取5 μmol/L Dex作为后续实验剂量。
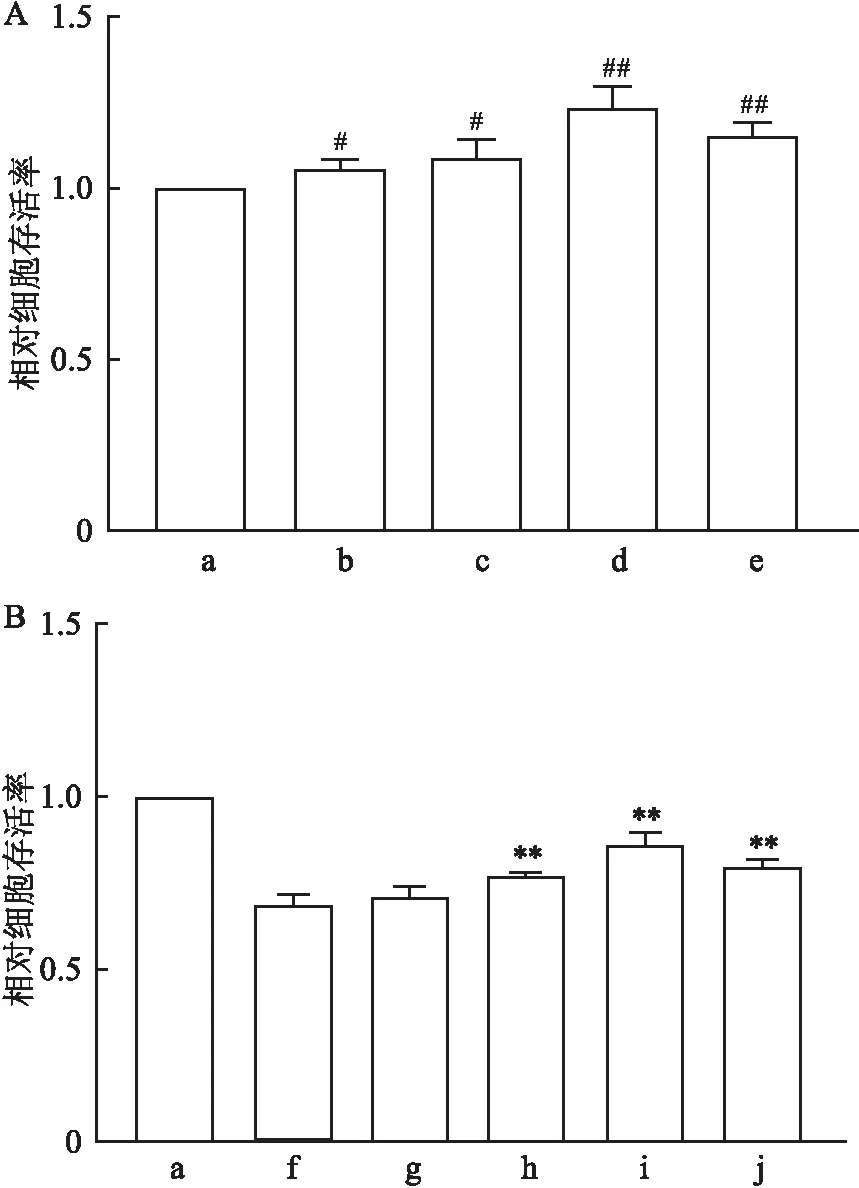
图1 Dex对FAC暴露下HT22细胞存活率的影响A:CCK-8法检测不同浓度Dex处理后细胞存活率;B:CCK-8法检测Dex预处理细胞后加入FAC的细胞存活率;a:Ctrl组;b-e:0.2、1、5、25 μmol/L Dex组;f:FAC组;g:0.2 μmol/L Dex + FAC组;h: 1 μmol/L Dex+ FAC组;i:5 μmol/L Dex+ FAC组;j:25 μmol/L Dex+ FAC组;与Ctrl组比较:#P<0.05,##P<0.01;与FAC组比较:*P<0.05,**P<0.01
2.2 Dex抑制FAC引起HT22细胞发生铁死亡使用FAC处理HT22细胞24 h后,与Ctrl组相比,FAC组铁死亡标志性蛋白PTGS2和ACSL4蛋白表达明显升高,与FAC组比较,Dex组PTGS2和ACSL4蛋白表达下降,这一变化与Fer-1组一致(P<0.05),见图2A,且FAC组PTGS2和ACSL4的mRNA表达水平相比于Ctrl组也显著增加,与FAC组比较,Dex组PTGS2和ACSL4的 mRNA表达水平下降,这一变化与Fer-1组一致(P<0.05),见图2B。
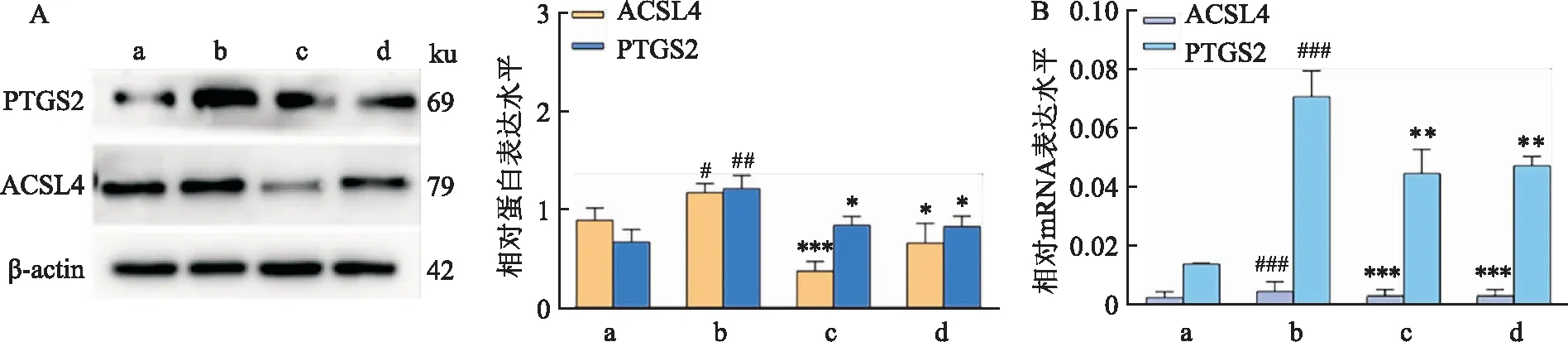
图2 Dex抑制FAC引起HT22细胞发生铁死亡A:Western blot法检测HT22细胞PTGS2、ACSL4的表达;B:qPCR法检测HT22细胞PTGS2、ACSL4的mRNA表达;a:Ctrl组;b:FAC组;c:Dex+FAC组;d:Fer-1+FAC组;与Ctrl组比较:#P<0.05,##P<0.01,###P<0.001;与FAC组比较:*P<0.05,**P<0.01,***P<0.001
2.3 Dex降低HT22细胞内ROS水平细胞内ROS的水平增高会引起细胞发生氧化应激。DHE荧光探针染色可检测细胞内ROS水平,使用125 μmol/L FAC处理HT22细胞24 h后,相较于Ctrl组,FAC组ROS水平升高(P<0.01);使用Dex和Fer-1预处理2 h后,与FAC组比较,Dex组和Fer-1组ROS水平降低(F=35.90,P<0.05),见图3。
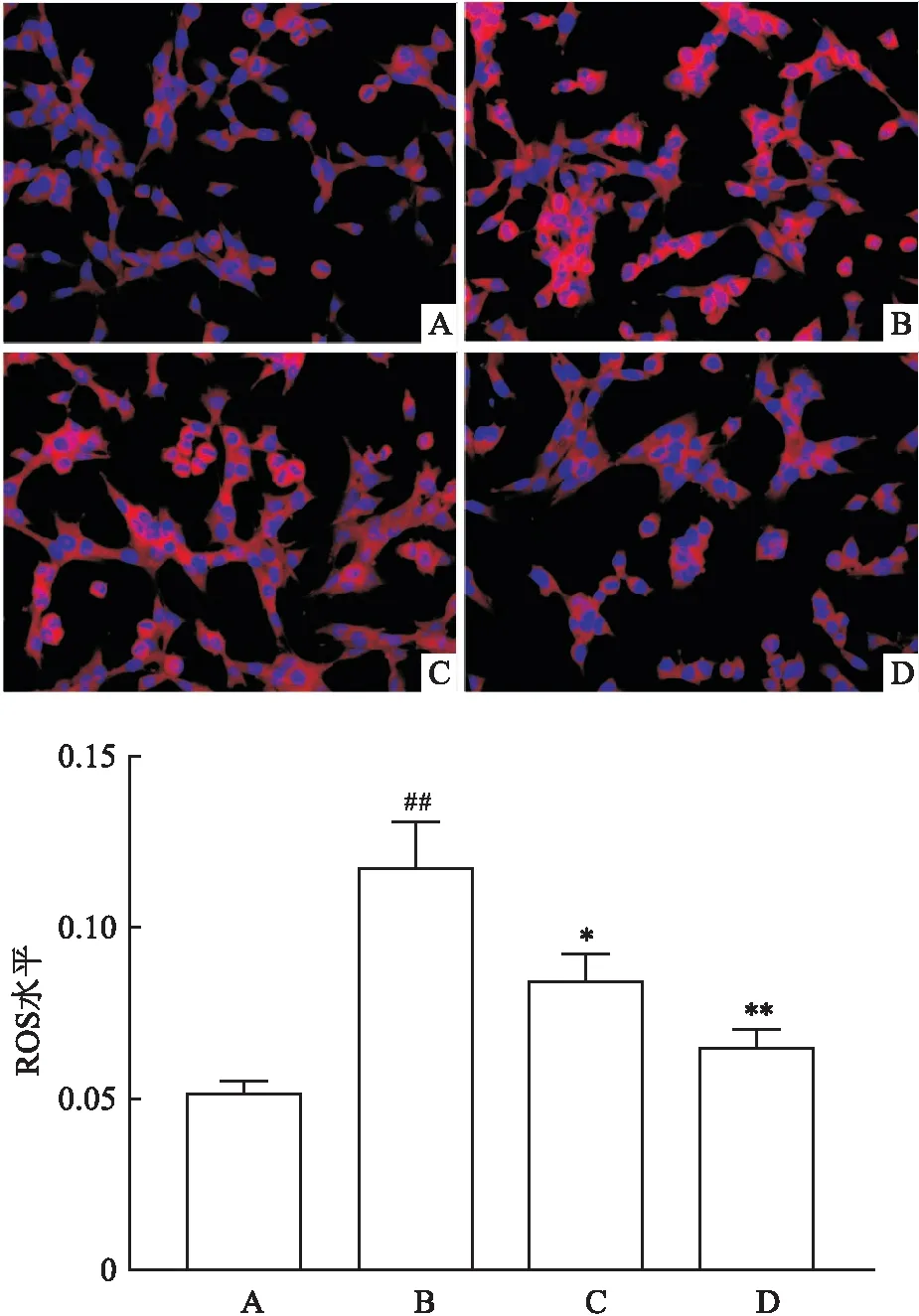
图3 DHE荧光探针检测HT22细胞中的ROS水平 ×400A:Ctrl组;B:FAC组;C:Dex组;D:Fer-1组;与Ctrl组比较:##P<0.01;与FAC组比较:*P<0.05,**P<0.01
2.4 Dex减轻细胞内脂质氧化水平使用125 μmol/L FAC处理HT22细胞24 h后,相较于Ctrl组,FAC组脂质氧化水平升高(P<0.001);使用Dex预处理2 h后,与FAC组比较,Dex组脂质氧化水平降低(F=162.20,P<0.001),见图4。
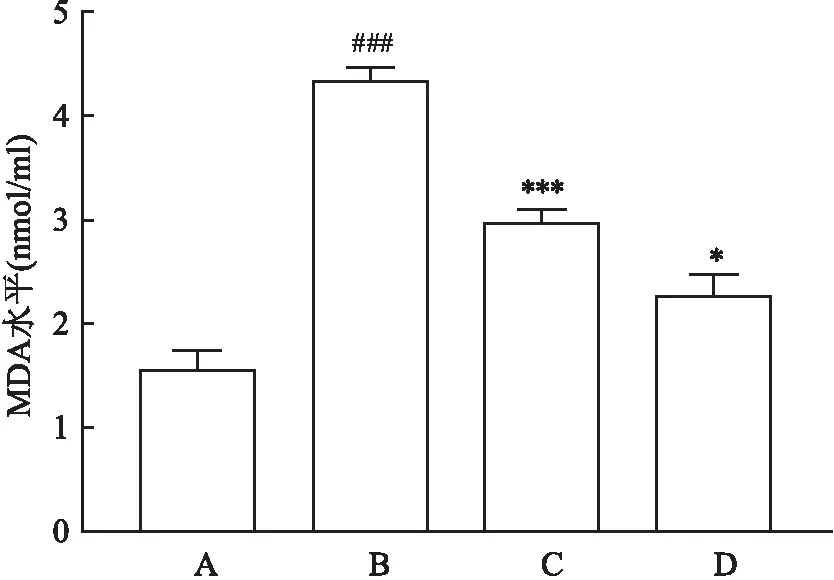
图4 MDA试剂盒检测HT22细胞中脂质氧化程度A:Ctrl组;B:FAC组;C:Dex组;D:Fer-1组;与Ctrl组比较:###P<0.001;与FAC组比较:*P<0.05,***P<0.001
2.5 Dex降低细胞内Fe2+含量Mito-FerroOrange荧光探针检测Fe2+的变化,结果显示,与Ctrl组相比,FAC组细胞内Fe2+浓度升高(P<0.001),而Dex组与Fer-1组细胞内Fe2+浓度则显著下降(P<0.001),表明Dex抑制了FAC所引起的Fe2+浓度的增加(F=0.36,P<0.001),见图5。
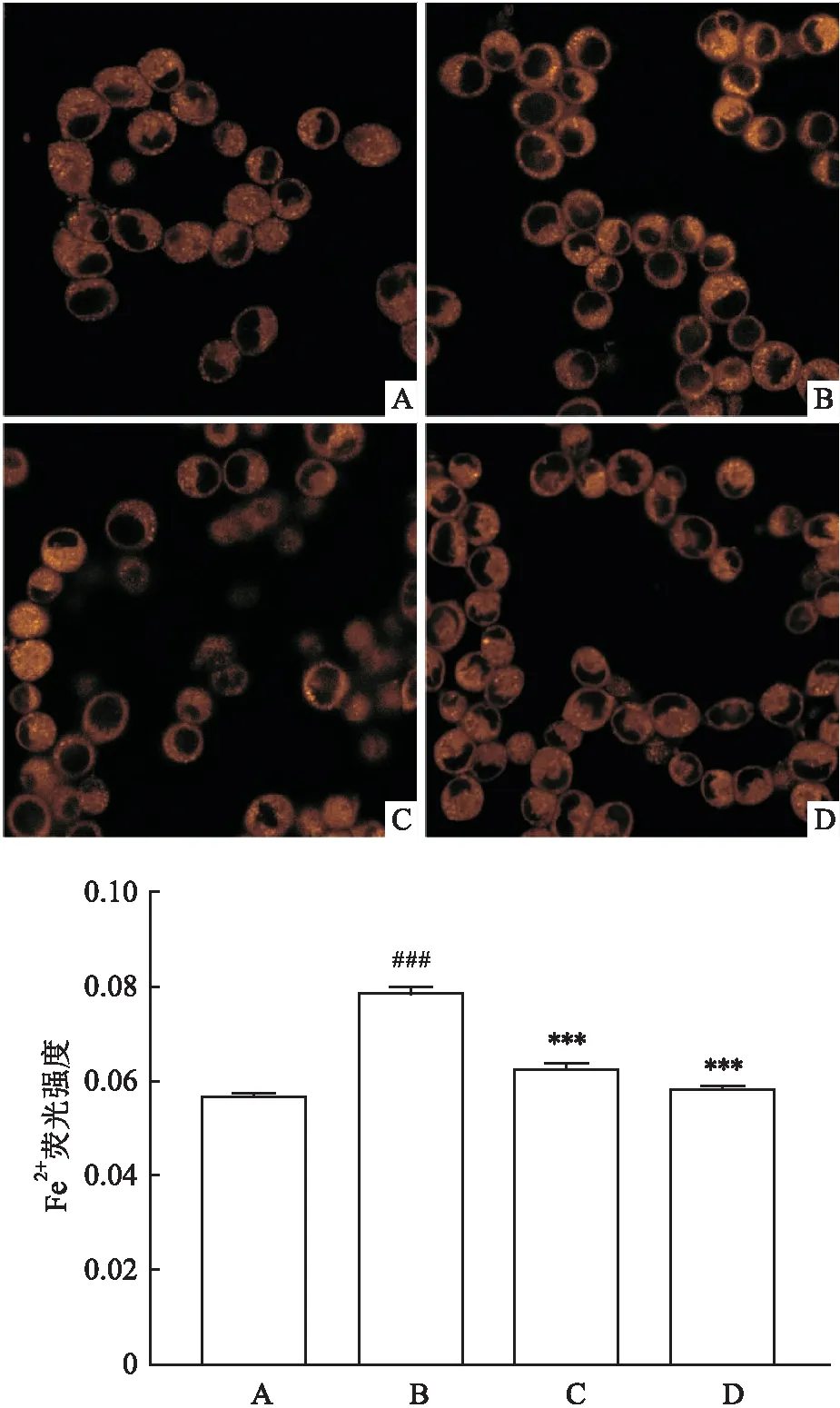
图5 Mito-FerroOrange Fe2+荧光探针检测HT22细胞中的Fe2+含量 ×60A:Ctrl组;B:FAC组;C:Dex组;D:Fer-1组;与Ctrl组比较:###P<0.001;与FAC组比较:***P<0.001
2.6 Dex减轻细胞超微结构损伤使用透射电子显微镜观察HT22细胞中的超微结构改变,与Ctrl组比较,FAC组线粒体损伤严重,膜密度增厚,线粒体嵴消失,Dex组和Fer-1组细胞内线粒体损伤程度减轻,见图6。
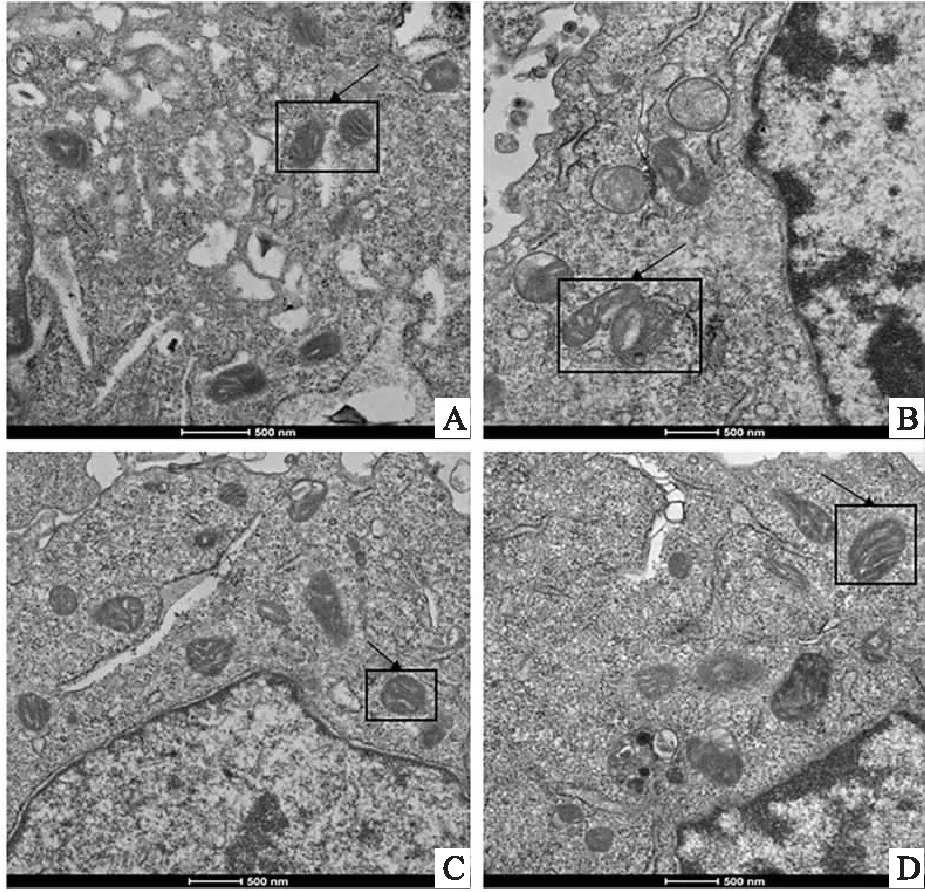
图6 电子显微镜下HT22细胞中线粒体及细胞核超微结构的变化情况 ×13 500A:Ctrl组;B:FAC组;C:Dex组;D:Fer-1组;箭头:线粒体
2.7 Dex通过减轻铁超载毒性抑制铁死亡使用mTOR抑制剂AZD8055后,TFR1表达上调(F=73.03,P<0.05),见图7A;与Ctrl组比较,FAC组mTOR表达水平下调,TFR1及Fpn水平上调,铁蛋白(Ferrtin)表达降低;与FAC组比较,Dex组mTOR表达水平升高,TFR1和Fpn表达水平减少,而Ferrtin表达活跃(P<0.05),见图7B。
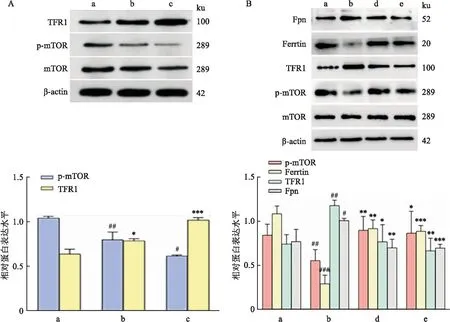
图7 Dex通过减轻铁超载毒性抑制铁死亡A:Western blot法检测HT22细胞经AZD8055处理后p-mTOR、TFR1的表达;B:Western blot法检测铁代谢相关蛋白的表达;a:Ctrl组;b:FAC组;c:FAC+AZD8055组;d:Dex组;e:Fer-1组;与Ctrl组比较:#P<0.05,##P<0.01,###P<0.001;与FAC组比较:*P<0.05,**P<0.01,***P<0.001
3 讨论
本研究根据文献[9]和CCK-8法检测结果确定了Dex是一种安全无毒的麻醉药物,可以保护HT22细胞免受毒性损伤。采用FAC诱导HT22细胞,建立铁超载模型。结果表明,与Ctrl组相比,FAC组Fe2+含量升高,提示铁超载模型建立成功。本实验采用5 μmol/L Dex预处理,发生铁超载毒性的HT22细胞中Fe2+含量下降,提示Dex可以减轻铁超载引起的HT22细胞损伤。
铁死亡是迄今为止发现的一种相对较新的死亡方式,它与神经退行性疾病和脑缺血/出血性中风均有密切关系[10],铁代谢紊乱可以认为是铁死亡的触发阶段[11],影响细胞中ROS和脂质氧化的水平。HT22细胞分离自大脑海马体,是铁死亡高度敏感的细胞,目前广泛应用于神经系统疾病的研究。FAC诱导的细胞外高铁浓度,使HT22细胞受到铁超载毒性攻击。HT22细胞发生铁超载后,会产生过量脂质氧化产物,加速细胞的损伤,引起氧化应激。细胞外高铁能增加TFR1入口的铁积累量,刺激TFR1通道打开,大量铁流入细胞,细胞内Ferrtin可以调节细胞内铁水平,对其进行贮存,维持细胞内铁的稳态。一旦Ferrtin降解,铁将变成游离态并促进Fenton反应发生,生成脂质过氧自由基(PUFA-OO·),并最终形成脂质氢过氧化物(PUFA-OOH),加速脂质积聚,最终导致铁死亡[12]。PTGS2和ACSL4是已知的铁死亡关键的标志性蛋白,参与上述脂质积累的过程,本研究结果显示,与Ctrl组比较,FAC组HT22细胞PTGS2和ACSL4的蛋白和mRNA表达水平升高,ROS、脂质氧化水平和Fe2+水平表达升高,细胞内线粒体结构损坏程度加重,提示FAC可以促进铁死亡的发生;且Dex能降低FAC引起的HT22细胞中PTGS2和ACSL4的蛋白和mRNA表达水平升高,减轻ROS、脂质氧化水平和Fe2+水平表达的升高,以及缓解细胞内线粒体结构损坏程度,提示Dex可能是通过抑制铁死亡的方式保护HT22细胞。
mTOR通路失控通常表现在脑出血、神经退行性疾病和衰老等许多疾病中,因此靶向mTOR治疗在近年来快速兴起[13], mTOR在铁死亡的研究中越发受到重视,许多研究者认为mTOR介导的铁代谢与脑出血之间存在联系。mTOR作为调节铁离子代谢的上游靶点已被证实[14],mTOR-TFR1信号通路作为调节铁离子代谢的关键通路,因此mTOR在铁死亡的发生机制中具有重要作用。细胞高铁浓度会使mTOR的表达受到抑制,导致细胞内铁稳态失衡,引起氧化应激诱发铁死亡[15]。本研究显示,在HT22细胞铁超载的模型中,使用mTOR抑制剂AZD8055处理,在mTOR表达量低的组别中下游TFR1蛋白表达水平升高,这表明在HT22细胞的铁超载模型中存在该通路的调控;使用Dex处理后,由FAC诱导的mTOR蛋白表达上调,下游的TFR1蛋白表达被抑制,并且降低了FAC引起的HT22细胞中Ferrtin和Fpn——铁相关的蛋白表达水平的上调。这说明Dex可能是通过调节铁代谢的方式影响细胞存活,从而改善铁超载引起的HT22细胞损伤。
本研究证实Dex可以抑制FAC诱导的HT22细胞发生铁死亡,从而减轻HT22细胞的铁超载毒性,其机制可能与激活mTOR-TFR1通路有关,自噬可能参与其中,但本研究尚未证实。本研究使用的Dex是商品针剂,对细胞实验存在一定影响;其次,在细胞机制方面,本研究证实Dex对铁超载引起的HT22细胞氧化应激损伤具有明确的保护作用,但尚未在原代神经元上验证;在动物体内Dex对铁超载引起的认知和记忆功能障碍是否具有保护作用是本课题组下一步的研究方向。
(致谢:本实验在安徽医科大学药学院教育部抗炎免疫药物重点实验室完成,感谢各位老师和同学的帮助。)
