基于网络药理学结合实验验证探究骨碎补防治绝经后骨质疏松症的作用机制
2022-11-02邹德宝王志洲王金凤姜红江
王 杰,邹德宝,李 琰,王志洲,金 鑫,候 燕,王金凤,石 威,姜红江,*
(1.安徽中医药大学第一临床医学院,安徽 合肥 230000;2.山东省文登整骨医院,山东 威海 264400)
骨质疏松症(osteoporosis, OP)作为一种代谢性骨病,具有全身发病、骨量减少和骨小梁微结构破坏等表现,以骨皮质变薄、骨小梁之间失去连接为典型病理特征[1],从而增加骨的脆性,使骨折发生率大幅提升。 OP 可分为Ⅰ型(原发性)和Ⅱ型(继发性)2种。 绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是Ⅰ型骨质疏松症中最高发的类型[2]。 有研究发现,全球范围内PMOP 已成为绝经后妇女的多发病[3-4],这一现象主要归因于绝经后女性雌激素含量大幅减少。 雌激素对保持骨内成骨和破骨功能平衡发挥主要调控作用,所以绝经后妇女出现骨质疏松的主要原因之一就是体内雌激素减少[5]。
目前,治疗PMOP 的方法主要是通过药物升高雌激素水平、补充钙剂、促进钙吸收、刺激成骨和抑制破骨等,但治疗效果均不太理想。 近年来,中医药防治PMOP 逐渐受到越来越多的关注。
PMOP 是现代医学病名,中医古籍中并无相关描述。 根据其症状可归为“骨痿”。 中医理论分析“骨痿”发病多因肾精亏虚,进而生髓乏源,导致骨骼失养。 根据“肾藏精,主骨生髓”的理论,中医以骨碎补、淫羊藿、杜仲等补肾中药为主对骨痿进行防治。骨碎补属于水龙骨科植物槲蕨的根茎,具有补肾壮骨、活血疗伤的功效[6]。现代药理研究证实,骨碎补有效成分主要为黄酮类、三萜类及木脂素等[7]。 既往药理及临床研究已证实,骨碎补具备优良的抗骨质疏松和促进骨折愈合的功效[8-10],但其治疗PMOP 的具体作用机制尚不明确。 因此,有必要基于网络药理学和动物实验验证的方法进一步展开研究。
网络药理学是一种多学科融合而形成的新学科,能够较为全面地反应在分子水平上药物对疾病网络的作用机制[11]。 此次研究借助网络药理学的手段,从骨碎补的化学成分基础出发,更加系统地深入探究骨碎补治疗PMOP 的主要靶点和潜在的分子作用机制,并通过雌性大鼠去势构建PMOP 模型,观察不同组别大鼠血清E2水平、骨代谢指标及骨密度的变化,来探究骨碎补防治PMOP 的机制。 以期为PMOP 的防治提供理论依据,同时给新药开发提供新思路。
1 网络药理学
1.1 骨碎补相关靶点筛选
通过TCMSP[12]平台检索骨碎补的化学成分并按口服药物生物利用度≥30%、类药效性≥0.18[13]两个ADME 属性值对活性成分进行筛选, 结合Swis sTargetPrediction 平台,勾选“Homo sapiens”选项查找药物作用的有效蛋白质靶点。
1.2 骨碎补活性成分-靶点网络
蛋白质靶点筛选完成后借助Uniprot 数据库将与化合物相关联的蛋白质靶点进行标准化,使用Cytoscape 3.8.0[14]构建骨碎补活性成分-靶点网络。
1.3 PMOP 相关靶点筛选
通过检索OMIM 数据库[15]、GeneCards 数据库[16]、TTD 数据库[17]中PMOP 的潜在靶点,设置“postmenopausal osteoporosis”为关键词,结合DrugBank数据库挖掘防治PMOP 的临床药物作用靶点[18]。 将上述4 个数据库靶点联合并去重,获取PMOP 的靶点。
1.4 PPI 网络构建
为确定骨碎补相关靶点与PMOP 潜在靶点之间的关系,运用Venny 2.1.0 平台将骨碎补相关成分靶点与PMOP 潜在靶点取交集并制作韦恩图。 运用STRING 平台[19]制作PPI 网络图。
1.5 骨碎补成分-PMOP 靶点功能与通路的富集分析
将骨碎补防治PMOP 的靶点录入DAVID 平台,获取疾病生物学过程及其信号通路并加以富集分析,将获得的4 个数据库资料设置Count 值为2、P<0.05;根据Count 值选用TOP10、TOP20 数据,采用微生信平台制作GO 富集分析条形图、KEGG 通路富集分析气泡图。 为更加直观地显示骨碎补治疗PMOP所涉及KEGG 通路的相关靶点,借助Cytoscape 3.8.0构建“靶点-信号通路”网络图。
2 实验验证
2.1 动物与材料
40 只8 周龄SPF 级雌性SD 大鼠,体质量220~250 g[许可证号SCXK(鲁)20190003,购自济南朋悦实验动物繁育有限公司],玉米芯垫料、SPF 级大小鼠繁殖饲料(广东省医学实验动物中心)。实验通过山东省文登整骨医院伦理委员会批准,批准号:LL2021052701。动物饲养于山东省文登整骨医院动物实验室大鼠IVC 独立送风隔离笼具内,笼内温度22~26 ℃,相对湿度设定40%~70%,昼夜节律12 h 间隔照明。
2.2 试剂与仪器
骨碎补中药饮片来自山东省文登整骨医院;E2检测试剂盒(批号:PE223)、BALP 检测试剂盒(批号:P0321S)、TRAP 检测试剂盒(批号:P0332)均购自上海碧云天生物技术有限公司;苯巴比妥钠注射液(批号:2103071,天津金耀药业有限公司);0.9%氯化钠注射液(批号:2101010523,辰欣药业股份有限公司);75%乙醇(批号:210107,山东利尔康医疗科技股份有限公司);Micro CT(型号:NMC-100,平生医疗科技有限公司);离心机(型号:Sorvall ST 16R,赛默飞世尔科技公司)。
2.3 方法
2.3.1 分组与造模 40 只雌鼠经7 d 适应性喂养后,按随机数字表法分成空白组、假手术组、模型组、骨碎补组,每组10 只。空白组无手术干预,其余各组大鼠分别用苯巴比妥钠溶液腹腔注射麻醉,麻醉完成后行术区备皮,75%乙醇消毒,经背侧腰椎旁入路各做一纵切口,长约1.5 cm,逐层切开各层组织直至腹腔,模型组和骨碎补组大鼠摘除双侧卵巢,假手术组摘除卵巢周围等量脂肪,术区止血,缝合切口。 术后各组大鼠切口按时消毒,定期更换垫料,预防感染。
2.3.2 骨碎补煎液制备 骨碎补饮片100 g 置于锅中,加三蒸水浸泡60 min,调整液面,大火煮沸,继续用小火煮30 min,滤出煎液,锅中再次加入水,二煎,火候控制同前,时长20 min,同前滤出煎液,与头煎汤液混合,继续文火蒸馏至100 mL,得到骨碎补煎液(1 g/mL),4 ℃储存备用。
2.3.3 给药 继续饲养2 周后给药,灌胃剂量根据动物与人体间的等效剂量换算方法,成人记为a,大鼠记为b。D、R、S 分别代表剂量、换算系数和校正系数,公式如下:Db=Da×Rab×Sb[20]。成人取标准体质量60 kg,给药前大鼠平均体质量约300 g。 得到骨碎补煎液灌胃剂量(6.1 g/kg),其余各组每天灌胃相应体积生理盐水。每14 天再次称重调整灌胃剂量。 每天灌胃1 次,持续12 周。 灌胃结束后全部大鼠依次麻醉,行腹主动脉取血,离心后留取血清并分离双侧股骨。
2.3.4 检测指标及方法采集不同组别大鼠血清,依照各检测指标检测试剂盒使用说明进行雌二醇(estradiol, E2)、骨源性碱性磷酸酶(bone alkaline phosphatase, BALP)及抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP)检测,运用Micro CT 行大鼠股骨BDM 检测,并通过自带软件对股骨近端和远端进行骨密度(bome mineral density, BDM)分析。
3 结果
3.1 网络药理学研究结果
3.1.1 骨碎补活性成分与靶点的获取 初步提取骨碎补的化学成分71 种,有效成分作用靶点587 个。经ADME 筛选和SwissTargetPrediction 平台补充后,删去不能获取信息的成分,共获得骨碎补16 种有效活性成分,有效成分对应的靶点171 个。 包括柚皮苷、山柰酚和木犀草素等。利用Cytoscape 3.8.0 对骨碎补成分连同作用靶点的关系网络进行绘制。 详见图1。
3.1.2 PMOP 相关靶点的获取 从GeneCards 数据库中获得PMOP 潜在靶点,然后结合OMIM、Drug-Bank、TTD 数据库对相关靶点进行补充,合并上述数据库有关靶点后除去重复值,最终获取611 个PMOP有关靶点。
3.1.3 PPI 网络的构建 将筛选出来的药物有效活性成分靶点与PMOP 靶点取交集,并借助Venny 平台制作韦恩图,得到骨碎补药物成分-PMOP 共同靶点74 个,见图2。 运用STRING 平台构建骨碎补和PMOP 共同靶点的PPI 网络。 详见图3。
3.1.4 靶点功能与通路的富集分析 应用DAVID数据平台对获取的74 个潜在靶点进行信号通路GO 富集分析,分别选取Top10 运用微生信平台对结果进行可视化,见图4。 由结果可见多个靶点的功能与PMOP 的发病紧密联系。 骨碎补参与的重要生物过程包含RNA 聚合酶Ⅱ启动子的转录正调节、氧化还原过程、凋亡过程的负调节和信号转导等。在细胞组分中,主要作用于细胞核、细胞质和质膜等。 相关靶点调节PMOP 的分子功能主要富集于蛋白结合、酶结合和蛋白质同源二聚化活性等。 将KEGG通路Top 20 结果绘制成气泡图,见图5。KEGG 富集通路提示骨碎补可能通过Pathways in cancer、PI3KAkt、TNF、HIF-1 等信号通路和MAPK1、MAPK3、TNF、TGF-β1 等主要靶点参与调控PMOP。 通过Cytoscape 3.8.0 对骨碎补治疗PMOP 所涉及KEGG 通路的相关靶点进行可视化,见图6。
3.2 骨碎补对模型大鼠的作用
3.2.1 各组大鼠E2、BALP、TRAP 水平比较 与空白组相比,假手术组大鼠血清E2、BALP、TRAP 含量均无统学差异(P>0.05)。 与假手术组相比,模型组大鼠血清E2、BALP 含量下降(P<0.01),TRAP 含量增高(P<0.01)。 与模型组相比,骨碎补组大鼠血清E2、BALP 升高(P<0.05、P<0.01),TRAP 降低(P<0.05)。 详见表1。
3.2.2 各组大鼠股骨BDM 比较 与空白组相比,假手术组大鼠股骨近端和远端BDM 水平均无统学差异(P>0.05)。 与假手术组相比,模型组大鼠股骨近端和远端BDM 水平显著降低(P<0.01)。 与模型组相比,骨碎补组大鼠股骨近端和远端BDM 水平升高(P<0.05),见表2。 空白组和假手术组大鼠骨小梁结构正常,模型组大鼠骨小梁稀疏、断裂,骨碎补组大鼠骨小梁稀疏、断裂程度较模型组轻,但仍有破坏。详见图7。
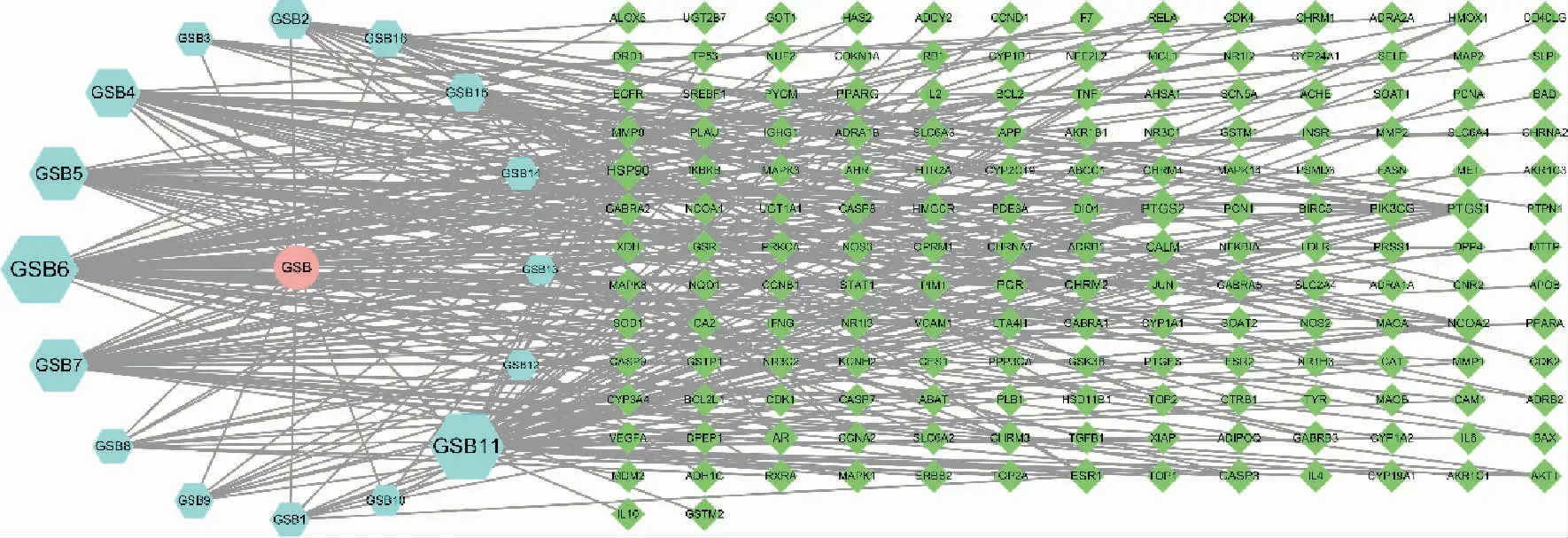
图1 骨碎补活性成分-靶点图
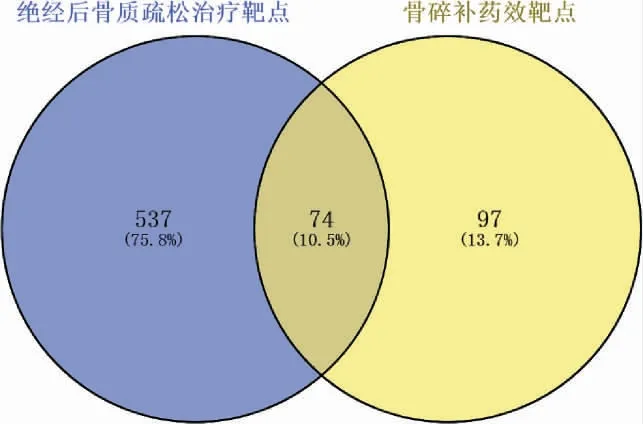
图2 骨碎补药物成分-PMOP 靶点韦恩图
4 讨论

图3 骨碎补-PMOP 靶点PPI 网络图

图4 靶点GO 富集分析条形图

图5 靶点KEGG 通路富集分析气泡图

图6 骨碎补防治PMOP“靶点-信号通路”网络图
表1 各组大鼠血清BALP、E2、TRAP 含量(±s,n=10)

表1 各组大鼠血清BALP、E2、TRAP 含量(±s,n=10)
注:与假手术组相比,△P<0.01;与模型组相比,*P<0.01,**P<0.05。
组别空白组假手术组模型组骨碎补组BALP/(μg/L)217.72±20.53 218.30±17.23#135.00±10.24△176.39±12.79*E2/(ng/L)8.09±1.38 8.15±1.46#5.31±0.72△6.30±0.91**TRAP(ng/L)2.24±0.13 2.25±0.10#2.86±0.17△2.51±0.17**
表2 各组大鼠股骨近端、远端BDM 水平(±s,n=10,g/cm2)

表2 各组大鼠股骨近端、远端BDM 水平(±s,n=10,g/cm2)
注:与假手术组相比,△P<0.01;与模型组相比,*P<0.05。
股骨近端BDM 0.212 39±0.012 62 0.215 63±0.013 29#0.179 79±0.016 54△0.206 31±0.007 90*股骨远端BDM 0.262 20±0.013 08 0.262 61±0.013 49#0.216 13±0.014 72△0.258 52±0.016 61*组别空白组假手术组模型组骨碎补组

图7 各组大鼠股骨近端、远端CT 断层扫描
随着人口老龄化的加剧,我国老年人比例不断上升,因骨质疏松所造成的病理性骨折的发生率逐年增加,尤其是绝经后女性更为严重,使家庭和社会承受了极大的经济压力,已经成为社会面临的严重挑战[21]。 根据国家卫生健康委员会2018 年调查结果表明,我国超过50 岁居民发病率为19.2%,超过65 岁居民发病率达到32.0%,且女性患病率较男性显著提高[22]。 研究证实,在绝经后女性中,雌激素分泌减少能够刺激破骨细胞分化,增加骨细胞凋亡,并抑制成骨细胞分化功能[23-24]。 BALP 和TRAP 作为反映骨形成和骨吸收的敏感指标,常用于监测机体骨代谢情况[25]。骨密度是诊断OP 的重要指标,具有较广泛的临床应用。 PMOP 发病往往伴随着BALP 和TRAP 水平变化和骨密度下降。
根据中医学理论,PMOP 可归为“骨痿” 范畴。中医古籍关于“骨痿”的描述最早见于《素问·痿论篇》:“肾主身之骨髓……骨枯而髓减,发为骨痿。”骨碎补作为传统中药材,具有悠久的药用历史[26]。《开宝本草》曰:“骨碎补主破血,止血,补伤折。 ”其补肾益精、续筋接骨的功效被历代医家广泛地用于治疗各种骨伤科疾病。
本实验结果发现,空白组与假手术组大鼠各项指标均无统计学差异。 与假手术组比较,模型组大鼠血清E2、BALP 和BMD 显著下降(P<0.01),TRAP明显升高(P<0.01),提示造模成功。 骨碎补组大鼠血清E2、BALP 和BDM 均高于模型组(P<0.01),TRAP水平较模型组降低(P<0.01),说明骨碎补能够改善PMOP 大鼠E2水平,促进成骨细胞功能,抑制破骨细胞活性,同时能够提高骨密度,从而对PMOP 发挥治疗作用。
由于骨碎补的化学组成成分复杂,决定了其发挥药理作用可能是通过多个治疗疾病的信号通路、蛋白靶点进行调节,以发挥相应的作用。 本研究共筛选出骨碎补可能的活性成分16 个, 其中柚皮苷、木犀草素和山奈酚等成分拥有较多的预测靶点,说明这些化合物可能是骨碎补治疗PMOP 的重要活性成分。 柚皮苷作为一种天然黄酮类物质,已有研究证实其能促进微循环,改善成骨细胞增殖和分化[27]。柚皮苷能提高BMP-2 等成骨细胞标志蛋白的表达水平,同时还能减少NF-κB 和ERK 信号转导和破骨细胞基因的蛋白表达水平,进而影响破骨细胞形成,起到缓解骨质疏松的作用[28-29]。 骨碎补中另一种主要化合物木犀草素也属于黄酮类,有研究证实,木犀草素能缓解甲基乙醛对成骨细胞MC3T3-E1 的损伤,可能对糖尿病骨病的预防起作用[30]。其他体内外实验[31]指出木犀草素可能通过降低破骨细胞分化能力和功能来减少PMOP 的骨流失。 山柰酚作为骨碎补的重要有效成分,对防治OP 有一定效果,能够缓解因雌激素减少所导致的大鼠骨微结构紊乱[32]。WONG 等[33]提出山柰酚是通过调控雌激素受体、BMP-2、MAPK 等信号通路来实现抗骨质疏松的作用。 另有研究证实山柰酚可以参与雌激素信号转导,激活Wnt 信号通路,从而起到骨保护的功效[34]。
根据PPI 网络图,得到骨碎补防治PMOP 的靶点包括MAPK1、MAPK3、TNF、TGF-β1 等,表明骨碎补防治PMOP 具有多成分、多靶点的特点。 作为MAPK 家族的主要成员,MAPK1、MAPK3 基因通过编码相关蛋白介入细胞信号转导,调控细胞增殖、分化和凋亡等。研究证实,来源于大鼠骨髓间充质干细胞的外泌体,可通过MAPK 途径产生促进成骨细胞增殖作用,进而延缓OP 的进程[35]。TNF-α 作为TNF 的一种类型,通过炎症反应参与骨重塑,具有刺激OC形成和调控成骨细胞作用,在维持骨稳态中有重要功能[36]。 研究证实,TNF-α 通过提升巨噬细胞及干细胞中NF-κB 受体激活因子水平,并促进RANKL与其受体RANK 结合进而刺激OC 的增殖和分化[37]。TGF-β1 是TGF-β 的亚型,在骨组织中含量丰富,在骨发育及重建过程中具有重要调节作用[38]。 刘元等[39]借助动物实验证实蛇床子素能够降低去卵巢大鼠血清BGP 含量,升高TGF-β1 水平,表明蛇床子素能够调节大鼠激素水平,明显改善去势雌鼠的骨代谢异常,增加骨密度,进而防治骨质疏松。
KEGG 通路富集分析显示,骨碎补对PMOP 的防治作用主要通过Pathways in cancer、PI3K-Akt、TNF、HIF-1 等信号通路。Pathways in cancer 较为复杂,包括Wnt 信号通路、Hedgehog 信号通路、Notch信号通路等多个下游通路[40]。其中,Wnt 蛋白是一组分泌的糖蛋白,是促进成骨细胞分化和活性的重要调节因子[41]。ZHU 等[42]证实,PI3K/Akt 信号通路具有促进成骨细胞增殖、分化和成骨作用而缓解骨质疏松。 TNF 主要介导细胞凋亡及炎症和机体免疫,参与调节包括糖尿病、骨质疏松症、多发性硬化症和类风湿关节炎等多种疾病的发病机制[43]。 陈鹏等[44]发现TNF-α 通过介导NF-κB 来增加RANKL 诱导的破骨细胞形成以防治PMOP。已有研究证实,HIF-1具有促进破骨细胞形成、增强破骨细胞活性的作用[45-46]。该通路在组织缺氧时紧密参与了血管形成、骨吸收和骨生成的修复过程[47]。 由此预测,骨碎补可通过Pathways in cancer、PI3K-Akt、TNF、HIF-1 等 信 号通路和MAPK1、MAPK3、TNF、TGF-β1 等靶点达到改善骨量的目的,对PMOP 有治疗效果。
综上所述,本研究采用网络药理学结合动物实验验证的方法探讨了骨碎补治疗PMOP 的潜在作用机制,证实了骨碎补治疗PMOP 具有多成分、多靶点、多途径的作用机制特征。 课题组拟在后续研究中基于不同骨碎补药物浓度进一步探讨骨碎补治疗PMOP 作用机制及作用效果,为现代药物研发提供思路。
