ALDH1、SOX2表达与卵巢浆液性肿瘤预后相关性
2022-11-02崔艳超崔艳平
崔艳超 李 勤 崔艳平 王 夏 姜 虹
1.陕西中医药大学(咸阳,712046);2.陕西中医药大学第二附属医院;3.西北妇女儿童医院
卵巢癌是女性死亡率高的恶性肿瘤,卵巢浆液性肿瘤是子宫外女性生殖道最常见的组织学肿瘤类型[1]。缺少可靠的特异性标志物[2],有75%的卵巢癌患者首次确诊就是晚期且预后不良[3]。尽管科学发展推动了许多其他癌症患者预后的改善,但在过去50年里恶性卵巢肿瘤患者的总体生存率并没有根本改变[4]。乙醛脱氢酶1(ALDH1)是肺癌、胰腺癌、前列腺癌、头颈部癌的一种癌症干细胞标志物[5];ALDH1是卵巢癌的预后标志,表达增加与预后不良相关的研究最多[6]。1994年,作为SOX家族成员之一的SOX2基因在人类中被发现并表征[7],目前为止已在多种上皮源性的肿瘤中检测到SOX2表达增强,例如空腔鳞状细胞癌、肝细胞癌、结肠直肠癌、和卵巢癌等[7]。在卵巢癌中,多项研究[8]证明SOX2的表达从良性、交界性到恶性逐渐增加,且与卵巢癌不良临床结局相关[9]。然而,ALDH1和SOX2在卵巢浆液性肿瘤组织中的表达还未见研究。因此,本研究检测卵巢浆液性肿瘤组织中ALDH1、SOX2表达,分析二者在卵巢浆液性肿瘤中的作用以及与患者预后的关系。
1 对象与方法
1.1 研究对象
选取2017年6月—2018年6月在本院手术治疗的卵巢浆液性肿瘤患者79例为研究对象,术中收集患者病理组织标本送病理分析。纳入标准:①参照世界卫生组织 2014年诊断标准病理诊断为卵巢浆液性肿瘤;②本院手术治疗。排除标准:①合并有其他恶性肿瘤等重大疾病;②入院前有放疗、化疗等;③临床资料不完整。本研究经过院道德伦理委员会批准通过,样品采集均取得受试者知情同意。
1.2 检测方法
1.2.1免疫组织化学染色将收集的3种不同病理组织切片常规脱蜡,高压修复,磷酸缓存液(PBS)冲洗后加入一抗(ALDH1兔多克隆抗体(ab2781119),SOX2兔多克隆抗体(ab2781119),均购自上海谷研实业有限公司)4℃过夜,再次PBS冲洗,加入二抗37℃孵育20 min,行DAB显色,苏木素复染,脱水、透明后封片。高表达对照为已知的高表达病理组织切片,低表达对照为PBS代替一抗。
1.2.2免疫组化结果评价标准SOX2主要表达于子宫内膜腺上皮细胞核,ALDH1主要表达位于细胞质。根据染色强度和高表达细胞百分比综合评分:无着色为0分,淡棕黄色为1分,棕黄色为2分,深棕黄色为3分;高表达细胞占比0~5%为0分,5%~24%为1分,25%~49%为2分,50%~74%为3分,≥75%为4分。两种评分相加≤3分为低表达,>3分为高表达。
1.3 预后随访
从患者病理确诊日起,门诊或电话定期随访,观察患者生存时间,术后2年内每3个月进行1次随访,第3年开始6个月随访1次,终点事件为患者死亡。随访截止时间为2021年6月。
1.4 统计学分析

2 结果
2.1 临床资料
根据病理结果分为卵巢浆液性癌(恶性组,54例),年龄52.4±6.2岁;卵巢交界性浆液性肿瘤(交界性组,15例),年龄52.4±6.1岁;卵巢浆液性囊腺瘤(良性组,10例),年龄51.9±6.3岁。根据FIGO分期标准,Ⅰ期15例、Ⅱ期7例、Ⅲ期32例、Ⅳ期25例。按照病理组织学分级,高分化30例、中分化25例、低分化24例;绝经38例、未绝经41例。
2.2 ALDH1与SOX2蛋白的表达
在79例卵巢浆液性肿瘤组织标本中,ALDH1、SOX2蛋白在恶性组、交界性组、良性组病理组织中高表达率均依次降低(均P<0.05)。见表1。
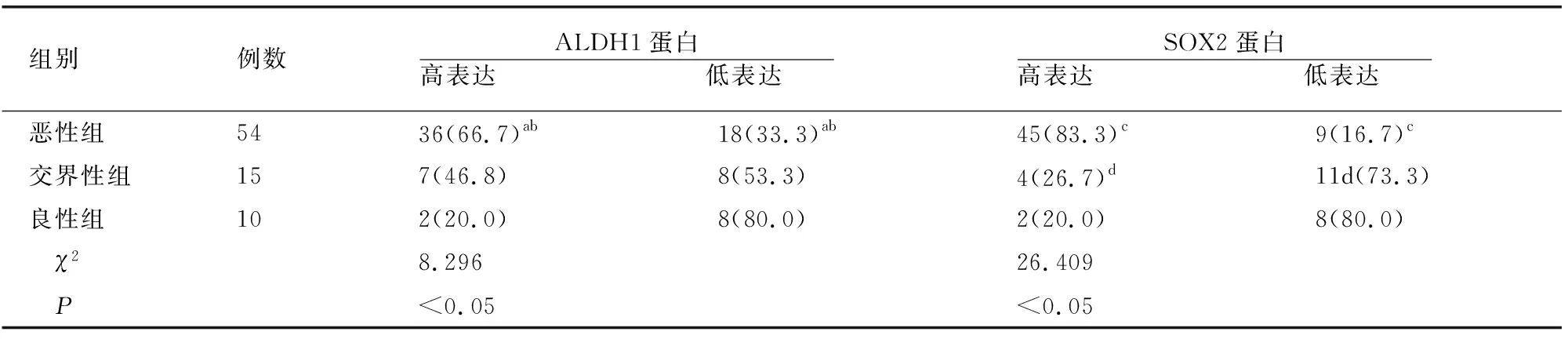
表1 各组病理组织中ALDH1、SOX2蛋白表达比较[例(%)]
2.3 ALDH1、SOX2表达相关性
卵巢浆液性肿瘤组织中ALDH1、SOX2表达存在明显关系(P<0.05),见表2。经GEPIA数据库检索分析发现,ALDH1、SOX2二者表达水平呈正相关(P<0.05)。见图1。

表2 ALDH1与SOX2表达关系

图1 GEPIA数据库分析患者病理组织中ALDH1、SOX2表达相关性
2.4 ALDH1与SOX2蛋白表达与患者临床病理参数关系
病理组织中ALDH1与SOX2蛋白表达与患者年龄无关(P>0.05)。与患者肿瘤FIGO分期、淋巴结有无转移、病理分级、盆腔侵犯、大网膜转移、Ki-67指数有关(P<0.05)。见表3。
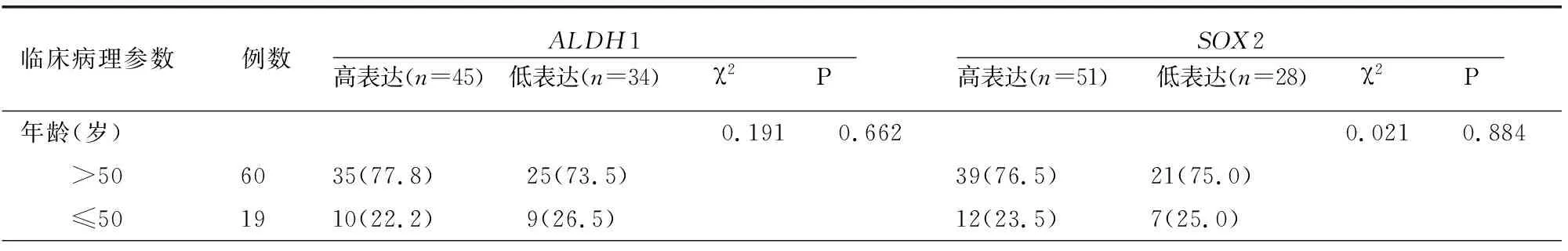
表3 病理组织中ALDH1、SOX2蛋白表达与临床病理参数关系[例(%)]

临床病理参数例数ALDH1高表达(n=45) 低表达(n=34) χ2 P SOX2高表达(n=51) 低表达(n=28) χ2 P 淋巴结转移5239(86.7)13(38.2)20.1930.00042(82.4)10(35.7)17.4780.000FIGO分期23.3470.00018.5250.000 Ⅰ+Ⅱ223(6.7)19(55.9)6(11.8)16(57.1) Ⅲ+Ⅳ5742(93.3)15(44.1)45(88.2)12(42.9)病理分级19.3430.0008.5270.014 高3020(44.4)10(29.4)25(49.0)5(17.9) 中2520(44.4)5(14.7)15(29.4)10(35.7) 低245(11.1)19(55.9)11(21.6)13(46.4)盆腔侵犯5040(88.9)10(29.4)29.4880.00038(74.5)12(42.9)7.7950.005大网膜转移5542(93.3)13(38.2)27.7980.00040(78.4)15(53.6)5.2820.022Ki67指数阳性6043(95.6)17(50.0)22.0040.00045(88.2)15(53.6)11.8910.001
2.5 影响患者预后的单因素分析
单因素分析显示,FIGO分期、淋巴结转移、盆腔侵犯、大网膜转移、Ki-67指数、ALDH1、SOX2蛋白表达均与患者预后有关(P<0.05)。见表4。
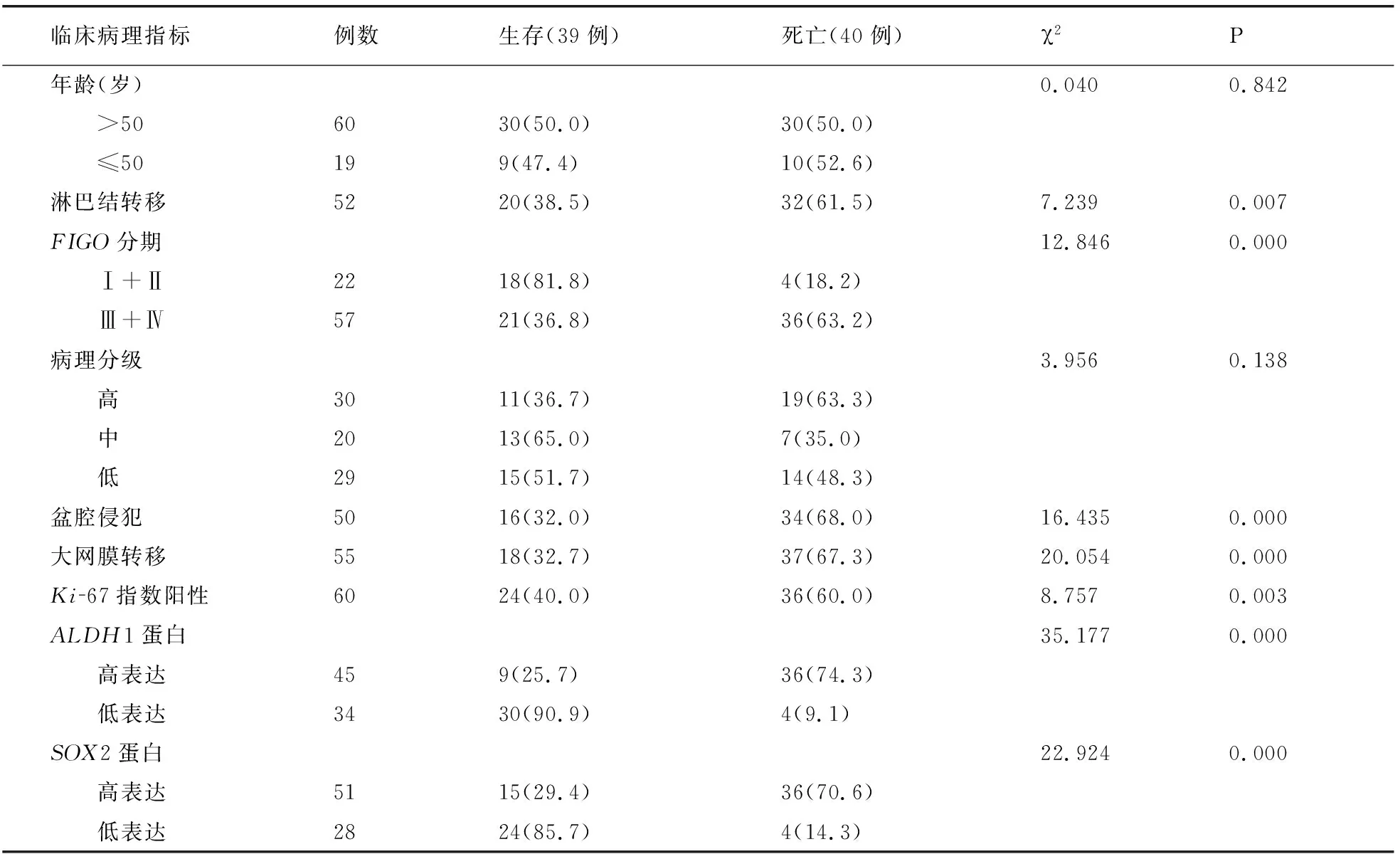
表4 卵巢浆液性肿瘤患者预后影响单因素分析 [例(%)]
2.6 -Kaplan-Meier生存分析
本研究79例患者,末次随访日期2021年6月30日,共30例死亡,49例存活。Kaplan-Meier分析结果显示,ALDH1蛋白高表达组患者3年累积生存率低于低表达组(χ2=41.112,P=0.000),患者3年累积生存率SOX2蛋白高表达组低于低表达组(χ2=32.519,P=0.000)。见图2。
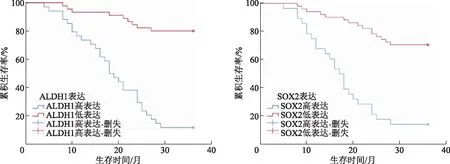
图2 不同ALDH1、SOX2表达患者Kaplan-Meier生存曲线
3 讨论
上皮性卵巢癌是最致命的妇科恶性肿瘤,给女性身心健康带来严重威胁[10]。在疾病早期缺乏特定的症状是导致高死亡率重要因素。多数患者诊断时已到晚期[11]。发病原因复杂,遗传、输卵管上皮种植、绝经晚等均是卵巢癌发生的危险因素[12]。尽管在诊断和手术方面取得了新的进展,以及化疗方案的发展,但在过去40年中晚期上皮性卵巢癌5年生存率仍保持在12%。寻找治疗卵巢浆液性肿瘤的新靶点及评估病情发展及预后是卵巢浆液性肿瘤研究的重点。
ALDH1是一种解毒酶,参与早期干细胞分化过程中视黄醇氧化成视黄酸的过程。此外,ALDH1被认为是癌症干细胞和祖细胞标记物吗,在多种恶性肿瘤中表达[13],包括人乳腺癌。高水平ALDH1活性预示着乳腺癌预后不良[14]。有研究发现ALDH1能够通过对卵巢上皮细胞转录基因的激活促进上皮细胞异常持续增殖,从而降低癌细胞的错配修复能力[15]。钱茹等[16]发现ALDH1在卵巢癌组织中呈现高表达,促进了卵巢癌的发生发展。本研究发现ALDH1蛋白在卵巢浆液性癌组织中呈高表达,在恶性组、交界性组、良性组患者病理组织中高表达率逐渐降低;表达与患者年龄无关,FIGO分期、淋巴结有无转移、病理分级、盆腔侵犯、大网膜转移、Ki-67指数阳性有关,提示ALDH1可能参与了卵巢良性肿瘤的癌变过程。人类SOX2基因编码317个氨基酸的蛋白质[17],最初被发现可以维持胚胎干细胞的多能性,最近被证明与一系列恶性肿瘤有关。大量研究表明,SOX2在多种类型肿瘤中促进细胞增殖、迁移、侵袭[18]。高表达与肿瘤进展或多种癌症的不良预后相关。本研究发现SOX2蛋白在卵巢浆液性癌中呈高表达,在恶性组、交界性组、良性组病理组织中的表达率分别为83.33%、26.67%、20.00%依次降低,与患者FIGO分期、淋巴结有无转移、病理分级、盆腔侵犯、大网膜转移、Ki-67指数阳性有关,提示,SOX2可能影响卵巢浆液性癌的发生发展。本研究进一步分析,卵巢浆液性肿瘤组织中ALDH1与SOX2表达水平呈正相关,提示ALDH1和SOX2可能存在某种机制影响着卵巢浆液性癌变进程。本研究因素分析显示,FIGO分期、淋巴结有无转移、盆腔侵犯、大网膜转移、Ki-67指数、ALDH1、SOX2蛋白表达均与巢浆液性肿瘤患者预后有关;Kaplan-Meier分析显示,ALDH1、SOX2蛋白高表达患者3年累积生存率均低于低表达组,表明ALDH1、SOX2蛋白表达均与患者预后有关,提示二者可能通过某种机制共同参与卵巢浆液性肿瘤的发生发展并影响患者预后。
综上所述,ALDH1、SOX2在浆液性癌组织中呈高表达且二者表达正相关,与患者部分临床病理参数和预后生存相关,具有重要的临床意义。但是,本研究纳入样本量有限,可能存在一定误差,后续讲加大样本量继续验证本研究结果。ALDH1与SOX2具体作用机制仍需通过细胞实验深入研究。
