SPT-TransPRK术中联合0.02%丝裂霉素C治疗后角膜基质细胞活化和光密度值的变化
2022-11-02闫春晓靳琳方石峰王丽晶崔林赵丹牟亚男张立军
闫春晓 靳琳 方石峰 王丽晶 崔林 赵丹 牟亚男 张立军
作者单位:大连医科大学附属大连市第三人民医院 大连市眼科医院,大连 116033
表层角膜屈光手术目前已进入高精准、个体化的切削时代,智能脉冲技术辅助的经上皮准分子激光角膜切削术(Transepithelial photorefractive keratectomy with smart pulse technology,SPTTransPRK)通过富勒烯模型技术优化激光脉冲位置,降低传统表层手术(Transepithelial photorefractive keratectomy,TransPRK)的疼痛刺激、残余基质床的粗糙度、角膜上皮下雾状混浊(haze)发生率,成为主流表层屈光手术。目前国内外常规使用0.02%丝裂霉素C(Mitomycin C,MMC)预防术后haze,主要通过抑制角膜基质细胞增殖分化、细胞外基质分泌达到减少haze发生和严重程度的作用,但其使用浓度与作用时间尚未形成共识。本研究通过Pentacam测量角膜光密度(Corneal densitometry,CD)量化角膜的透明度,采用共焦显微镜从超微观层面观察角膜基质细胞活化、密度变化,观察0.02%MMC在SPT-TransPRK术中的临床效果,为MMC的临床规范应用提供依据。
1 对象与方法
1.1 对象
纳入标准:①屈光度均稳定在2 年以上;②术前停戴软性角膜接触镜2周,停戴硬性角膜接触镜3个月;③等效球镜度(SE)为-6.00~-3.00 D,双眼SE差值≤0.75 D。排除标准:①角膜屈光手术史;②眼部疾病史,如干眼、青光眼、圆锥角膜、感染性角膜炎及眼底疾病等;③全身性疾病史,如免疫系统疾病、结缔组织疾病等。
收集2021 年3—6 月在大连医科大学附属大连市第三人民医院眼科屈光中心就诊并行SPTTransPRK的患者25 例,年龄18~40 岁,术前最佳矫正视力≥1.0。本研究为患者自身对照,两眼按照术中有无使用0.02%MMC分为MMC组和对照组。2组患者术前球镜度、柱镜度、SE、角膜厚度、最大及最小角膜曲率组间差异无统计学意义(均P>0.05)(见表1)。术中激光治疗时间、激光切削时间、切削光区直径、切削总直径、最大及最小切削深度在2组间差异无统计学意义(均P>0.05)(见表2)。本研究通过大连医科大学附属大连市第三人民医院伦理委员会批准(批号:2019-KT-010),所有患者签署知情同意。
1.2 手术方法
术前3 d开始双眼滴0.5%左氧氟沙星眼液,预防术前细菌感染,4次/d。手术当日使用乳酸钠林格溶液充分冲洗结膜囊,使用盐酸奥布卡因滴眼液局部表面麻醉。手术设备为AMARIS 750s准分子激光机(德国视明公司),所有手术均由同一医师完成,AF模式切削角膜上皮层(55 μm)、前弹力层及基质层,术毕MMC组使用0.02%MMC棉片轻敷基质床20 s,使用吸血海绵擦干残液,使用4℃缓冲液(硫酸妥布霉素、地塞米松和乳酸钠林格混合液)冲洗基质床,对照组术毕使用缓冲液冲洗基质床。2 组均使用0.3%妥布霉素地塞米松滴眼液1滴,配戴软性治疗性角膜接触镜(美国强生公司)。术后使用0.5%左氧氟沙星滴眼液4 次/d,点眼2 周;0.3%妥布霉素/0.1%地塞米松滴眼液4次/d,点眼1周。于术后7 d摘掉角膜绷带镜,改用0.1%氟米龙滴眼液4次/d,点眼4个月,每月递减1次。所有患者摘绷带镜后使用小牛血去蛋白提取物眼用凝胶1周,0.3%玻璃酸钠滴眼液6个月缓解术后干眼。
1.3 检查方法
CD值测量使用Pentacam眼前节分析系统(德国欧科路公司)完成,使用统一遮光布保证患者在半暗室状态下接受检查,避免瞬目及偏离注视点,保证扫描图像质量,CD值结果以灰度单位(Gray scale units,GSU)显示并输出。在本研究中因10~12 mm范围的角膜在检查操作过程中受眼睑因素导致测量结果误差大,故在本研究中不予统计。于术前,术后14 d、1个月、3个月对0~10 mm范围内的角膜前部(Anterior layer)、中部(Center layer)、后部(Posterior layer)及全角膜(Total layer)的CD值进行测量。
HRTⅢ角膜共聚焦显微镜(德国海德堡公司)检查均由同一名眼科技师完成,检查前患者双眼局部表面麻醉,对角膜激光切削区正中央(0~6 mm)进行拍摄,角膜前部基质、后部基质细胞活化状态和基质细胞密度变化进行观察。
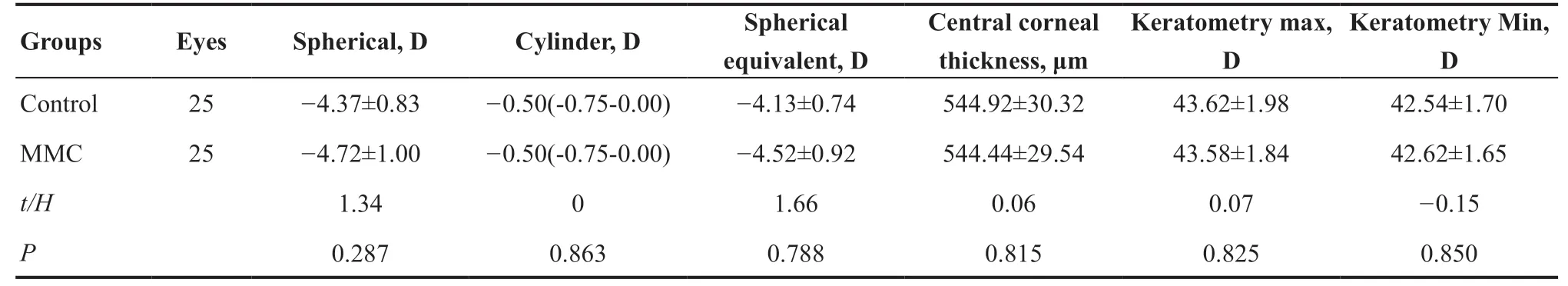
表1. 2组患者术前基线资料比较Table 1. Comparison of preoperative baseline data of the two groups
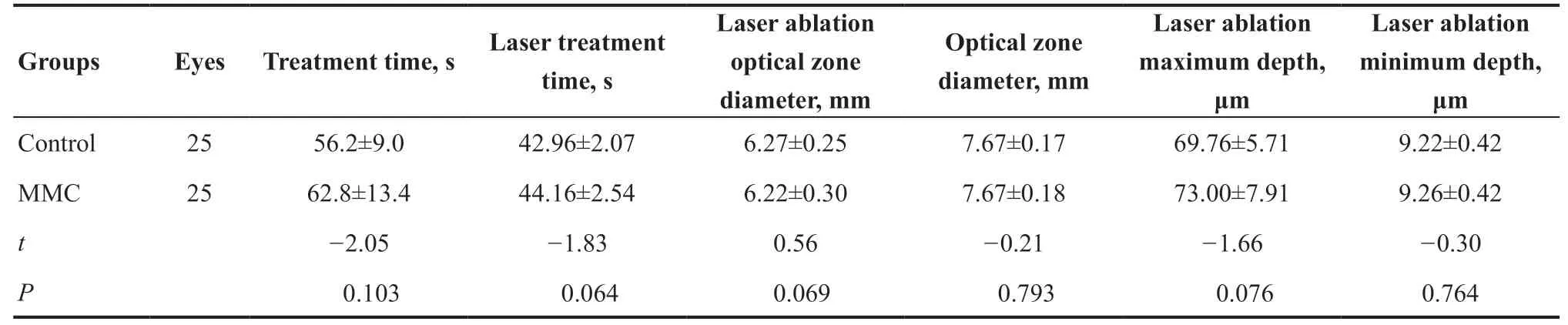
表2. 2组患者术中基线资料比较Table 2. Comparison of intraoperative baseline data of the two groups
1.4 统计学方法
前瞻性临床研究。角膜共聚焦显微镜所收集图像使用Image J软件进行图像处理分析,Pentacam光密度值结果使用SPSS 25.0进行统计分析。统计图使用prism 8.0绘制。经Shapiro-Wilk检验数据是否服从正态分布,计量资料以或中位数及四分位间距表示。对术前,术后14 d、1个月及3个月的角膜光密度值进行重复测量资料方差分析。使用Mauchly方法检验是否满足球形假设,当资料满足球形假设时,可直接进行一元方差分析;不满足时,则进行多元方差分析,对组内与组间因素进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 Haze发生率及发生等级结果
术后1个月时2组裂隙灯显微镜下观察haze发生率为4%(1/25),为同一患者的双眼,haze分级对照组0.5 级,MMC组小于0.5 级,共聚焦显微镜示同一角膜层面(44 μm)可见对照组(左眼)细胞外基质高反光物质分布广泛,蜂窝状改变明显(见图1)。MMC组(右眼)细胞外基质高反光物质分布少,细胞密度降低伴有不明显的蜂窝状改变;在该例患者中仍然可以观察到有无使用0.02%MMC的差异,因例数仅为1例,无法进行统计学分析。
2.2 0~10 mm范围内前、中、后及全角膜CD值变化
2.2.1 0~2 mm范围内前、中、后及全角膜CD值变化
术后14 d、1个月时前部、中部角膜CD值较术前升高,且术后14 d时前部MMC组[(23.94±2.27)GSU]高于对照组[(21.19±1.69)GSU](P<0.001),中部角膜CD值MMC组[(16.05±1.31)GSU]高于对照组[(15.35±0.87)GSU](P=0.008);术后1个月时前部角膜CD值升高,且MMC组[(21.94±1.54)GSU]高于对照组[(19.72±1.78)GSU](P<0.001),中部角膜CD值MMC组[(15.72±0.72)GSU]高于对照组[(15.16±0.64)GSU](P<0.001)。见表3。
对照组组内前部角膜CD值术前与术后14 d、3 个月CD 值差异具有统计学意义(P=0.004、P=0.010),MMC组术前与术后14 d、1 个月光密度值差异具有统计学意义(P<0.001、P<0.001);对照组组内中部CD值术前与术后14 d、1个月及3个月CD值差异具有统计学意义(P=0.008、P=0.034、P=0.049),MMC组术前与术后14 d、1 个月CD值差异具有统计学意义(均P<0.001)。见表3。
角膜后部CD于术后3 个月升高,其变化程度MMC组[(0.29±0.05)GSU]低于对照组[(0.68±0.10)GSU](P<0.001)。对照组术前与术后14 d、1 个月及3 个月CD值差异具有统计学意义(P=0.049、P=0.026、P<0.001),MMC组不受时间因素的影响(P=0.141)。见表3。
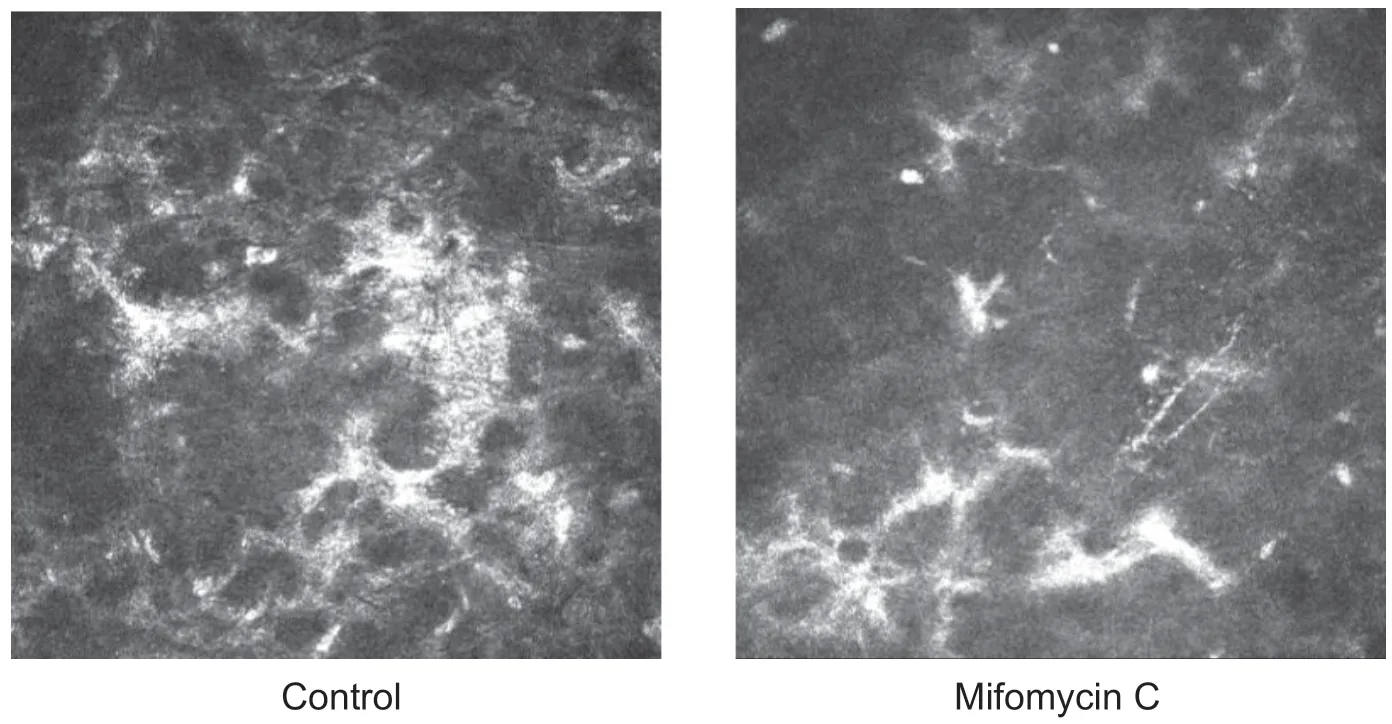
图1. SPT-TransPRK术后1个月双眼发生haze患者的共聚焦显微镜图像(×800)Figure 1. Confocal microscopy images of patients with haze at 1 month after SPT-TransPRK surgery (×800)
全CD值术后14 d、1 个月呈短暂升高趋势,组间差异具有统计学意义(P=0.001、P<0.001),对照组术前与术后14 dCD值差异有统计学意义(P=0.003),MMC组术前与术后14 d、1个月CD值差异具有统计学意义(均P<0.001)。见表3。
2.2.2 >2~6 mm范围内前、中、后及全CD变化
术后14 d时前部、中部CD值较术前升高,且术后14 d时前部角膜MMC组(19.70±1.20)GSU高于对照组(18.19±1.15)GSU(P<0.001),中部CD值MMC组(13.80±0.79)GSU高于对照组(13.44±0.83)GSU(P=0.034);术后1 个月时前部CD值降低,且MMC组(18.18±0.91)GSU高于对照组(17.11±1.02)GSU(P<0.001),中部CD值MMC组(13.58±0.52)GSU高于对照组(13.33±0.55)GSU(P=0.036)。见表4。
对照组前部CD 术前与术后1 个月、3 个月CD值差异具有统计学意义(P=0.001、P<0.001),MMC组术前与术后14 d、3个月CD值差异具有统计学意义(P=0.007、P<0.001);中部角膜2组CD值不受时间影响(P=0.839)。见表4。
角膜后部CD值于术后3 个月升高,其变化程度为MMC组(0.18±0.03)GSU低于对照组(0.47±0.13)GSU(P=0.005)。对照组术前与术后3个月CD值差异具有统计学意义(P=0.001),MMC组不受时间因素的影响(P=0.263)。见表4。
全CD值3个月内呈下降趋势,术后14 d、1个月组间差异具有统计学意义(P=0.002、P=0.005)。对照组术前与术后1个月、3个月CD值差异具有统计学意义(P=0.037、P=0.003),MMC组术前与术后14 d、3个月CD值差异具有统计学意义(P=0.028、P<0.001)。见表4。
2.2.3 >6~10 mm范围内前、中、后及全CD值变化
前部、中部CD值术后14 d、1 个月、3 个月时较术前有所降低。前部CD值MMC组低于对照组,但组间差异无统计学意义(P=0.672、P=0.174、P=0.182)。中部CD 值术后3 个月较术前下降(P=0.049)。同时对照组术前与术后1个月CD值差异具有统计学意义(P=0.005),MMC组术前与术后14 d、3个月光密度值差异无统计学意义(P=0.003、P<0.001)。后部角膜术后14 d、1个月及3个月组间差异无统计学意义(P=0.239、P=0.583、P=0.231);2组内均不受时间因素的影响(P=0.580、P=0.292)。全CD值于术后14 d、1个月及3个月时降低,但组间差异均无统计学意义(P=0.391、0.209、0.121)。见表5。
2.3 共聚焦显微镜观察角膜各部位细胞活化状态与细胞密度变化
2.3.1 术前角膜细胞活化状态与细胞密度
角膜上皮基底下隐见细胞核高亮的角膜基质细胞及排列规则深浅不一的神经纤维走形。前部基质层可见角膜细胞高亮的细胞核,细胞密度大。后部基质层见短棒状高亮细胞核,细胞密度较前部基质细胞密度小。图2示同一位患者术前角膜共聚焦检查结果。
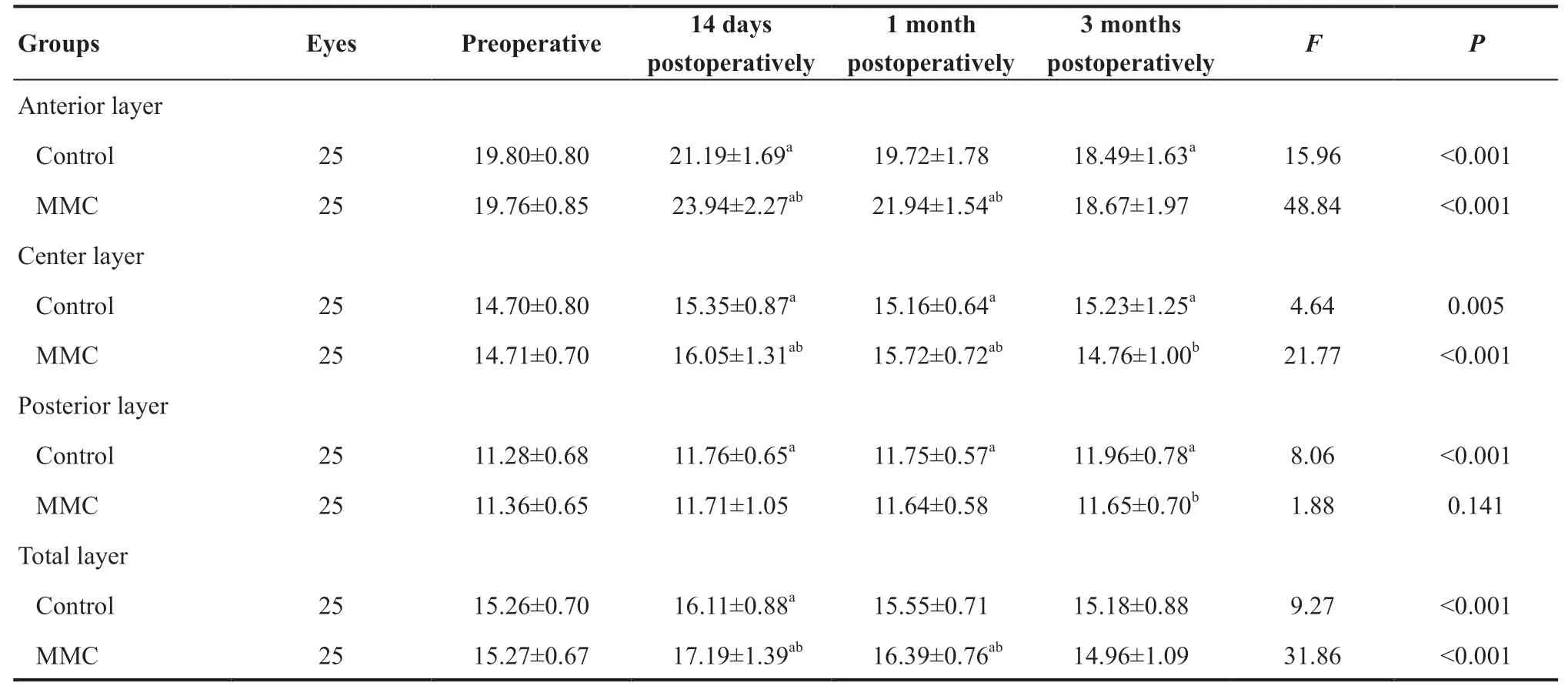
表3. 0~2 mm范围内前、中、后及全角膜光密度值(GSU)变化Table 3. 0-2 mm of anterior,center,posterior and total layer corneal densitometry (GSU) variation
2.3.2 术后14 d角膜细胞活化状态与细胞密度
观察到对照组在手术界面基底层见大量的团块状高反光物质并形成无细胞区,前基质的活化细胞数量多,后基质层细胞状态较安静。MMC组在手术界面基底层可见少许点状高反光碎屑,前基质层可见活化的角膜细胞伴细胞外基质积聚,后基质较术前无明显差别。见图3。
2.3.3 术后1个月角膜细胞活化状态与细胞密度
术后1 个月时对照组较MMC组在手术界面基底层活化的细胞外基质(高反光物质)堆积明显增强,而且可以观察到断裂的再生的神经纤维,前部基质层可以观察到MMC组的细胞密度、高亮的细胞核明显少于对照组,2组间在后基质细胞水平无差异。见图4。
2.3.4 术后3个月角膜细胞活化状态与细胞密度
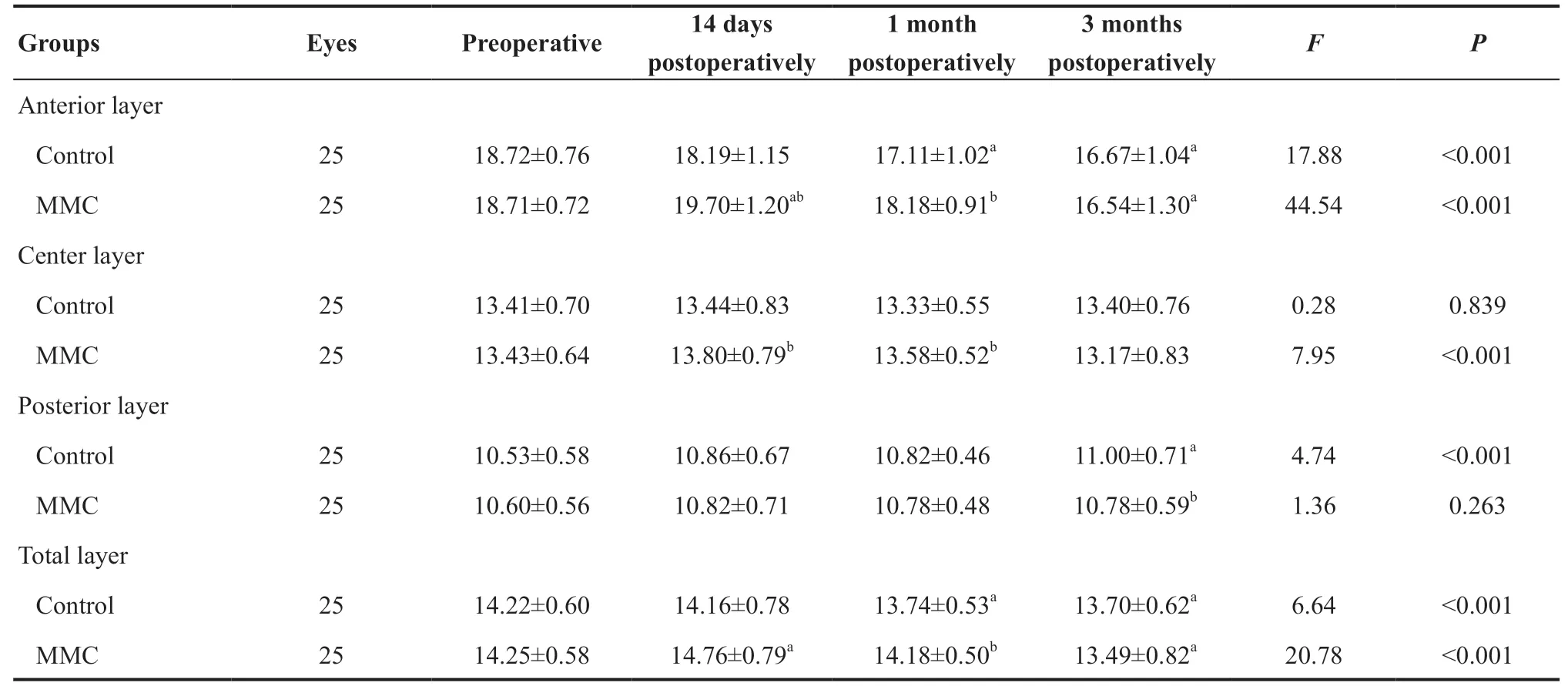
表4. >2~6 mm范围内前、中、后及全角膜光密度值(GSU)变化Table 4. >2-6 mm of anterior,center,posterior and total layer corneal densitometry (GSU) variation
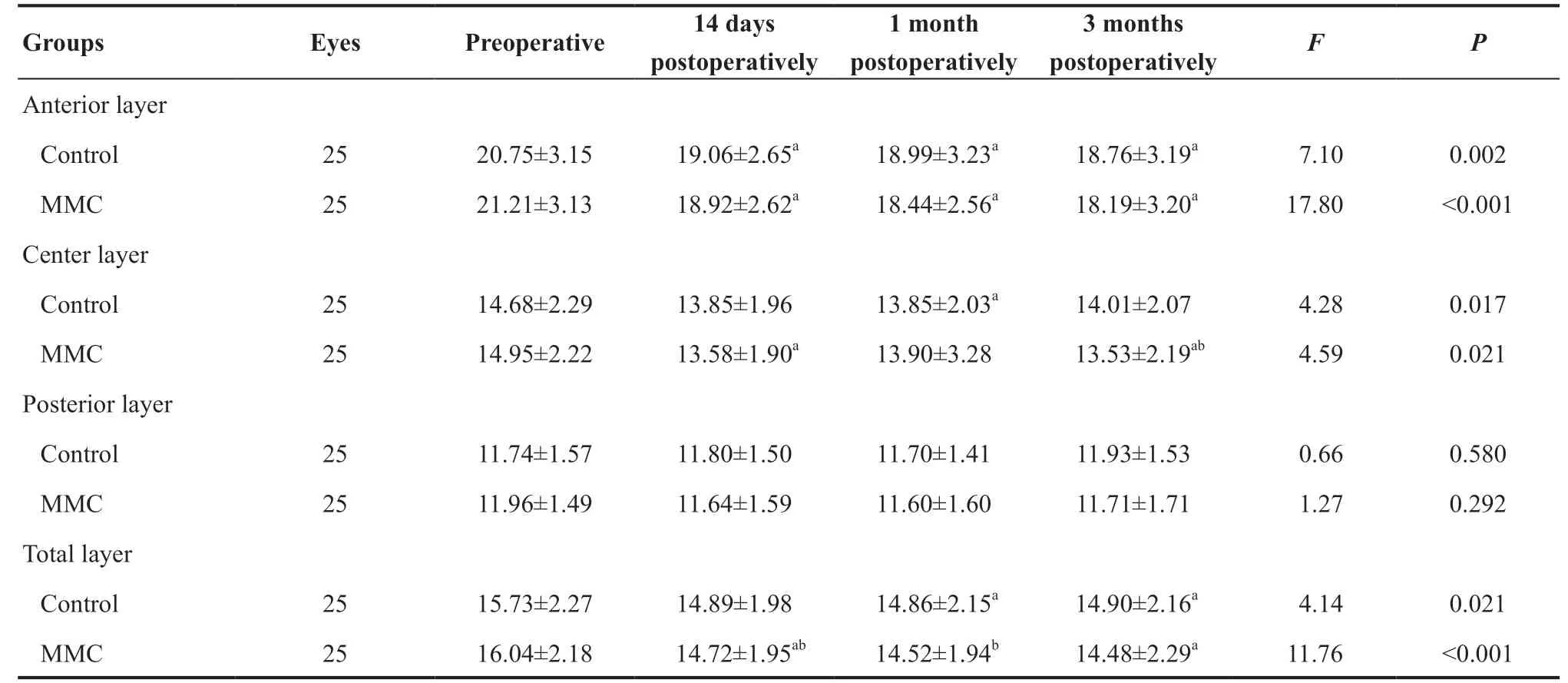
表5. >6~10 mm范围内前、中、后及全角膜光密度值(GSU)变化Table 5. >6-10 mm of anterior,center,posterior and total layer corneal densitometry (GSU) variation
术后3个月时,相较于术后1个月时2组切削区基底层的活化的高反光细胞外基质均有所减少,蜂窝状结构削弱。对照组在前部基质层中的高反光的细胞核的密度较MMC组有所增加,后部基质层2组较术前仍无明显差异,未见明显活化状态。见图5。
3 讨论
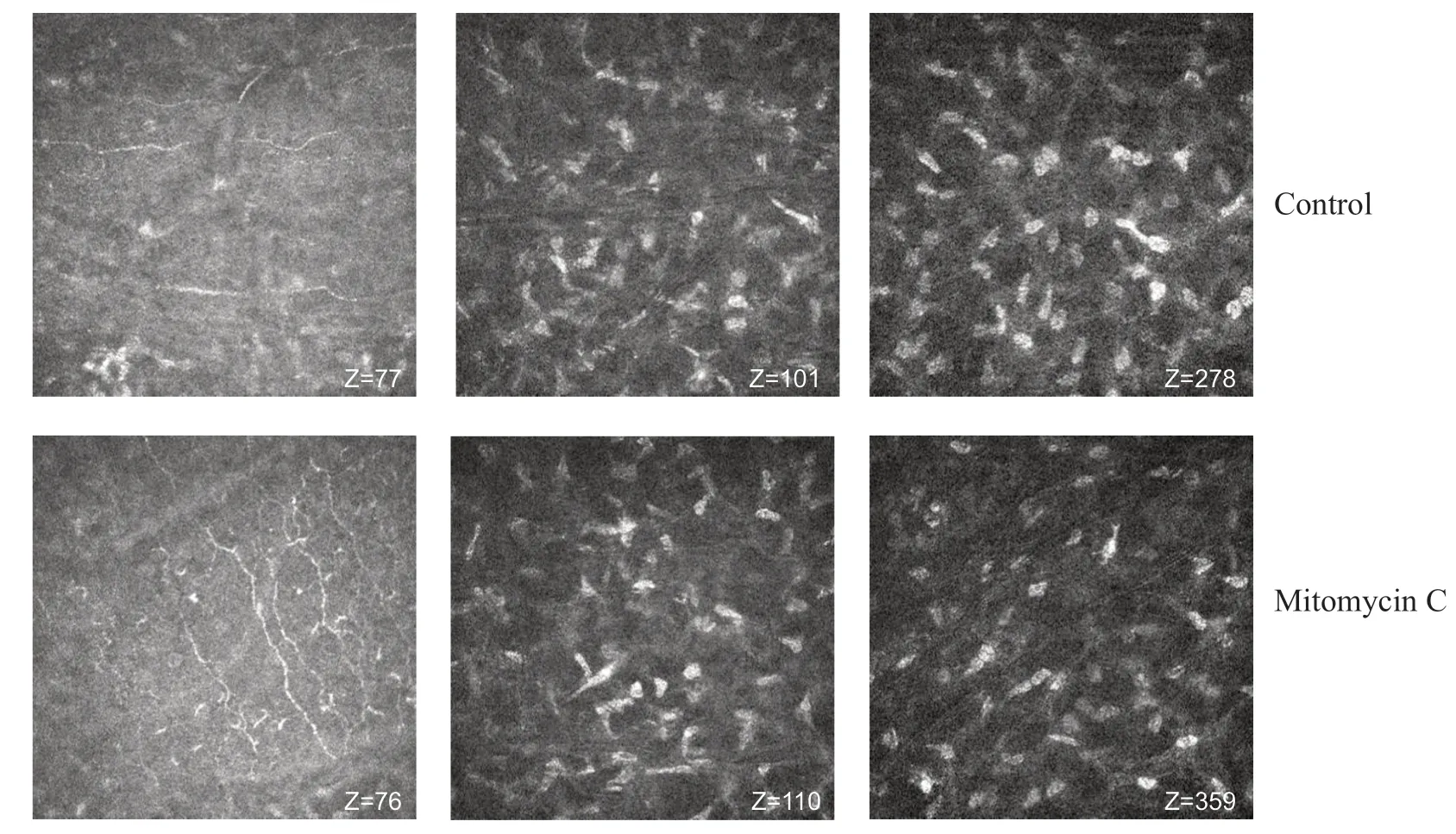
图2. SPT-TransPRK术前角膜共聚焦显微镜图像(×800)“Z”表示动态观察时角膜的深度轴Figure 2. Confocal microscopy images of cornea with SPT-TransPRK preoperatively (×800)“Z” indicated the corneal observation depth axis.SPT-TransPRK,transepithelial photorefractive keratectomy with smart pulse technology

图3. SPT-TransPRK术后14 d角膜共聚焦显微镜图像(×800)“Z”表示动态观察时角膜的深度轴Figure 3. Confocal microscopy images of cornea with SPT-TransPRK at 14 days postoperatively (×800)“Z” indicated the corneal observation depth axis.SPT-TransPRK,transepithelial photorefractive keratectomy with smart pulse technology
表层屈光手术矫正近视的同时也破坏了角膜基底膜结构[1],导致胶原纤维的异常排列[2]、细胞外基质异常分泌[3]进而形成haze。临床上常规使用0.02%MMC抑制haze的进展[4],严重的haze使角膜失去透明性,影响术后视力及视觉质量。本研究中发现的1例患者使用0.02%MMC后,haze在角膜微观结构中的表现形态与对照组存在差异,说明0.02%MMC有效影响细胞外基质的分泌,抑制胶原纤维不规则排列,这一研究结果与徐婧等[5]的TransPRK术后共聚焦显微镜观察细胞外基质及基质细胞活化状态的结果相一致。由于观察到0.02%MMC对haze的形态产生影响,而角膜组织的基质细胞是影响角膜光密度的主要因素[6],所以我们观察了所有患者的共聚焦显微镜角膜基质细胞活化及角膜光密度值的改变。

图4. SPT-TransPRK术后1个月角膜共聚焦显微镜图像(×800)“Z”表示动态观察时角膜的深度轴Figure 4. Confocal microscopy images of cornea with SPT-TransPRK at 1 month postoperatively (×800)“Z” indicated the corneal observation depth axis.SPT-TransPRK,transepithelial photorefractive keratectomy with smart pulse technology
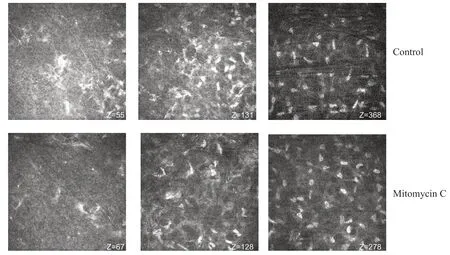
图5. SPT-TransPRK术后3个月角膜共聚焦显微镜图像(×800)“Z”表示动态观察时角膜的深度轴Figure 5. Confocal microscopy images of cornea with SPT-TransPRK at 3 months postoperatively (×800)“Z” indicated the corneal observation depth axis. SPT-TransPRK,transepithelial photorefractive keratectomy with smart pulse technology
本研究对于术前、术后角膜CD值的观察通过Pentacam眼前节分析系统,在测量的过程中使用统一遮光布,减少光的误差。本研究中对照组最大切削深度范围为(69.76±5.71)μm,MMC组为(73.00±7.91)μm。对照组切削总直径(7.67±0.17)mm,MMC组(7.67±0.18)mm。术后3个月内角膜前、中部0~2 mm范围内MMC对角膜CD值有影响,术后1个月内角膜前、中部>2~6 mm MMC对角膜CD值有影响,角膜前、中部>6~10 mm范围内MMC对CD值无影响,在术后3个月时0~10 mm范围内的前、中部角膜CD值均较术前有所下降,MMC组CD值的改变程度较对照组大。这与张嘉璠等[7]、袁倩等[8]在TransPRK术后3个月CD值较术前降低的结果一致。可能原因为屈光手术切削一部分基质床,基质细胞减少导致CD值降低,角膜透明性增加[9]。同时我们发现0~6 mm范围内角膜后部光密度值较术前增高,可能原因为Pisella等[10]提出的屈光术后角膜后部基质细胞通过有丝分裂代偿前部基质细胞的减少。同时MMC组光密度值较对照组低,可能原因为MMC抑制细胞的有丝分裂。值得注意的是,术后14 d时0~2 mm范围各部分角膜CD值出现短暂的升高,且MMC组的CD值高于对照组,组间差异具有统计学意义,由于MMC抑制细胞外基质分泌抑制基质细胞的增殖与分化,CD值理论上应该降低,考虑角膜上皮的愈合状态也参与影响了CD值。既往Lu等[11]的研究结果提示,在术后1 个月内MMC影响角膜上皮中央及旁中央区的厚度,且Chen等[12]在角膜上皮细胞的基础研究中发现更低浓度的0.005%MMC较0.01%及0.02%上调IL-1β相关的肝细胞生长因子的程度大,提示MMC的浓度对角膜上皮的愈合有一定的影响。Cankaya等[13]、Boote等[14]发现正常角膜0~2 mm范围内的CD值较高,该区域的胶原纤维排列紧密,纤维间距较小,药物短暂积存导致短暂的轻度远视与CD值的短暂升高。
除此之外,我们使用共聚焦显微镜对角膜细胞外基质活化与基质细胞密度进行观察。发现0.02%MMC减少细胞外基质的分泌,并可以观察到前部基质的细胞减少。角膜CD值代表角膜的透明性,细胞外基质与基质细胞密度均会影响角膜CD值,共聚焦显微镜观察到的结果与CD值的变化一致。其中共聚焦显微镜观察到切削区中央的后部基质细胞密度变化不大,可能原因为图片在拍摄过程中,选取的深度有所差异。
综上所述,0.02%MMC术中使用20 s在术后短期内(1个月内)影响CD值的变化,但术后3个月时CD值较术前低,后部CD的升高程度低,共聚焦显微镜观察到可有效抑制细胞外基质的分泌,降低基质细胞的活化程度,同时在随访过程中,所有患者视力均稳定在1.0 以上,提示我们应该选择更加敏锐的设备(如 OQASⅡ视觉质量分析仪)来监测患者的视觉质量,进一步探讨光密度的变化与视觉质量的关系,以及0.02%MMC在表层手术中使用的有效性和安全性。本研究尚存在的不足之处为未对共聚焦显微镜结果进行量化分析,而且样本量少导致观察到haze的例数仅为1例,日后应加大样本量继续本研究并通过医工合作开发合理量化基质细胞活化的软件。
利益冲突申明本研究无任何利益冲突
作者贡献声明闫春晓:参与选题、设计、收集数据及资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。靳琳、方石峰、张立军:参与选题、设计,资料的分析,修改论文中关键性结果、结论,根据编辑部的修改意见进行核修。王丽晶、崔林、赵丹、牟亚男:参与收集数据及资料的分析
