硼替佐米 环磷酰胺和地塞米松联合诱导治疗初诊多发性骨髓瘤患者131例的临床研究*
2022-11-02邓书会徐燕隋伟薇邹德慧安刚邱录贵
邓书会 徐燕 隋伟薇 邹德慧 安刚 邱录贵
近20 余年,随着新药广泛使用,多发性骨髓瘤(multiple myeloma,MM)的预后得到明显改善。其中硼替佐米(bortezomib,Vel)作为第一代蛋白酶体抑制剂在MM 中疗效显著[1-2]。Vel 对骨髓仅有轻微抑制,并且可逆,适合与细胞毒药物联合。既往多项研究[3-14]显示,Vel 与马法兰、环磷酰胺(cyclophosphamide,CTX)、阿霉素等的联合均取得了良好的疗效和安全性。本课题组自2008 年至2017 年制定了一系列前瞻性非随机队列研究,使用Vel 为基础的三药方案作为MM 的诱导治疗。本研究即对这期间入组研究的131 例采用BCD 方案(Vel、CTX、地塞米松)的初诊MM 患者资料进行回顾性分析,旨在对其临床效能及安全性进行总结,为临床用药提供参考。
1 材料与方法
1.1 临床资料
分析2008 年4月至2017 年8月中国医学科学院血液病医院治疗的131 例初诊MM 患者,所有患者均符合中国多发性骨髓瘤诊治指南(2020 年修订)中MM 诊断标准[15]。131 例中男性74 例,女性57 例。患者中位年龄58(30~76)岁。所有患者均接受BCD三药诱导治疗,中位治疗疗程数4(2~10)个疗程。因为是对诱导治疗方案进行分析,所以排除了非疾病原因治疗不足3 个疗程的患者。
1.2 方法
1.2.1 治疗方案 BCD 方案具体为:Vel 1.3 mg/m2,第1、4、8、11 d;CTX 500 mg/m2,第1、8 d;地塞米松20 mg,第1、2、4、5、8、9、11、12 d)。上述治疗方案21 d 为1 个治疗周期。诱导4 个周期后疗效达到部分缓解(partial response,PR)或以上的患者,后续根据年龄、体能及意愿选择自体造血干细胞移植(autologous stem cell transplantation,ASCT)或原方案巩固治疗,之后应用以沙利度胺为主的维持治疗1~2 年。
1.2.2 治疗方法 患者基础数据来源于病例资料。后续随访资料来源于治疗中的历次访视。本研究符合1964 年赫尔辛基宣言的各项规定,经本院伦理委员会批准,并获得了患者的知情同意。疗效标准采用国际骨髓瘤工作组(IMWG)的骨髓瘤疗效标准[16],分为严格的完全缓解(stringent complete response,sCR)、完全缓解(complete response,CR)、非常好的部分缓解(very good partial response,VGPR)、PR、微小缓解(minimal response,MR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。总体反应率(overall response rate,ORR)定义为PR 及以上缓解。微小残留病(minimal residual disease,MRD)水平应用多参数流式检测[17],检测敏感度为1×10-4。总生存(overall survival,OS)时间从诊断之日起至末次随访日止,死亡的患者算至死亡日止。无进展生存(progression-free survival,PFS)时间从确诊之日起至发生疾病进展/复发之日止,死亡的患者算至死亡日止,如果治疗无效,则计PFS 时间为0。至末次随访日仍无上述事件发生的则算至末次随访日止。
1.3 统计学分析
采用SPSS 25.0 软件进行统计学分析。生存分析采用Kaplan-Meier 法,显著性检验采用Log-rank 法,并用Cox 回归模型进行多参数分析,率的比较采用χ2检验,均数比较采用独立t检验或方差分析的双侧检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者临床特征
43 例患者年龄>65 岁。27.3%(24/88)年龄<65 岁的患者进行了一线ASCT。根据M 蛋白类型,IgG 型所占比例最高,为52.7%;其次为IgA 型占比20.2%,单纯轻链κ 和轻链λ 型共计占20.2%;IgD 型占比5.3%,不分泌型占比0.8%;未见IgM、IgE 及双克隆型,见表1。患者实验室检查、细胞遗传学结果以及分期情况具体,见表1,2。

表1 患者临床特征
2.2 疗效及预后分析
共有130 例患者可以进行疗效评估。患者总体的ORR 为88.5%,其中达到VGPR 以上的比例为50.0%,达到CR/sCR 的比例为23.8%。达到PR 的中位疗程数为1(1~6)个。共有30 例患者应用新一代多色流式进行了MRD 的监测,其中15 例(50.0%)患者获得MRD 阴性。不同临床特征患者疗效情况见表2。ISS 分期Ⅰ期或R-ISS 分期Ⅰ期患者ORR 以及VGPR 以上缓解率水平更高,但与Ⅱ/Ⅲ期患者相比,差异无统计学意义(P>0.05)。就单个细胞遗传学异常进行的分析显示,具有p53 缺失或IgH/MAF 易位的患者ORR 较低(P<0.05),具有IgH/FGFR3 易位或者1q21 扩增并未明显影响患者的缓解水平。
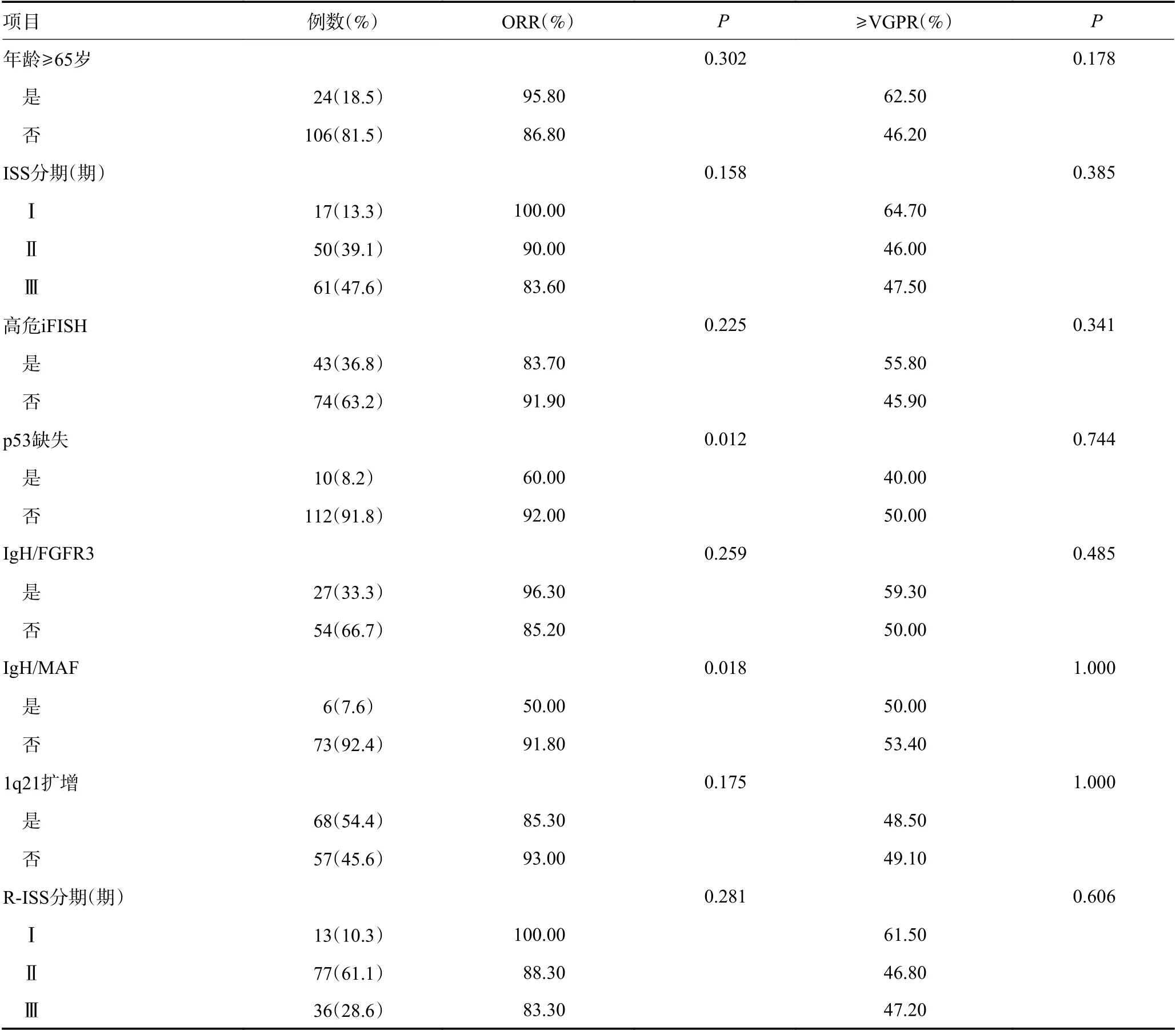
表2 不同临床特征患者BCD 诱导治疗后的疗效比较
中位随访36.4 个月,患者总体的中位PFS(median PFS,mPFS)为36.0 个月,中位OS(median OS,mOS)为63 个月(图1)。单因素分析显示,LDH 水平正常、MRD 阴性、ASCT、ISS 分期Ⅰ/Ⅱ期、R-ISS 分期Ⅰ/Ⅱ期为PFS 和OS 的预后良好因素;除此以外,无1q21 扩增、达到VGPR 或以上疗效也是PFS 的预后良好因素,而年龄<65 岁是OS 的预后良好因素(P<0.05)。本研究中p53 缺失和IgH/MAF 易位患者例数较少,未纳入预后分析。针对IgH/FGFR3 易位进行的分析显示,其对患者PFS、OS 均未见明显不良影响(图2)。多因素分析显示,PFS 的独立预后因素依次 为R-ISS 分 期(RR=0.467,95%CI:0.263 ~0.829;P=0.009)和ASCT (RR=2.069,95%CI:1.090~3.888;P=0.026)。OS 的独立预后因素依次为R-ISS 分期(RR=0.219,95%CI:0.093~0.517;P=0.001)和年龄<65 岁(RR=3.759,95%CI:1.527~9.259);P=0.004)。因检测例数较少,MRD 未纳入多因素分析。
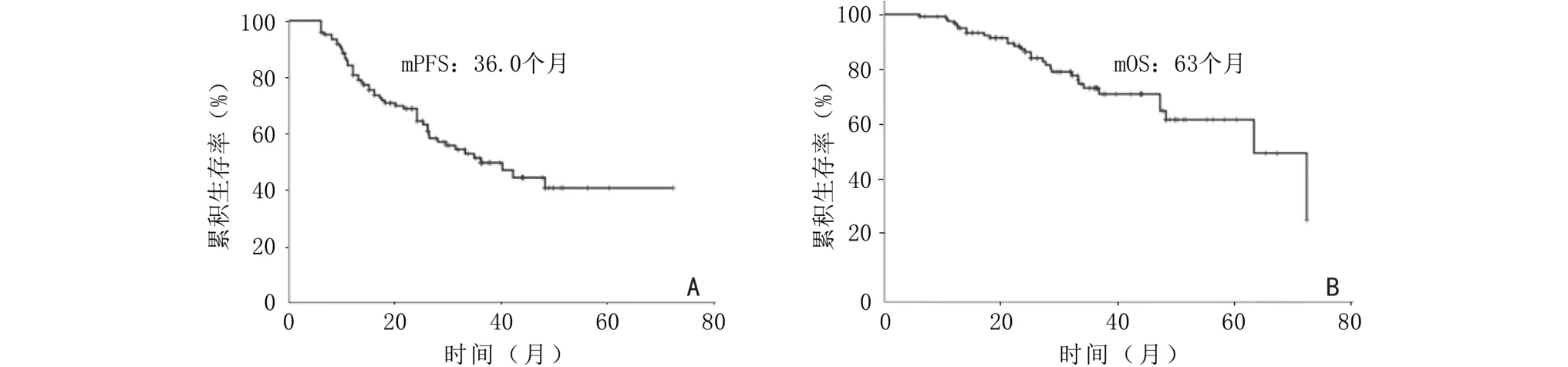
图1 BCD 诱导治疗患者的生存分析

图2 IgH/FGFR3 易位阴性和阳性患者接受BCD 诱导治疗后的分析
2.3 安全性分析
诱导治疗过程中,非血液学毒性方面最常见的毒性依次为感染、周围神经炎(peripheral neuropathy,PN)、胃肠道反应、神经性疼痛等,见表3。PN 多数为CTCAE 1~2 级,3/4 PN 发生率为4.7%。血液学毒性方面,中性粒细胞减少及血小板减少均较为常见,其中CTCAE 3~4 级中性粒细胞减少发生率为25.4%,3/4 级血小板减少发生率为27.2%(表4)。贫血更多见于患者治疗的第1~2 个周期,主要是与PN相关。
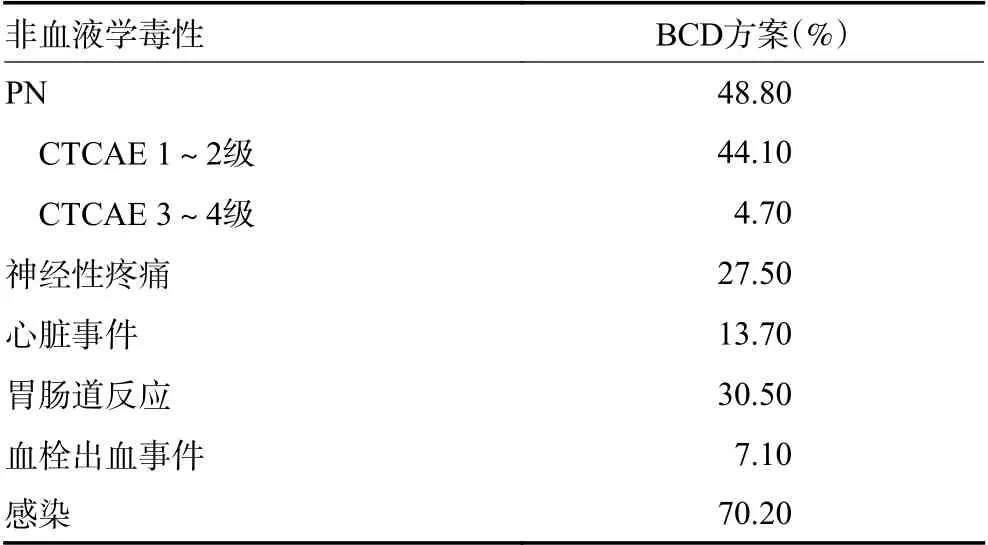
表3 131 例患者非血液学毒性的发生情况
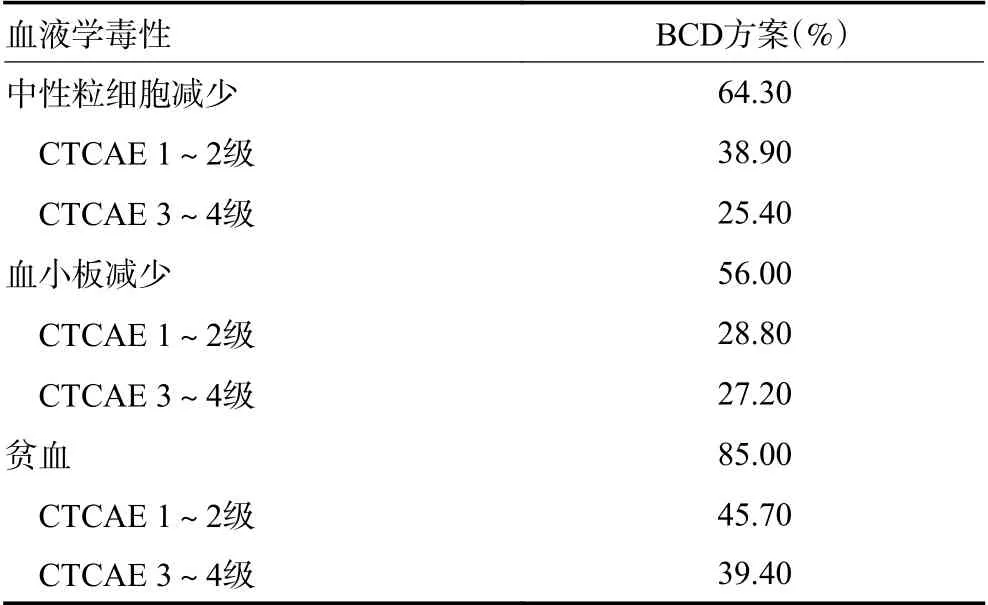
表4 131 例患者血液学毒性的发生情况
3 讨论
近20 年来,新药的广泛应用带来了MM 疗效的显著提高。这其中Vel 的表现最为突出,且目前仍是MM 的骨架用药。SUMMIT(Ⅱ期)[18]和APEX(Ⅲ期)[19-20]研究是Vel 得以获批用于复发难治性MM 的两项关键性临床试验。SUMMIT 研究中经Vel 联合或不联合地塞米松治疗后,ORR 为35%。APEX 研究中Vel 联合地塞米松治疗的ORR 为38%。上述研究结果显示,Vel 切实有效,但同时也可以看出其疗效仍有较大的提升空间。而后多项体内外研究显示Vel与数种抗骨髓瘤药物具有协同作用,且安全性良好。因此,后续以Vel 为基础的三药联合成为最常用的治疗方案[1-3,6-9,11,14]。现阶段,Vel 联合来那度胺的VRD方案已逐渐成为诱导治疗的主流选择,但因为药物价格以及可及性等因素,在很长一段时间内传统化疗药物CTX 成为Vel 最常见的配伍用药。本研究显示,在初诊患者中,BCD 诱导治疗方案的总有效率为88.5%,达到VGPR 以上的比例为50.0%,达到CR/sCR 的比例为23.8%,中位起效时间仅1 个周期。文献[3-4,6-8,14,21-26]中BCD 诱导治疗的ORR 约为69.7%~88.0%,VGPR 以上缓解率为37%~61%,与本研究结果相符。提示虽然各个研究中药物用法用量存在一些差异,但总体而言,BCD 诱导方案有效率较高。本研究同时也有比较完整的生存随访,患者mPFS 为36.0 个月,mOS 为63 个月。其中PFS 数据与IFM2009研究[27](PFS 为36.0 个月)以及SWOGS-0777 研究[28](PFS 为43 个月)中VRD 治疗组也无显著差异,均提示BCD 作为诱导治疗预后良好。此外,多因素分析显示ASCT 可以进一步延长患者的PFS,而年龄仍然是MM 患者OS 的独立预后因素。
对于MM 的遗传学危险度分层,存在mSMART、IMWG 等多个体系,并且仍然在研究发展之中[1-3,26,28]。目前公认的MM 高危细胞遗传学异常主要有p53 缺失、IgH/FGFR3 易位和IgH/MAF 易位3 种。本研究对这3 种细胞遗传学异常进行了相关分析,结果显示具有p53 缺失(10 例)或IgH/MAF 易位(6 例)患者的ORR 明显较低(P<0.05),因为例数过少,后续未对这两类异常进行生存分析。27 例(33.3%)患者存在IgH/FGFR3 易位,比例较既往研究(12%~15%)[27-28]及我中心总体患者统计中偏高,可能体现了治疗选择偏倚。虽然例数仍然偏少,但结果显示,IgH/FGFR3易位阳性患者应用BCD 方案,不论诱导后缓解水平,还是生存情况(PFS 和OS),均较阴性患者无显著性差异。提示以Vel 为基础的治疗能够改善IgH/FGFR3易位的不良预后,因此未来对于不同细胞遗传学异常在危险度分层中的权重可能需要再评估[1-3,15,29,30]。当然,上述研究结果仍需更大系列随机对照临床研究进一步证实。
安全性方面,本研究中周围神经炎、心脏事件、胃肠道反应、血栓出血事件等非血液学毒性均与既往研究相当。血液学毒性方面,CTCAE3/4 级中性粒细胞减少和血小板减少发生率分别为25.4% 和27.2%。既往Mai 等[6]的研究中BCD 诱导治疗后CTCAE 3~4 级白细胞少/粒细胞少发生率35.2%,但是该研究中CTX 用法为900 mg/m2第2 d 应用。因此,推测CTX 单次较大剂量,使得骨髓抑制加重。目前,多数学者认为拆分后的CTX 在MM 中可以通过稳定分布和总剂量增加来提高疗效。而且低剂量CTX 具有多种作用,包括直接抗肿瘤、抗血管新生、调节微环境、以及改善T 细胞和NK 细胞介导的抗肿瘤免疫应答等[9,12,24-25]。因此,目前拆分、低剂量的CTX 应用方式更为普遍。本研究显示,BCD 中CTX 500 mg/m2第1、8 天的应用方式高效低毒,具有良好的有效性和安全性。此外,虽然CTX 属于烷化剂,但是长期应用CTX 对干细胞的毒性有限,远低于马法兰、卡莫司汀等,所以本研究未对后续造血干细胞动员采集的情况进行分析。
综上所述,以Vel 为基础、联合传统烷化剂CTX的三药方案BCD 作为诱导治疗,可使80%以上的初诊MM 患者获得缓解,诱导治疗后年龄较轻能够接受一线ASCT 的患者疗效及预后更佳。在此治疗基础上,IgH/FGFR3 易位对患者的疗效及生存无明显不良影响。与既往文献相比,低剂量、分次应用CTX 的方法安全性更优。
