5种植物精油抗菌性能研究及特征成分分析
2022-11-02于芯宜徐家延陈方圆李莉刘玲玲王琛鑫
于芯宜,徐家延,陈方圆,李莉,刘玲玲,*,王琛鑫
(1.浙江科技学院生物与化学工程学院,浙江省农产品化学与生物加工技术重点实验室,浙江省农业生物资源生化制造协同创新中心,浙江杭州310023;2.浙江大学生物系统工程与食品科学学院,农业农村部农产品产后处理重点实验室,浙江杭州310058)
大肠杆菌(Escherichia coli)和枯草芽孢杆菌(Bacillus subtilis)是自然界中分布广泛的微生物,在食品加工过程中最易繁殖。众多研究表明,植物精油对E.coli和B.subtilis等细菌有抑制作用,并且能够与食品直接接触。因此,本试验就丁香、薰衣草、桉叶、香茅和肉豆蔻5种精油对E.coli和B.subtilis的抑制效果进行了研究,对各精油中主要的特征成分进行了分析,旨为开发植物源天然抗菌剂在食品保鲜中的应用提供理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
丁香精油(CLEO)、薰衣草精油(LEO)、肉豆蔻精油(NEO),购自广州晶晶生物科技有限公司;桉叶精油(EEO)、香茅精油(CEO),购自深圳市国鑫香料有限公司,密封4℃下保存待用;胰蛋白胨、酵母提取物、琼脂、葡萄糖,均为国产市售;PCA平板计数培养基,购自杭州百思生物技术有限公司;正己烷(纯度99%,色谱纯),购自上海麦克林生化科技有限公司;无水乙醇(纯度99%,分析纯),购自上海国药控股化学试剂有限公司。E.coli和B.subtilis为本实验室筛选。
1.1.2 设备与仪器
SpectraMax iD3多功能酶标仪,美谷分子仪器(上海)有限公司;SW-CJ-2D型净化工作台、LRH-150细菌培养箱,上海一恒科学仪器有限公司;LDF-50L-l型立式高压蒸汽灭菌器,上海申安医疗器械厂;Agilent 7890-5975C型气相色谱-质谱联用仪,安捷伦科技(中国)有限公司。
1.2 方法
1.2.1 菌悬液的制备
用灼烧冷却后的接种环挑取少量保藏的菌种,接种到已经灭菌好的Luria-Bertani(LB)液体培养基的试管中,充分混合,于37℃培养箱中培养24 h进行活化。对活化后的菌悬液进行10倍系列稀释,选取调至浓度为含菌体104~105CFU/mL的菌悬液(测定菌悬液的OD600值在0.31左右),备用[9]。
1.2.2 精油浓度梯度稀释和最小抑菌浓度的测定
采用二倍稀释法测定精油的最小抑菌浓度(Minimal inhibit concentration,MIC)。将精油用40%乙醇溶液稀释至浓度为200 μg/mL,摇匀备用。取300 μL稀释后的精油于装有5.70 mL LB液体培养基的试管中,然后采用二倍稀释法,依次得到含有浓度分别为10.00、5.00、2.50、1.25、0.63、0.31、0.16、0.08 μg/mL的精油培养基。设置对照组A:只含培养基,不含精油(完全生长);对照组B:5.70 mL LB培养基和300 μL 40%乙醇溶液;对照组C:只有培养基,不接种菌悬液(空白对照组)。分别将50 μL稀释好的菌悬液加至上述不同浓度的精油溶液和对照组中,每个浓度进行2组平行组,于37℃培养箱中悬浮培养24 h。观察试管液体培养基中菌体的生长情况并做好记录,培养结束后,若培养基浑浊,则说明有菌生长;对于临界的透明试管(培养前后OD600值之差几乎不变的最低精油浓度),需要进行检验。从临界透明离心管及与之相邻的2支试管中取液体培养基100 μL转接平板,37℃培养24 h,进行菌落计数,确定精油的MIC[10]。
1.2.3 植物精油特征成分分析
称取精油0.1 g,加入正己烷,溶解定容至10 mL容量瓶中。采用气相色谱-质谱联用仪(GC-MS)对其组成成分进行分析。参照张晶琳[11]的方法,稍作修改进行测定。
采用程序升温法对植物精油进行分析。初始温度为50℃,保持3 min,然后以5℃/min程序升温至120℃,保持2 min,再以10℃/min程序升温至250℃。喷射器和检测器温度为280℃;色谱柱为DB-5(30 m×0.25 mm×0.2 μm);载气为高纯氦气(纯度>99.99%);分流比1∶50。质谱条件:电子轰击电离源(EI),电子能量70 eV,接口温度280℃,离子源温度250℃,溶剂延迟5 min[12]。
1.2.4 数据处理
利用Excel软件进行数据分析,再通过GC/MSD化学工作站软件分别整理5种精油的成分含量表格,分别根据其中组分含量分析其与相应精油抑菌作用的关系。
2 结果与分析
2.1 5种植物精油对两种代表菌的抑制效果研究
2.1.1 5 种精油对E.coli的抑菌作用
由表1可知,5种精油对E.coli生长的抑制活性排序为:CLEO>LEO=NEO>EEO=CEO,CLEO对E.coli的抑制作用最强,MIC为1.25 μg/mL;LEO、NEO对E.coli的抑制效果相当,MIC为5.00 μg/mL,EEO和CEO对E.coli影响最弱,MIC均为10.00 μg/mL。由表2可知,5种精油对B.subtilis生长的抑制活性排序为:NEO>CLEO>LEO=CEO>EEO。NEO对B.subtilis的抑制作用最强,MIC为0.31 μg/mL;CLEO对B.subtilis的抑制作用较强,MIC为0.63 μg/mL;EEO对B.subtilis的抑制作用最弱,MIC为2.50 μg/mL。CLEO对两种细菌的抑菌区间为0.63~1.25 μg/mL,LEO对两种细菌的抑菌区间为1.25~5.00 μg/mL,CEO对两种细菌的抑菌区间为1.25~10.00 μg/mL,NEO对两种细菌的抑菌区间为0.31~5.00 μg/mL,EEO的抑菌效果最差。这一结论符合前人所总结的革兰氏阴性菌对植物精油的耐受性优于革兰氏阳性菌[6]。

表1 不同种类及浓度的精油对E.coli的抑制作用Table 1 Inhibitory effects of different species and concentrations of EOs on E.coli
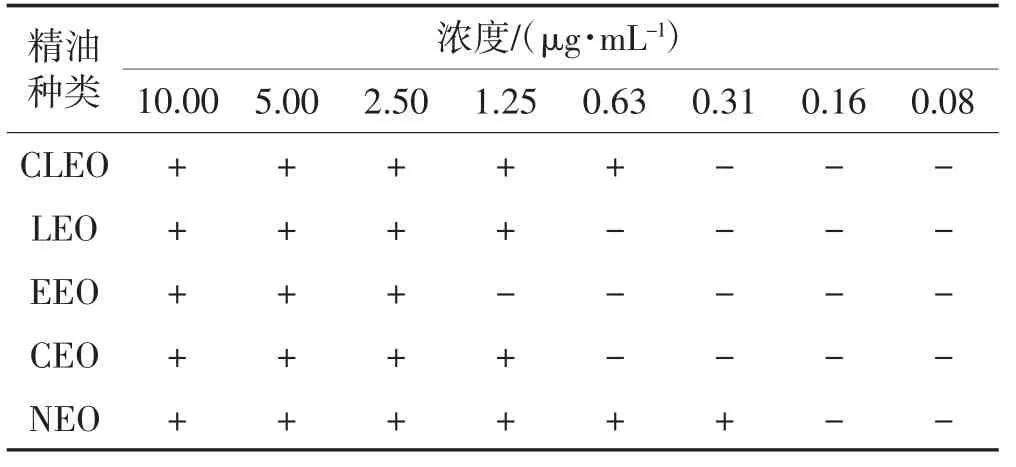
表2 不同种类及浓度的精油对B.subtilis的抑制作用Table 2 Inhibitory effects of different species and concentrations of EOs on B.subtilis
5种植物精油均对E.coli和B.subtilis有良好的抑制作用。精油会影响细胞膜的正常功能,导致其功能损害,细胞内物质外泄[13]。同时可以看出,各组精油对B.subtilis的MIC均低于对E.coli的MIC,得出同等浓度下精油的杀菌效果对B.subtilis更显著。本试验选取的菌种为革兰氏阳性菌(B.subtilis)和革兰氏阴性(E.coli)的代表菌株,其对精油的敏感程度不同主要区别在于细胞壁的结构不同。相较于革兰氏阳性菌,革兰氏阴性菌的细胞壁由肽聚糖、脂蛋白、磷脂层和脂多糖层组成,能在一定程度上阻隔精油,即提高对精油的耐受性,使得需更高浓度精油才能达到作用效果[14]。
2.2 5种植物精油的成分分析结果
2.2.1 精油成分及含量
由表3和图1可知:CLEO中的化合物较少,主要成分为丁香酚(相对含量84.90%),与前人研究报道一致[15];其次为石竹烯,相对含量为13.27%;其余的化合物(α-石竹烯和氧化石竹烯)的相对含量较少。具体含量以及次要组分与已有报道[16]存在一定差异,主要是因植物品种、产地及气候等因素造成上述化学成分的多样性和含量差异,同时分析检测的仪器、方法和条件等也可能会引起结果的不同。丁香酚为CLEO中的主要成分,即可以推测CLEO的良好抑菌活性主要来源于丁香酚。相关研究表明,丁香酚具有良好的抗菌活性,且与其酚羟基结构增大物质活性密切相关[17-19];疏水性基团隔离细菌细胞膜脂质和线粒体,改变细胞结构增加细胞膜通透性[20-21];此外,研究表明,丁香酚可以通过改变细菌胞内酶的分子结构及构象,从而达到降低酶活性,抑制细菌生长繁殖的效果[22-23]。
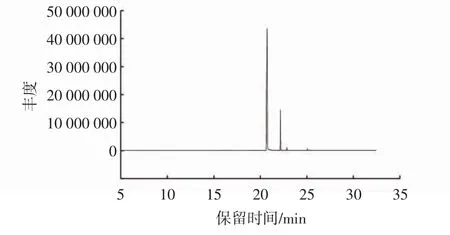
图1 丁香精油的总离子流色谱图Fig.1 Total ion chromatogram of CLEO
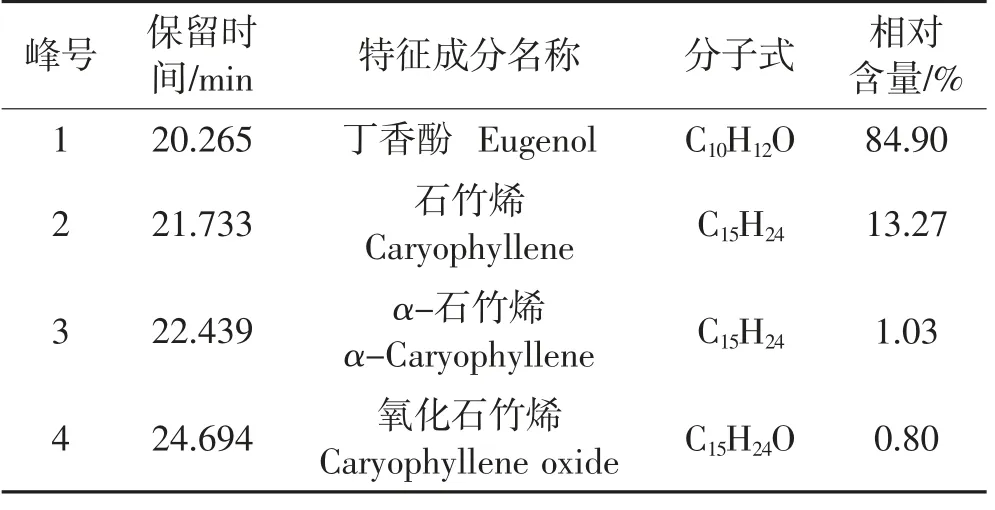
表3 CLEO的特征成分Table 3 Characteristic components of CLEO
由表4和图2可知:LEO中的化合物较多,以醇类(44.62%)和酯类(37.45%)物质为主,还含有少量的萜烯类。其中含量最多的是乙酸芳樟酯,相对含量为34.05%,该酯又名乙酸沉香酯,多存在于天然薰衣草、香柠檬等植物的精油中,是芳樟醇的主要酯类化合物[24];其次为芳樟醇,相对含量为28.40%,芳樟醇属于链状萜烯醇类物质,具有铃兰香气;再者是(R)-2-樟脑(9.11%)和桉树醇(7.54%),这些都是薰衣草精油的特征香气成分[25],且桉树醇、芳樟醇和乙酸芳樟酯的含量越高,则精油的抗菌作用越好[26]。杨滢滢等[27]研究表明,芳樟醇对果蔬采后致病菌有良好的抑菌活性。通过对生长曲线测定和细胞形态观察,郭俸钰等[28]发现,芳樟醇因其疏水作用破坏细胞的细胞膜,进而破坏其通透性和完整性,影响细菌细胞的正常能量代谢,导致菌体死亡,且作用效果随着芳樟醇浓度的增加而增强。
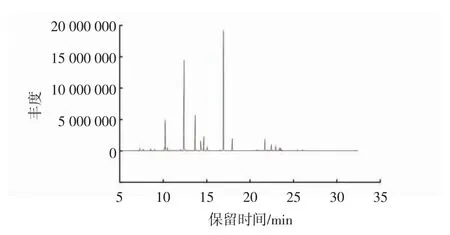
图2 薰衣草精油的总离子流色谱图Fig.2 Total ion chromatogram of LEO
由表5和图3可知:EEO的主要成分为桉树醇(34.29%)、D-柠檬烯(18.39%)、β-伞花烃(8.79%)、3-蒈烯(6.99%)和α-萜品油烯(6.60%),其中桉树醇和D-柠檬烯总相对含量为52.68%。桉树醇又名桉树脑,是一种一萜醇,化学性质稳定,具有抗菌、抗氧化、抗炎等广泛的生物活性。桉树醇处理真菌可致真菌的结构异常及生理功能紊乱等,从而达到抑菌效果[29]。柠檬烯是一种天然的功能单萜,具有广谱抑菌性,其抑菌效果受环境条件(温度、浓度、pH条件、易挥发性等)影响。柠檬烯对细菌、真菌的抑制机理主要为作用于细菌的蛋白表达基因,破坏细胞形态和结构,抑制呼吸复合物及相应的代谢酶活性[30]。EEO成分包含了脂肪烃类化合物、醇类化合物、桉树醇及萜烯类化合物,不同品种的桉树叶挥发性成分不同[23]。祝一鸣[31]研究表明,不同桉树叶片挥发油对桉树青枯菌均有明显的抑制作用,植物精油的抗性作用由主要化合物及次要化合物共同作用导致。

表5 EEO的特征成分Table 5 Characteristic components of EEO
由表6和图4可知:CEO中的主要成分为(R)-香茅醛(16.22%)、柠檬醛(11.72%)、(R)-花侧柏烯(16.04%)、(S)-顺式-去氢白菖烯(7.99%)、反式-香叶醇(5.9%)和D-柠檬烯(5.42%)。香茅属精油的主要成分及组分含量会因其基因、产地、环境和采摘时间等因素影响而具有较大差异,主要成分多为烯萜、酚、醇,含顺式-柠檬醛和反式-柠檬醛的比例较高[32]。杨辉祥等[33]对福建厦门产香茅精油的抑菌性及抗氧化活性进行研究发现,香茅精油具有广谱抑菌活性及强抗氧化活性。曾桃花等[34]研究表明,香茅醛对细胞群体感应具有高效的抑制作用,能调节铜绿假单胞菌毒力基因的表达水平。郭丹[35]研究表明,香茅醛和柠檬醛对纤维素降解酶、多聚半乳糖醛酸酶、果胶甲基半乳糖醛酸酶、多聚半乳糖醛酸转移消除酶、果胶甲基转移消除酶活性均具有良好的抑制作用,且浓度越高,抑制率越高。吴建挺[36]研究表明,香茅醛具有良好的抑菌效果,能引起细菌细胞膜透性和胞内酶活性发生改变。
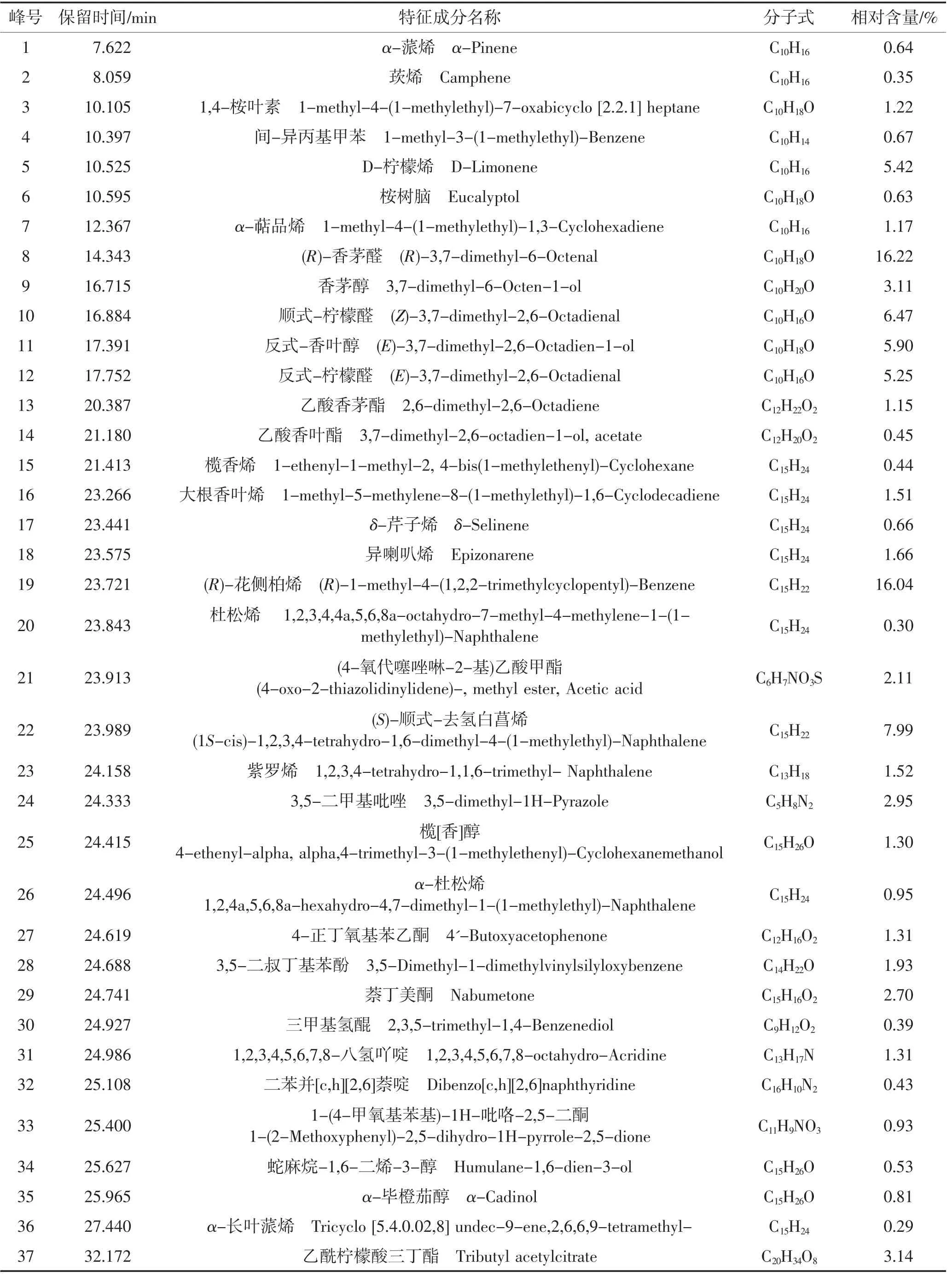
表6 CEO的特征成分Table 6 Characteristic components of CEO
由表7和图5可知:NEO成分包括脂肪烃类、醇、酚、萜烯类及酯类化合物,主要成分具体为α-蒎烯(23.96%)、柠檬烯(32.68%)、(S)-α-松油醇(21.44%)、α-松油烯(6.04%)和丁香酚(4.08%)。柠檬烯又称苎烯,相对分子质量136.24,是多种水果(主要为柑橘类)、蔬菜及香料中存在的天然成分。本研究中NEO的成分以烯类(67.86%)和醇类(24.49%)物质为主。相关研究表明,采用水蒸气蒸馏法提取肉豆蔻挥发油,用气相色谱-质谱联用法分析其化学成分和相对含量发现,挥发油除了主要含有单萜类化合物及其衍生物和倍半萜外,还含有肉豆蔻醚等苯丙素类化合物和榄香素。赖闻玲等[37]也报道了肉豆蔻挥发油含有肉豆蔻醚、榄香素和黄樟醚3个醚类化合物。本研究中未直接发现肉豆蔻醚和榄香素,主要是由于肉豆蔻原料和储藏条件的差异性导致化学成分和含量不同,另外精油的制备和提取方法上的差异也会造成化学成分及含量的差异。邱琴等[38]采用超临界二氧化碳萃取法提取的肉豆蔻精油主要活性物质为肉豆蔻酸、肉豆蔻醚、松油烯-4-醇、α-蒎烯、黄樟醚等,大分子量的成分相对较多。微波辅助-水蒸气蒸馏法较传统的水蒸气蒸馏法在提取所得的挥发油中具有较高含量的高沸点含氧类化合物。多数研究表明,含氧类化合物与挥发油的特殊香气有着密切关系,且与挥发油的品质呈正相关[39]。

表7 NEO的特征成分Table 7 Characteristic components of NEO
图5 肉豆蔻精油的总离子流色谱图Fig.5 Total ion chromatogram of NEO
3 结论与讨论
5种植物精油经GC-MS分析证实其成分复杂,含有多种化学成分,共有的主要成分为烯类、酚类和醛类物质。这些成分与植物精油的抗菌活性密切相关。这些物质能对细菌的细胞壁、细胞膜、脂肪酸、蛋白质、代谢活动产生影响,从而使细菌无法正常生长繁殖。本试验中,丁香精油对革兰氏阴性代表菌(E.coli)和革兰氏阳性代表菌(B.subtilis)的抑制效果都很明显,丁香精油所含具有广谱抑菌性的丁香酚占比达84.90%,丁香酚在细菌生长环境中稳定性较好,并且能够使细胞膜渗透性发生改变,从而造成细胞快速死亡。肉豆蔻精油对革兰氏阳性代表菌的抑制效果较明显,除了醇类和酚类物质对细菌有抑制作用外,其含有的烯类物质在临床医学上也被广泛用于抗真菌感染的抗生素中,推测其对于细菌生长也有一定抑制作用。薰衣草精油对革兰氏阴性和革兰氏阳性代表菌的抑菌作用一般,桉叶精油和香茅精油的抑菌作用相对较弱,这与未检测到抑菌活性较高的酚类物质有关。关于精油的有效成分有待进行进一步的分离纯化,验证其抑菌效果并揭示其抗菌机理。同时,通过精油抑菌性能的比较和组分的分析,进一步证明植物精油的抑菌广谱性,这些结论为更好地开发和利用绿色、安全、高效的新型抗生素替代品及复合型的植物源天然抗菌剂,提高生产效率、降低生产成本提供理论依据。
