载银/钴β-磷酸三钙的抗菌性能评估及其应用于感染性骨缺损治疗研究*
2022-11-01刘昱辰韩秋阳汪寿腾谢克难杨为中
何 帅,刘昱辰,韩秋阳,汪寿腾,谢克难,谢 璐,邓 怡,杨为中
(1. 四川大学 化学工程学院,成都 610065; 2. 中国人民解放军63820部队医院,四川 绵阳 621051;3. 四川大学 生物医学工程学院,成都 610065; 4. 四川大学 华西口腔医院,成都 610041)
0 引 言
生物陶瓷β-磷酸三钙(β-TCP)凭借其优越的骨诱导性、优异的生物相容性、耐腐蚀性能以及与人体骨骼具有相似的结构和性能等诸多优点,逐渐成为骨组织修复领域的首选植入材料之一[1-4]。但是,由于β-TCP本身缺乏杀菌能力,在植入手术过程中易引起植入体周围感染(IAI)从而导致植入手术失败[5]。细菌感染,尤其是IAI已成为全球人类面临的严重健康威胁[6-8]。用于骨科修复或受损骨骼重建的合成植入物容易受到细菌入侵,因为在植入物和骨腔之间存在着一个界面,这为细菌滋生提供了空间,继而引发骨植入体相关感染[9-10]。植入过程中β-TCP植入物周围的病原菌感染则会造成患者继发性损伤、植入手术失败从而延长患者的治疗周期。目前,主流疗法是通过使用抗生素用于对抗细菌入侵[11-13]。然而,抗生素的滥用则可能会导致患者体内耐药菌的出现,从而增加治疗难度和治疗成本[14-17]。因此,现急需一种创新、高效、安全的抗菌方法取代抗生素以对抗IAI。
由于抗菌和成骨是骨缺损再生过程中两个密切相关的过程,因此在设计性能更好的β-TCP植入物过程中,最关键且最具挑战性的工作是如何平衡两者之间的关系[18-19]。植入物的主要修饰方法可分为两种,其一是通过生物活性金属对植入体表面进行修饰,另一种是将植入物与功能化材料相结合[20-23]。近年来,主流的抗菌剂一般是具有杀菌作用的金属离子(Fe、Ag、Mn、Cu离子等),其通过破坏细菌膜进入细菌内部以杀死细菌[24-25]。同时,输送到病原菌中的金属离子会致使细菌内蛋白质变性和渗漏,干扰其代谢过程并致其失活。其中,具有优异抗菌性能的银纳米颗粒(AgNPs)基于以下原因引起了研究人员的广泛关注:(1)AgNPs具有较强的渗透性和较大的比表面积;(2)AgNPs具有广谱抗菌特性,能消灭大部分病原菌;(3)在体液环境下AgNPs释放的Ag+可持续性地杀死细菌;(4)细菌膜与银离子(Ag+)之间的静电吸附有助于提高Ag+的杀菌能力;(5)病原体不会对AgNPs产生任何耐药性。然而,考虑到体内环境的复杂性,多余的Ag+会带来严重的全身性毒副作用。因此,如何降低Ag+的生物毒性同时不影响其抗菌效果是应用AgNPs进行抗菌治疗的关键所在。由于仿贻贝聚多巴胺(PDA)具有出色的生物相容性和粘附性,AgNPs可以通过PDA的螯合作用紧密均匀地附着在植入物表面,以减少Ag+的浸出,从而降低其生物毒性[10]。因此,可通过PDA辅助将AgNPs接枝在植入体表面以增强材料抗菌能力。
除了杀菌能力,良好的促组织生长能力对于骨植入材料来说也是极其重要的。因为组织生长的能力将直接影响植入物的成骨效果和长期固定能力[6]。近年来,许多研究结果表明,一些过渡金属离子(Cr、Sr、Co、Ni、Fe、Cu离子等)可在细胞内通过创造类缺氧微环境来刺激血管生成和促进组织再生[18]。其中,钴(Co)元素是人体生理功能中的关键微量元素。钴离子可以替代血液中的铁离子稳定缺氧诱导因子-1α(HIF-1α)并促进红细胞的生成,此外钴离子还具有强大的抗菌能力。基于Co的这些特性,在本研究中开发了一种同时具有抗菌和促骨再生能力的Co掺杂材料。
首先,通过压制成型和煅烧制备了钴掺杂的β-TCP(Co/β-TCP),再通过PDA的螯合反应将AgNPs接枝在Co/β-TCP表面(Ag@Co/β-TCP)。通过扫描电子显微镜(SEM)、能量色散光谱(EDS)、X射线衍射仪(XRD)、傅里叶红外光谱仪(FT-IR)、接触角测试仪和X射线光电子能谱(XPS)对材料的组成和表面性质进行了表征。以革兰氏阳性菌金黄色葡萄球菌(S.aureus)和革兰氏阴性菌大肠杆菌(E.coli)为代表菌,测试了Ag@Co/β-TCP植入体的广谱抗菌能力。与此同时,本研究还探究了该材料的生物相容性和生物毒性。
1 材料和方法
1.1 实验试剂
四水合硝酸钙(Ca(NO3)2·4H2O, AR)、六水合硝酸钴(Co(NO3)2·6H2O, AR)、磷酸氢二铵((NH4)2HPO4, AR)、盐酸(HCl, AR)、硝酸银(AgNO3, AR),氯化钠(NaCl, AR)和琼脂(AR)购自成都科隆试剂(中国);蛋白胨和牛肉提取物购自北京澳宝生物技术公司(中国);Tris-HCl缓冲溶液购自北京太阳生物科技公司(中国);CCK-8试剂盒购自北京博泰生物科技有限公司(中国)。
1.2 样品制备
钴掺杂β-TCP(Co/β-TCP)是通过压制成型和煅烧制备的[22]。简而言之,将Ca(NO3)2·4H2O(0.1 mol/L)和Co(NO3)2·4H2O(0,0.002,0.005 mol/L)添加到去离子水中并在室温下搅拌确保Ca(NO3)2·4H2O和Co(NO3)2·4H2O充分溶解。随后,将7.926 g (NH4)2HPO4快速加入到上述混合溶液中并快速搅拌1 h,使用氨水将混合物的pH值调至10左右。将所得产品抽滤并用去离子水冲洗,重复3次。将所得样品放入60 ℃烘箱中干燥24 h以去除残留水分。在产品中添加硬脂酸钠(质量比为20%)作为造孔剂,然后将得到的粉末放入直径为5 mm的模具中,在油压压片机中以10 MPa的压力压制3 min。最后,将成型的样品放入马弗炉中在800 ℃高温下烧制2 h。
为在植入体表面接枝AgNPs,在37 ℃下将Co/β-TCP浸入到PDA浓度为2 mg/mL的Tris-HCl缓冲液(10 mmol/L, pH = 8.5)中浸泡12 h以得到PDA修饰的Co/β-TCP。用去离子水冲洗上述样品并干燥后,将PDA修饰的Co/β-TCP在37 ℃下浸入AgNO3溶液(1 mmol/L)中6 h。然后使用去离子水将负载有Ag的Co/β-TCP冲洗3次去除未负载的AgNPs,在空气中干燥。同时,在本研究中采用与对照组相同的方法制备了不含Co的Ag修饰β-TCP。
1.3 表 征
1.4 体外抗菌试验
S.aureus和E.coli分别是典型的革兰氏阳性菌和革兰氏阴性菌。因此,在本项研究中通过抑菌圈实验测试了不同样品(β-TCP, Co/β-TCP, Ag/β-TCP, Ag@Co/β-TCP)对E.coli和S.aureus的抑菌能力。将经过紫外线照射灭菌后的样品固定在涂有200 μL细菌悬浮液(1×106CFU/mL)的Luria-Bertani(LB)固体琼脂培养基中,在37 ℃下培养24 h后测量抑菌圈直径。
1.5 体外细胞实验
1.5.1 细胞培养
在温度为37 ℃,含5% CO2的孵育箱中,人骨肉瘤细胞(MG63)在含10%胎牛血清(FBS,Gibco,美国)和1%链霉素-青霉素(南京凯基生物技术公司,中国)的Dulbecco改良Eagle培养基(DMEM,南京凯基生物技术公司,中国)中培养,每隔一天更换一次细胞培养基。
1.5.2 细胞毒性评估
CCK-8试剂盒测定用于评估MG63的存活率。将培养的细胞以每孔2×104个细胞的密度接种在含有材料的48孔板中。培养1,3,5 d后,用含有10% CCK-8试剂和90%细胞培养基的混合物代替细胞培养基。培养2 h后,从每个孔中提取上述100 μL混合物并添加到酶标板中,使用酶标仪测量混合溶液在λ = 450 nm处的吸光度,以评估细胞的相对存活率。
1.5.3 细胞形态评价
在该研究中,通过SEM来观察材料对细胞形貌的影响以评估材料的生物相容性。将细胞以每孔1×104个细胞的初始密度接种在含不同样品的48孔板中。培养3 d后取出样品并用磷酸缓冲溶液清洗,在300 μL戊二醛(2.5%)溶液中固定4 h。然后,使用不同浓度的乙醇(30%、50%、60%、70%、80%、90%、95%、100%)对细胞进行梯度脱水。随后,将样品真空干燥,喷金,并通过SEM观察细胞的形貌。
2 结果与讨论
2.1 材料的设计、制造和表征
在这里,为了解决由植入体引起的相关感染问题和促进骨缺损再生,开发了一种新型多功能材料(Ag@Co/β-TCP)。如图1(a)所示,纯β-TCP和Co掺杂β-TCP最初是通过压制成型和煅烧制备的。在pH值为9~10的条件下,PDA可以通过自聚合锚定在大部分固体表面(包括β-TCP)。此外,由于PDA的儿茶酚基团对金属具有强大的螯合能力,因此AgNPs可以与PDA结合组装形成Ag@Co/β-TCP表面的抗菌涂层,以提高Co/β-TCP的抗菌性能,解决IAI问题(图1(b))。
全站仪作为能够自动测量距离、角度,自动进行数据存储及处理的测绘仪器,从20世纪70年代初发明至今,已成为测绘生产单位的最基本仪器,在各种测绘生产中发挥着重要作用。与传统测绘仪器一样,全站仪作为测量距离、角度及坐标的工具,在使用前必须进行检定,以确认全站仪的精度能否达到出厂标准。

图1 (a) β-TCP,Co/β-TCP和 (b) Ag@Co/β-TCP的制备流程示意图Fig.1 Schematic description of the manufacturing of (a) the β-TCP, Co/β-TCP, and (b) Ag@Co/β-TCP
图2(a)、(b)显示了由β-TCP粉末经过压制成型和煅烧产生的Co掺杂β-TCP块状固体的微观结构。这些固体由聚集的微晶堆叠在一起,具有微孔结构的陶瓷状团聚微晶均匀地分散在Co/β-TCP表面(Co含量为2%)(图2(a))。在Co含量增加后,β-TCP表面(Co含量为5%)上分布着更多的类陶瓷微晶,晶体颗粒的边界变得模糊,这种多孔结构和粗糙的表面更有利于细胞的粘附和生长[21]。然后,使用EDS光谱用于确定其表面元素组成。图2(c)显示β-TCP表面的这些陶瓷状微晶富含Ca、P和Co元素。此外,2% Co/β-TCP表面和5% Co/β-TCP表面除Co的含量有区别外,峰并没有显著差异。

图2 2% Co/β-TCP和5% Co/β-TCP的微孔和元素表征:(a) 2% Co/β-TCP表面形貌的SEM;(b) 5% Co/β-TCP表面形貌的SEM;(c) 2% Co/β-TCP和5% Co/β-TCP表面元素的能谱分析Fig.2 Micro-structure and element characterization of 2% Co/β-TCP and 5% Co/β-TCP: (a) SEM for surface morphology of 2% Co/β-TCP; (b) EDS for surface morphology of 5% Co/β-TCP; (c) EDS for the surface element of 2% Co/β-TCP and 5% Co/β-TCP
图3(a)显示了β-TCP和Co/β-TCP的XRD图谱。β-TCP的图谱与Ca3(PO4)2(PDF#17-0320)的标准卡片非常一致。其衍射峰分别位于27.70°,30.98°和34.29°,可以很好地对应于β-TCP的(214)、(0210)和(220)晶面,表明β-TCP的成功制备。掺杂Co后,Co/β-TCP的峰发生明显变化。在25.91°,28.00°,31.23°和34.64°附近的主峰指向Co的(1010)、(214)、(0210)和(220)晶面 (JCPDS#49-1081),明显的峰移表明加入Co的加入使得β-TCP晶格发生了膨胀或收缩。

图3 (a) 对于β-TCP和Co-doped β-TCP的相表征的XRD谱图;(b) β-TCP和Co-doped β-TCP的FT-IR谱图;(c)β-TCP和Co-doped β-TCP的WCAFig.3 (a) XRD patterns for phase characterization of β-TCP and Co-doped β-TCP; (b) FT-IR pattern; (c) The water contact angle of β-TCP and Co-doped β-TCP
图3(b)显示了不同β-TCP的FT-IR谱图。β-TCP在557和604 cm-1处的特征峰对应于PO43-的面内弯曲振动。943 cm-1处的峰与PO43-的对称伸缩振动有关,971.96~1 123.28 cm-1与PO43-的不对称伸缩振动相匹配[25]。值得注意的是,加入Co后PO43-的不对称伸缩振动发生了明显变化,这可能源于β-TCP晶格的膨胀和收缩。此外,在3 443 cm-1处的吸收带是因为样品中的残留水的存在。
β-TCP和Co/β-TCP的表面亲水性通过测量WCA来表征,以证明样品改性对材料表面亲水性的影响(图3(c))。纯β-TCP的WCA为46°,而2% Co/β-TCP和5% Co/β-TCP的WCA分别为18°和16°,表明Co的加入对材料表面亲水性有正向促进作用。研究表明,亲水性的表面有助于细胞粘附和增殖[6,21],因此可假设Co的掺入可以促进细胞粘附以提高骨修复的效率。
2.2 Ag@Co/β-TCP的表征

2.3 体外抗菌能力
正如引言中所假设的, Ag@Co/β-TCP可以在体液环境中释放Ag+和Co2+,破坏细菌内蛋白质,从而消灭细菌。为了研究Ag@Co/β-TCP的杀菌能力,在本研究中以S.aureus和E.coli作为代表性病原菌,将不同β-TCP材料固定在LB琼脂板上培养24 h后,细菌抑菌圈结果如图5所示。观察到在Ag@Co/β-TCP与病原菌(S.aureus和E.coli)之间存在着较大的抑菌区域。相反,在β-TCP周围没有明显的抑制区。而与β-TCP相比,Co/β-TCP的抗菌能力略有提高。由此可知:(1)β-TCP表面释放的Ag+和Co2+促进了β-TCP底物的抗菌活性;(2)Co/β-TCP显示出微小的抑菌圈,表明Co2+不能独立抑制病原菌;(3)AgNPs的接枝和Co的掺入使β-TCP具有显著的抗菌活性。此外,对E.coli和S.aureus的抑菌结果表明Ag@Co/β-TCP具有广谱杀菌作用。因此,Ag@Co/β-TCP具有在骨缺损修复的植入过程中建立无菌微环境的潜力。

图5 不同β-TCP样品对E. coli和S. aureus的抗菌性能(虚线圆圈代表材料的抑菌区域)Fig.5 The different β-TCP-based samples against E. coli and S. aureus (the dotted circles represent the inhibition area)
2.4 Ag@Co/β-TCP的细胞毒性
除了杀菌性能以外,生物相容性也是骨植入材料一个关键性指标。在本研究中通过CCK-8试剂盒来评估各种样品对MG63细胞的影响。由图6可知,各组中的细胞数量随着时间的增加而增加。相比于β-TCP,由于银本身具有一定的毒性,在各组中Ag/β-TCP中的细胞增殖性能最弱。与Ag/β-TCP组相反,由于Co2+具有促进组织生长的能力,在Co/β-TCP和Ag@Co/β-TCP组中的细胞表现出更优的活性。
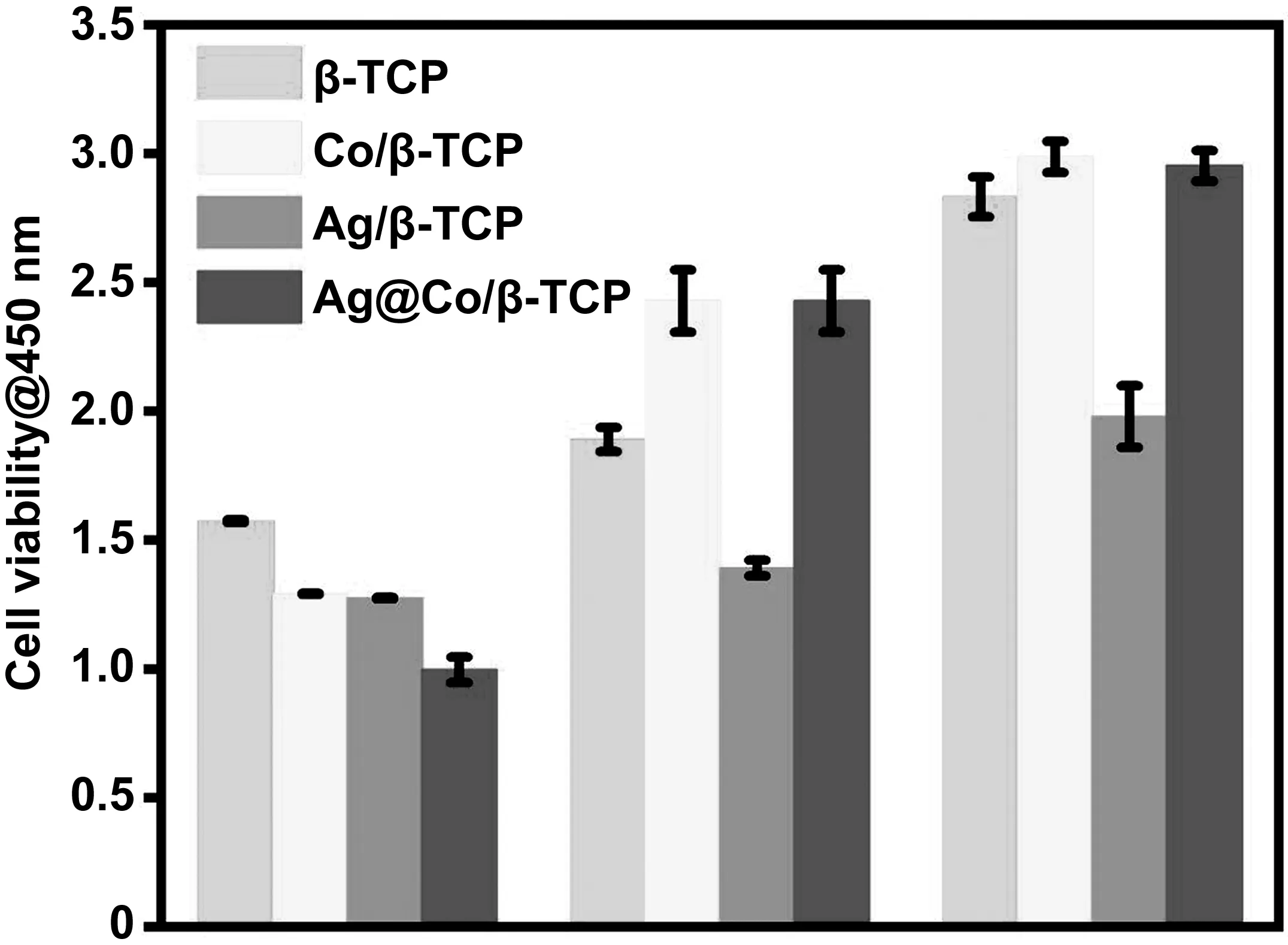
图6 MG63细胞在β-TCP、Co/β-TCP、Ag/β-TCP以及Ag@Co/培养1,3和5天后的细胞活性Fig.6 CCK-8 kits assay of the MG63 cell proliferation on β-TCP, Co/β-TCP, Ag/β-TCP, as well as Ag@Co/β-TCP after culturing for 1, 3 and 5 d
在本研究中通过SEM进一步观察了各种样品上的MG63细胞形态。如图7所示,在β-TCP上培养的细胞显示出纺锤状形状,细胞边缘周围有丝状伪足。然而,在Ag/β-TCP上培养的细胞表现出极差的细胞形态。值得注意的是,Ag@Co/β-TCP表面的细胞扩散和形态比Ag/β-TCP更好,这表明Co的掺入会促进细胞增殖,提升细胞的生物相容性。因此,Ag@Co/β-TCP的杀菌能力并不会影响细胞增殖,具有一定的生物安全性。
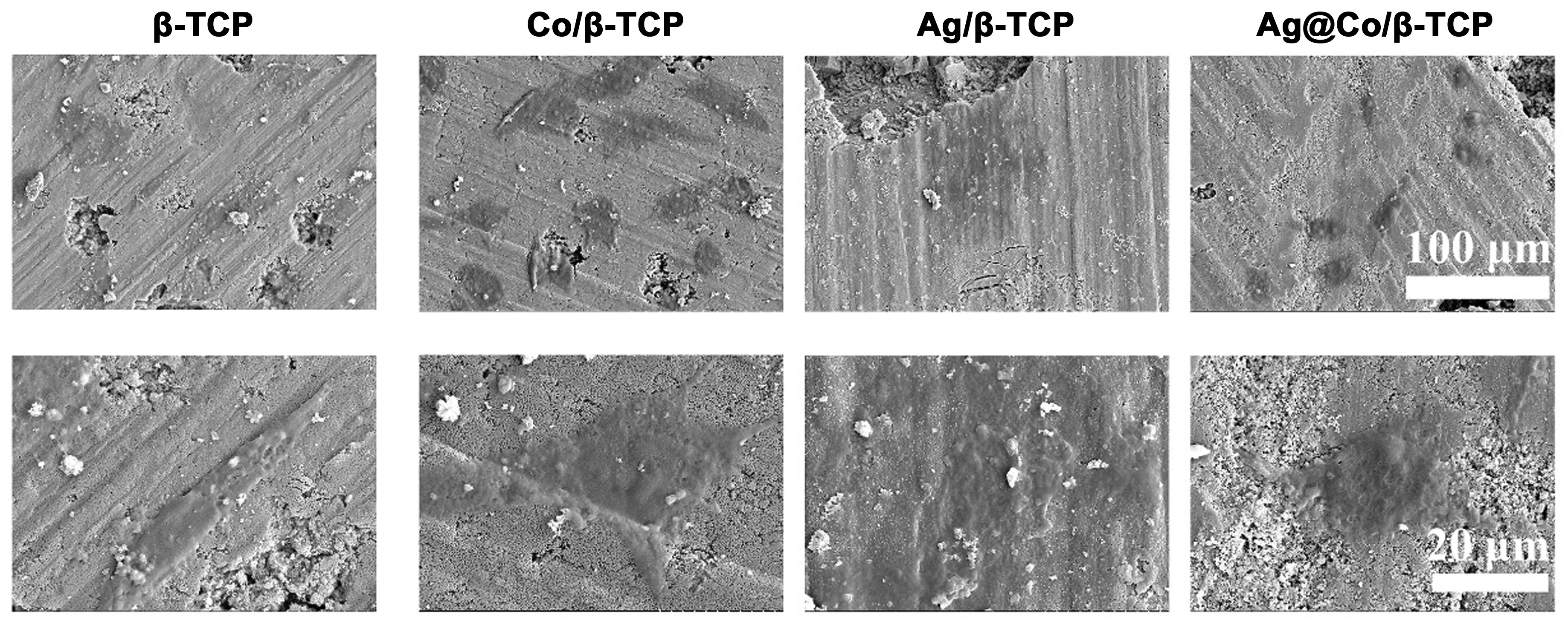
图7 MG63细胞在不同样品上培养5 d后的SEM形貌图Fig.7 Morphologies of MG63 detected by FE-SEM after 5 d of culture on different samples
3 结 论
通过压制成形和PDA辅助改性成功构建了Ag@Co/β-TCP植入物。通过SEM、EDS、XRD、FT-IR、接触角测试仪和XPS对材料进行了表征,以S.aureus和E.coli作为代表病原菌测试了Ag@Co/β-TCP的抗菌性能,并评估了其生物相容性,结果表明:
(1)通过SEM、EDS、XRD、FT-IR、接触角测试仪和XPS等一系列表征结果表明Ag@Co/β-TCP的成功制备,同时Ag@Co/β-TCP具有促细胞粘附和增殖的潜力。
(2)由于Ag+和Co2+的显著抗菌特性,在植入过程中Ag@Co/β-TCP可以持续释放出Ag+和Co2+从而达到有效抑制病原菌的目的。细菌抑制区测试表明,在无抗生素的环境下Ag@Co/β-TCP具有对E.coli和S.aureus持续性的杀菌活性。
(3)体外细胞实验证明Ag@Co/β-TCP具有良好的生物相容性,在骨缺损的治疗中具有出强大的应用潜力。
