转移抑制基因KAI1负调控Wnt/β-catenin通路在抑制鼻咽癌转移机制中的研究〔1〕
2022-11-01施雨南张珊毓周春燕杨静张小军王金凤衷敬华
施雨南,张珊毓,周春燕,杨静,张小军,王金凤,衷敬华*
(1.赣南医学院第一临床医学院,江西 赣州 341000;2.赣南医学院第一附属医院,江西 赣州 341000)
鼻咽癌(NPC)是常见恶性肿瘤,发病早期易转移。目前放疗是治疗鼻咽癌的主要手段,但存在放疗不彻底残留局部病灶的缺陷,易复发,治疗效果不佳。因此研究NPC转移机制可从根本上改善患者预后,临床实用价值较高。研究表明转移抑制基因(KAI1)表达下降或缺失与肿瘤转移具有相关性[1]。本实验通过体外动物模型实验,模拟KAI1基因在小鼠成瘤组织中高表达的情况,观察KAI1基因对模型转移能力的影响,并通过蛋白相对表达对比验证KAI1对Wnt/β-catenin通路的负调控机制。
1 材料与方法
1.1 材料
人鼻咽癌CNE-2Z细胞株购于上海佰晔生物科技中心;内皮祖细胞(EPCs)购于北京安鑫康科技有限公司;BALB/c-nu雌性裸鼠购于广州锐格生物技术有限公司;过表达KAI1基因的慢病毒购于上海吉满基因有限公司。
1.2 主要试剂
RPMI1640培养基、二甲基亚砜(DMSO)、十二烷基硫酸钠(SDS)均购于上海生工生物技术有限公司;胰蛋白酶、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液购于江苏碧云天有限公司;新生胎牛血清、淋巴细胞分离液、6%羟乙基淀粉购于上海易励医疗器械有限公司;甲基双丙烯酰胺、四甲基乙二胺(TEMED)、丙烯酰胺、过硫酸铵均购于美国Sigma公司。
1.3 方法
1.3.1 细胞培养与转染
将人鼻咽癌CNE-2Z细胞株进行复苏、培养、传代、冻存。在对数生长期将人鼻咽癌CNE-2Z细胞制成细胞悬液。将过表达KAI1基因的慢病毒转染至EPCs中,构建高表达的KAI1基因的稳转细胞(KAI1-EPCs)。所有细胞均进行台盼蓝染色活力检测,要求细胞活性在95%以上。
1.3.2 构建荷人鼻咽喉裸鼠转移模型
将裸鼠按照随机数字表法分为3组,每组30只。三组小鼠均在腋下注射CNE-2Z细胞悬液,记录裸鼠成瘤时间。接种7 d后,于小鼠尾静脉采用直接注射的方法进行干预,A组为空白组,B组为EPCs组,C组为KAI1实验组。当裸鼠出现反应迟缓、活动能力减弱、进食量下降、消瘦时,立即处死解剖。取完整的腋下移植瘤、肝脏和肺组织,记录瘤质量。肝肺组织进行固定处理后于显微镜下观察肺部转移灶,记录转移灶的大小和数目。
鼠肺转移灶计数方法及标准:I级转移灶直径<0.15 mm,Ⅱ级转移灶直径为0.15~<1 mm,Ⅲ级转移灶直径为1~<2 mm,Ⅳ级转移灶直径≥2 mm。总转移灶数=I级转移灶数+Ⅱ级转移灶数×2+Ⅲ级转移灶数×3+Ⅳ级转移灶数×4。
1.3.3 KAI1负调控Wnt/β-catenin通路的验证
抽取三组肿瘤细胞总蛋白,利用蛋白质印迹法(Western Blot)对三组Wnt-1和β-catenin蛋白相对表达水平进行检测,验证KAI1对Wnt/β-catenin通路有调控作用。
1.4 统计学方法
2 结 果
2.1 成瘤情况
三组成瘤时间比较差异无统计学意义(P>0.05);三组成瘤质量对比,差异有统计学意义(F=5.416,P=0.006)(见表1)。
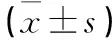
表1 三组成瘤时间与成瘤质量比较
2.2 人鼻咽癌裸鼠移植瘤肺转移灶的生成情况
A组13 例,B组16 例,C组3 例(见表2)。肺转移灶计数A组为(36.21±6.82),B组为(34.42±5.21),C组为(14.71±2.06),三组比较差异有统计学意义(F=164.581,P<0.001),且C组少于A组和B组,差异有统计学意义(t=16.534,P<0.001;t=19.271,P<0.001)。

表2 三组人鼻咽癌裸鼠移植瘤肺转移灶生成情况对比
2.3 KAI1负调控Wnt/β-catenin通路
Western Blot检测结果显示,三组Wnt-1表达对比差异有统计学意义(F=101.918,P<0.001),C组表达量低于A组和B组(P<0.05)。三组β-catenin表达比较差异有统计学意义(F=44.106,P<0.001),C组表达量明显低于A组和B组(P<0.05)。证明KAI1可以负调控Wnt/β-catenin通路(见图1和表3)。

图1 三组细胞中Wnt-1和β-catenin的表达情况

表3 三组细胞中Wnt-1和β-catenin相对表达量比较
3 讨 论
鼻咽癌是人类常见的头颈部恶性肿瘤[2],常有肿瘤转移。目前临床上应对肿瘤细胞转移的方法较为匮乏,现阶段鼻咽癌的主要治疗手段是放化疗相结合。随着放疗技术的不断提升,患者5年生存率稳步提高[2],但由于肿瘤的迁移特点使部分患者的预后效果不尽如人意,因此研究肿瘤的转移机制成为人们关注的热点[3]。KAI1是一种抑癌基因[4],在许多肿瘤发生和发展中起重要作用。KAI1基因[5]定位于人染色体11p11.2上,编码含有267个氨基酸的蛋白质,属于跨膜4超家族成员,可通过细胞膜广泛的糖基化作用、特异性定位[6]及细胞间黏附作用参与肿瘤侵袭和转移过程[7]。
EPCs是一类在早期胚胎发育即参与血管新生的造血干细胞。研究发现循环中的EPCs可被特异吸引到肿瘤微脉管系统的“热点部位”,参与肿瘤血管生成[8]。因此EPCs可作为肿瘤研究细胞载体用于外源基因的引入及局部表达。动物实验肿瘤模型是指将动物建模手段和细胞生物学技术结合,将人类肿瘤模型复制到动物身上。动物实验肿瘤模型可解决一些伦理问题和研究障碍,为研究肿瘤相关机制提供模型支持,且可实现动物模型结果与人类疾病的对比。本实验所使用的BALB/c-nu裸鼠属于免疫缺陷动物,缺乏成熟的T淋巴细胞,可通过取适量人癌组织细胞悬液注射的方式构建鼻咽癌裸鼠移植瘤模型。
本研究构建高表达的KAI1基因稳转细胞,通过注射法构建了人鼻咽喉裸鼠转移模型,以观察KAI1基因对鼻咽癌转移的作用,衡量KAI1负调控Wnt/β-catenin通路在抑制鼻咽癌转移机制中的作用。结果表明,C组肺转移病灶计数明显少于A组和B组;Western Blot检测结果显示,C组Wnt-1和β-catenin相对表达量均低于A组和B组。证明KAI1基因可对Wnt/β-catenin通路起到负调控作用,为临床抑制肿瘤转移提供理论基础。
本实验参考既往研究结论,验证了KAI1基因对抑制肿瘤转移的积极作用,并对作用机制进行探讨,验证了KAI1基因可对Wnt/β-catenin通路起负调控作用。同时本研究所使用的EPCs也为抑制肿瘤转移的基因治疗提供了参考。EPCs可躲避自然杀伤,无排斥作用和潜在致癌性,具有良好的分化、分型潜能,可作为许多基因的载体[9],其归巢于肿瘤微血管的特性,可被用作是鞭向运输至肿瘤组织的基因载体[10],为临床应对肿瘤转移提供新的研究靶点,为肿瘤转移的基因治疗提供理论基础。但本实验仍存在一定不足,未对患者临床切片样本中KAI1,Wnt-1,β-catenin表达量进行对比分析。
