血清miR-92a和miR-155-5p表达对老年高血压合并脑梗死诊断与预后的影响
2022-10-31孙莲红殷勇
孙莲红 殷勇
急性脑梗死是神经内科常见疾病,具有高致残、高致死和高复发等特点,是全球导致死亡和残疾第二大原因。而高血压患者合并急性脑梗死的几率明显提高,虽然高血压的特点是长期血管处于高压状态下,但其并发症不是出血,而是血栓形成发生急性脑梗死。急性脑梗死的诊断主要靠头颅CT和MRI,但由于灵敏度不高,仍达不到快速诊断的要求[1]。急性脑梗死的治疗是溶栓,但时间窗较短,只有3%的患者得到及时诊断,最终得到溶栓,因此,寻找具有灵敏度高和特异性好的生物标记物成为研究的热点。微小RNA(miRNAs)是一种非编码RNA,其是由18~24个核苷酸组成,参与细胞的各种病理生理过程,现有研究证实miRNAs在急性脑梗死的动物模型中出现表达异常[2],并认为miRNAs在急性脑梗死的诊断,治疗和预后判断方面可能的生物标记物。miR-155-5p和miR-92a在高血压疾病中出现异常表达[3,4],是否具有在高血压急性脑梗死中的诊断和预后中具有临床意义需要进一步明确。本研究通过对高血压急性脑梗死患者血清miR-155-5p和miR-92a检测,观察其在高血压急性脑梗死诊断和预后的价值,报告如下。
1 资料与方法
1.1 一般资料 选择2017年1月至2018年12月在我院就诊的高血压急性脑梗死患者105例为高血压合并脑梗死组,其中男70例,女35例;年龄60~85岁,平均年龄(73.14±6.88)岁;根据脑梗死的部位分为脑叶21例,脑干64例和基底节区20例。选择同期在我院诊断为原发性高血压患者89例,为高血压组,其中男57例,女32例;年龄60~85岁,平均年龄(72.93±7.65)岁;同期在我院行健康体检者45例,为健康对照组,男28例,女17例;年龄60~85岁,平均年龄(72.40±7.35)岁。3组基线资料具有均衡性。
1.2 纳入与排除标准 (1)纳入标准:高血压组和高血压合并脑梗死组均符合高血压的诊断标准[5];脑梗死组和高血压合并脑梗死组均行颅脑CT和MRI均符合急性脑梗死的诊断标准[6];脑梗死发病时间7~72 h;均知情同意签署同意书;经医院伦理委员会审核通过。(2)排除标准:继发性高血压;脑出血;急性冠脉综合征,严重心律失常和肾功能不全;免疫学和血液性疾病;恶性肿瘤;精神性疾病和智力障碍者。
1.3 方法
1.3.1 治疗方法与分组:脑梗死组患者入院后常规给予心电监护,吸氧,调整血糖、血压和抗血小板集聚等支持对症治疗;对于无明显抗凝禁忌症的患者采用抗凝治疗;如果有脑水肿和颅内压升高予以脱水治疗。患者舒张压>120 mm Hg或者收缩压>220 mm Hg则采用乌拉地尔静脉泵入缓慢降压至185/105 mm Hg,血压<185/105 mm Hg无需降压治疗。出院90 d后进行随访,用改良Rankin量表(mRS)[7]对患者预后进行评价,mRS为0~2分为预后良好,3~6分为预后不良。本组预后不良组41例,预后良好组64例。
1.3.2 血液标本留取:患者入院后空腹取肘静脉血10 ml,放在抗凝管中,以3 000 r/min离心10 min,离心半径10 cm,分离出血浆,放置在无RNA酶的Ep管中,保存在-80℃冰箱待测。
1.3.3 qRT-PCR检测:总RNA提取:按照miRNA试剂盒使用说明书,分离出总RNA,并使用核酸定量检测仪测定RNA浓度和纯度。qRT-PCR:使用Taqman microRNA RT Kit(ABI公司,美国)并用相应的逆转录引物合成cDNA,并根据说明书进行逆转录。其中miR-155-5p上游引物序列5’-UUAAUGCUAAUCGUGAUAGGGGU-3’,下游引物5’-CCCUAUCACGAUUAGCAUUAAUU-3’; miR-92a上游引物5’-TACACAGGTTGGGATCGGTTG-3’,下游引物5’-GTGCAGGGTCCAGGT-3’; U6上游引物序列5’-CAAACTCAACAGGCCGGGAC-3’,下游引物5’-CGCTTCACGAATTTGCGTGTCAT-3’。配置反应体系:加入上游引物0.5 μl(20 μmol/L),下游引物0.5 μl(20 μmol/L),cDNA Template 0.5 μl,2×SYBR Green Master Mix 10 μl,加入ddH2O配至20 μl。在即时荧光定量系统上进行扩增,其扩增条件为95℃ 10 min,95℃ 15 s,60℃ 1 min,循环40次,用U6来校正每个样品的Ct值,用2-ΔΔCt方法表示相对表达量。
1.3.4 生化指标测定:采集静脉血采用日立7170A全自动生化分析仪测定血糖、纤维蛋白原、三酰甘油、胆固醇、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、肌酐和D-二聚体。
1.4 观察指标 观察高血压合并脑梗死组、高血压组和健康对照组血清miR-92a和miR-155-5p表达变化,对高血压合并脑梗死影响预后因素进行单因素和多因素分析,观察血清miR-92a和miR-155-5p表达在高血压合并脑梗死诊断和预测预后的灵敏度和特异性。
2 结果
2.1 影响高血压合并脑梗死预后的单因素分析 根据mRS量表随访3个月后,41例患者评分为预后不良,64例患者为预后良好。单因素分析发现,性别、年龄、吸烟史、饮酒史、糖尿病史、冠心病史、心房颤动史、HDL-C、LDL-C、三酰甘油、总胆固醇、空腹血糖、血肌酐、NIHSS评分和梗死部位与高血压合并脑梗死预后无明显差异(P>0.05),而收缩压、舒张压、D-二聚体、病灶直径、miR-92a和miR-155-5p与高血压合并脑梗死患者的预后呈密切相关(P<0.05)。见表1。

表1 影响高血压合并脑梗死预后的单因素分析
2.2 3组血清miR-92a和miR-155-5p表达水平比较 高血压合并脑梗死患者血清miR-92a表达水平高于高血压组和健康对照组(P<0.01),而高血压组明显高于健康对照组(P<0.01);miR-155-5p表达水平明显低于高血压组和健康对照组(P<0.01),而高血压组低于健康对照组(P<0.01)。见表2。
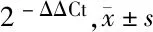
表2 3组血清miR-92a和miR-155-5p表达水平比较
2.3 3组血清miR-92a和miR-155-5p表达在诊断脑梗死的诊断效能 miR-92a和miR-155-5p表达在诊断高血压合并脑梗死具有较高诊断效能,将miR-92a和miR-155-5p表达进行logistics分析,得出方程=0.962XmiR-92a-3.163XmiR-155-5p-1.724,发现联合检测其灵敏度79.0%,特异性86.5%,AUC为0.900明显高于miR-92a(Z=3.827,P<0.05)和miR-155-5p(Z=2.368,P<0.05)的检测,而miR-92a和miR-155-5p间无明显差异(P>0.05)。见图1,表3。

图1 联合检测miR-92a和miR-155-5p表达高血压合并脑梗死的诊断效能

表3 血清miR-92a和miR-155-5p表达在诊断高血压合并脑梗死的诊断效能
2.4 影响高血压合并脑梗死预后的多因素分析 多因素分析发现收缩压、病灶直径、miR-92a和miR-155-5p是高血压合并脑梗死预后的独立预后因素(P<0.05)。见表4。

表4 影响高血压合并脑梗死预后的多因素分析
2.5 血清miR-92a和miR-155-5p表达在预测高血压合并脑梗死预后的效能 血清miR-92a和miR-155-5p表达在预测高血压合并脑梗死具有较高的灵敏度和特异性,将miR-92a和miR-155-5p表达进行Logistics分析,得出方程=1.285XmiR-92a-3.310XmiR-155-5p-2.135,发现联合检测其灵敏度87.7%,特异性82.8%,AUC为0.902明显高于miR-92a(Z=2.060,P<0.05)和miR-155-5p(Z=2.548,P<0.05)的检测,而miR-92a和miR-155-5p间无明显差异(P>0.05)。见表5,图2。

表5 血清miR-92a和miR-155-5p表达在预测高血压合并脑梗死预后的效能

图2 血清miR-92a和miR-155-5p表达在预测高血压合并脑梗死预后的效能
3 讨论
高血压患者常合并动脉粥样硬化,引起血栓形成,导致血管腔闭塞,出现急性脑供血不足导致急性脑梗死。miRNAs是一类约22个核苷酸组成的非编码单链RNA,通过对mRNA的结合降解或者抑制,从而达到对蛋白质合成的调控。现有研究证实血管内皮细胞和平滑肌细胞能够特异性的表达miRNAs,通过对细胞增殖,分化和凋亡等过程的调控,在血管病理生理过程中具有重要调控作用[8,9]。miRNA释放入血主要通过2种方式[10]:由破碎组织细胞或者凋亡细胞中漏出释放入血,或受损细胞主动分泌入血,以后者为主。在动物实验发现大鼠脑缺血在24 h出现表达miRNA谱出现明显的变化,在脑组织中高表达的miRNAs已经可以在血液中检测到[11],并认为血液中的miRNA水平是急性脑梗死诊断,指导治疗和预后判断的新型血液标记物。
本研究显示高血压合并脑梗死患者血清miR-92a表达水平高于高血压组和健康对照组,而高血压组明显高于健康对照组,说明miR-92a在高血压及高血压合并脑梗死疾病的中呈高表达,并且发现血清miR-92a表达在诊断高血压合并脑梗死其灵敏度为63.8%,特异性84.3%,AUC为0.812,说明在诊断高血压合并脑梗死具有较高的诊断效能。miR-92a是miR-17/92家族的成员之一,在基础研究中发现miR-92a在血管内皮细胞中呈高表达,且对新生血管具有明显抑制作用[11]。在一项大鼠的心肌梗死模型的动物实验中发现,注射miR-92a抑制剂后,能够明显缩小心脏梗死范围,心脏的收缩和舒张功能均得到改善,梗死部位的周边血管得到明显的增加[12]。将miR-92a以微粒体的形式释放入血,并且与疾病的严重程度呈相关性,故miR-92a在动脉粥样硬化形成过程具有重要的意义[13]。本研究还发现高血压合并脑梗死组血清miR-155-5p表达水平低于高血压组和健康对照组,而高血压组低于健康对照组,说明miR-155-5p是脑梗死发生的保护因子。与文献报道血清miR-155表达水平在脑血管疾病患者明显低于健康对照组[14]一致。miR-155位于人体的第3号染色体,基础研究发现miR-155水平是脑血管疾病的危险因素,在高脂血症,动脉粥样硬化破裂和高血糖等病变具有密切联系[15]。miR-155参与了动脉粥样硬化病理生理过程,当机体的miR-155表达量明显减少时,导致下游的信号传导值和转录激活因子表达明显增加,促进内皮细胞增殖和迁移加快,从而使动脉斑块出现新生的毛细血管,促进斑块的破裂[16];同时还可以通过调节内皮细胞络氨酸激酶细胞因子的表达,参与新生血管的病理生理过程[17]。此外有研究证实miRNA的异常表达与三酰甘油表达水平具有重要联系,其中miR-155的表达与高脂血症有密切联系,与低密度脂蛋白合成呈负相关[18]。本研究发现血清miR-155-5p表达在诊断高血压性脑梗死的灵敏度77.1%,特异性85.4%,AUC为0.852具有较高的诊断效能,联合miR-92a和miR-155-5p检测,其诊断效能明显提高,其灵敏度79.0%,特异性86.5%,AUC为0.900明显优于单个指标,说明两个指标有一定的互补性,能明显提高诊断效能。
随访3个月后发现高血压合并脑梗死预后不良的有41例,其中以收缩压、舒张压、D-二聚体、病灶直径、miR-92a和miR-155-5p与高血压合并脑梗死患者的预后呈密切相关,进一步进行多因素分析发现收缩压,病灶直径和miR-92a是高血压合并脑梗死独立预后的危险因素,而 miR-155-5p是高血压合并脑梗死的保护因素。为进一步探讨在预测高血压合并脑梗死预后的效能,本研究进行ROC曲线分析,发现miR-92a在预测不良预后方面具有较高的效能,当血清miR-92a>4.829时,其预测不良预后的灵敏度为63.4%,特异性93.7%,AUC为0.846,说明当机体血清miR-92a>4.829对这类患者是否进行进一步干预措施干预不良预后的发生。血清miR-155-5p表达在预测高血压合并脑梗死不良预后方面同样具有较高的诊断效能,当血清miR-155-5p表达≤1.111,其预测高血压不良预后的灵敏度为85.4%,特异性为73.4%,AUC为0.802,说明当机体血清miR-155-5p表达较低时,这部分患者应采取有效措施干预,从而对预后进行改善。本研究还发现联合检测miR-92a和miR-155-5p表达能够提高对不良预后的诊断价值,其灵敏度为87.8%,特异性为82.8%,AUC为0.902,说明联合检测能够提高对不良预后的诊断效能,当机体miR-92a>4.829且miR-155-5p≤1.111,建议采取进一步有效干预措施进行干预,以期改善预后,提高生活质量。
总之,在高血压合并脑梗死患者中,血清miR-92a表达明显升高,而miR-155-5p表达明显降低,是高血压合并脑梗死独立预后因素,联合检测在高血压合并脑梗死的诊断和预测预后方面具有较高的效能。
