溶剂-超声波-酶法辅助提取桑葚果渣色素及其抗氧化活性研究
2022-10-31吴均吴俊葶黄传书赵珮刘艳马婧秋
吴均,吴俊葶,黄传书*,赵珮,刘艳,马婧秋
(1.重庆市蚕业科学技术研究院,重庆 400700;2.中国人民解放军陆军勤务学院,重庆 401331)
桑葚富含多糖、脂肪酸、花色苷、鞣质、芦丁、维生素、蛋白质、果胶、粗纤维等成分[1],具有抑菌、抗氧化、抑制动脉粥样硬化和有害物质生成的作用[2-6]。因桑葚皮薄、易腐败、易霉变和保质期极短等特点使其工业化发展受到了极大的限制,我国桑葚种植面积大、分布广,资源丰富,但总体利用率较低,绝大多数以采摘鲜食为主,加工产品主要为果干、果汁、果醋、果粉、果膏和果酒等[7-11]。加工产生的果渣营养丰富但通常被丢弃,资源浪费十分严重。研究表明,桑葚果渣中富含大量有色物质花色苷[12],可作为理想的天然色素提取原料[13]。
近年来,人们对食品安全的重视程度越来越强,用天然色素代替化学合成色素已成为必然趋势[14-15],不仅是因为天然色素无毒,更因为它本身就是食品中具有生理活性的一部分,且营养丰富[16-17],将其添加至食品中对人体健康有益。从桑葚果渣中提取天然色素,可以拓宽天然色素的获取渠道,满足轻工业对天然色素日渐增长的需求,也能提高桑葚产品的附加值。色素提取工艺主要有溶剂提取法[18]、超声波辅助提取法[19]、微波辅助提取法[20]、酶解法[21]、微生物发酵提取法[22]和超临界CO2法[23]等。溶剂-超声波-酶法辅助提取法将3种方法整合,促进溶剂与有效成分融合,加快色素的溶解速度,提高色素的提取率,且不会造成成分的破坏,最大限度的保证产物的品质。本试验优化溶剂-超声波-酶法辅助提取桑葚果渣色素的工艺条件,获得提取液后分析其抗氧化活性,为桑葚果渣废弃物的开发应用提供试验依据。
1 材料与方法
1.1 材料与试剂
桑葚果渣:重庆市蚕业科学技术研究院;无水柠檬酸(食品级):潍坊英轩实业有限公司;无水乙醇(分析纯):成都市科隆化学品有限公司;盐酸(分析纯):国药集团化学试剂有限公司;纤维素酶(食品级,5万U/g)、维生素C(分析纯):北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)(分析纯):合肥博美生物科技有限责任公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS](分析纯):上海麦克林生化科技有限公司;Trolox(纯度97%):美国sigma公司。
1.2 仪器与设备
原汁机(H-200):上海韩惠人爱家电科技有限公司;电热鼓风干燥箱(101型):北京科伟永兴仪器有限公司;破壁料理机(MJ-PB80Easy215):广东美的生活电器制造有限公司;超声波清洗仪(SB25-12DTD):宁波新芝生物科技股份有限公司;数显全温振荡器(HZQ-2):山东博科科学仪器有限公司;旋转蒸发仪(RE-52AA):上海亚荣生化仪器厂;冷冻干燥机(CTFD-12S):青岛永合创信电子科技有限公司;pH计(PHS-3C):上海雷磁仪器有限公司;紫外可见光分光光度计(Ultra-3600):北京普源精电科技有限公司。
1.3 方法
1.3.1 原料预处理
将废弃冷冻果渣置于搪瓷盘中,于60℃烘箱中烘干,用破壁料理机破碎成粉,过80目筛,于-4℃条件下避光保存。
1.3.2 桑葚果渣色素的最大吸收波长测定
称取适量桑葚果渣粉末于三角瓶中,按1∶25(g/mL)料液比加入50%乙醇,置于超声功率300 W、50℃下提取30 min,10 000 r/min离心10 min,吸取1 mL上清液至25 mL棕色容量瓶,超纯水定容,用紫外可见光分光光度计进行400 nm~700 nm可见光波段扫描,确定最大吸收波长。试验设3次重复。
1.3.3 桑葚果渣色素提取的单因素试验
称取适量桑葚果渣粉末,以柠檬酸-90%乙醇(体积比1∶1)为提取溶剂提取桑葚果渣色素,考察柠檬酸浓度(6.0%、6.5%、7.0%、7.5%、8.0%)、料液比[1∶20、1∶25、1 ∶30、1 ∶35、1 ∶40(g/mL)]、纤维素酶添加量(40、60、80、100、120 U/mL)、超声温度(30、40、50、60、70 ℃)、超声时间(20、30、40、50、60 min)、超声功率(240、300、360、420、480、540、600 W)对吸光度的影响。提取液于10 000 r/min离心10 min,取1 mL上清液至10 mL棕色容量瓶,超纯水定容,于最大吸收波长513 nm处测定吸光度。
1.3.4 桑葚果渣色素提取的响应面试验
以单因素试验结果为依据,选择对结果影响较大的柠檬酸浓度(A)、料液比(B)、超声温度(C)和超声时间(D)为自变量,以吸光度(Y)为响应值,采用响应面法进行优化,对桑葚果渣色素最佳提取工艺条件进行设计,试验设计因素与水平见表1。

表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels of Box-Behnken experiments design
1.3.5 桑葚果渣色素的抗氧化活性分析
1.3.5.1 DPPH自由基清除率测定
分别取 20、40、60、80、100、120、140、160 μL 的桑葚果渣色素提取液于试管中,用超纯水补充至3 mL,加入3 mL 0.2 mmol/L DPPH溶液摇匀,避光放置30 min,于波长513 nm处测定吸光度Ai。同时测定含有20、40、60、80、100、120、140、160 μL 的桑葚果渣色素提取液(超纯水补充至3 mL)与无水乙醇各3 mL混合后的溶液吸光度Aj,以及无水乙醇与0.2 mmol/L DPPH溶液各3 mL混合后的溶液吸光度A0[24];以VC和Trolox做阳性对照。DPPH自由基清除率计算公式如下。

1.3.5.2 ABTS+自由基清除率测定
分别取 10、20、30、40、50、60、70、80 μL 的粗提色素溶液于试管中,用超纯水补充至0.2 mL,加入ABTS+工作液5.8 mL,摇匀,避光放置10 min,于波长734 nm处测定吸光度 Ai,同时测定含有 10、20、30、40、50、60、70、80 μL的桑葚果渣色素提取液(超纯水补充至0.2 mL)与5.8mL无水乙醇混合后的溶液吸光度Aj,以及0.2mL无水乙醇与5.8 mL ABTS+工作液混合后的溶液吸光度A0[25];以VC和Trolox做阳性对照。ABTS+自由基清除率计算公式如下。

1.3.6 数据处理及绘图
采用 Excel、Origin 9.0和 Design Expert 8.0.6进行绘图和响应面分析。
2 结果与分析
2.1 桑葚果渣色素最大吸收波长测定结果
桑葚果渣色素的最佳吸收光谱图见图1。
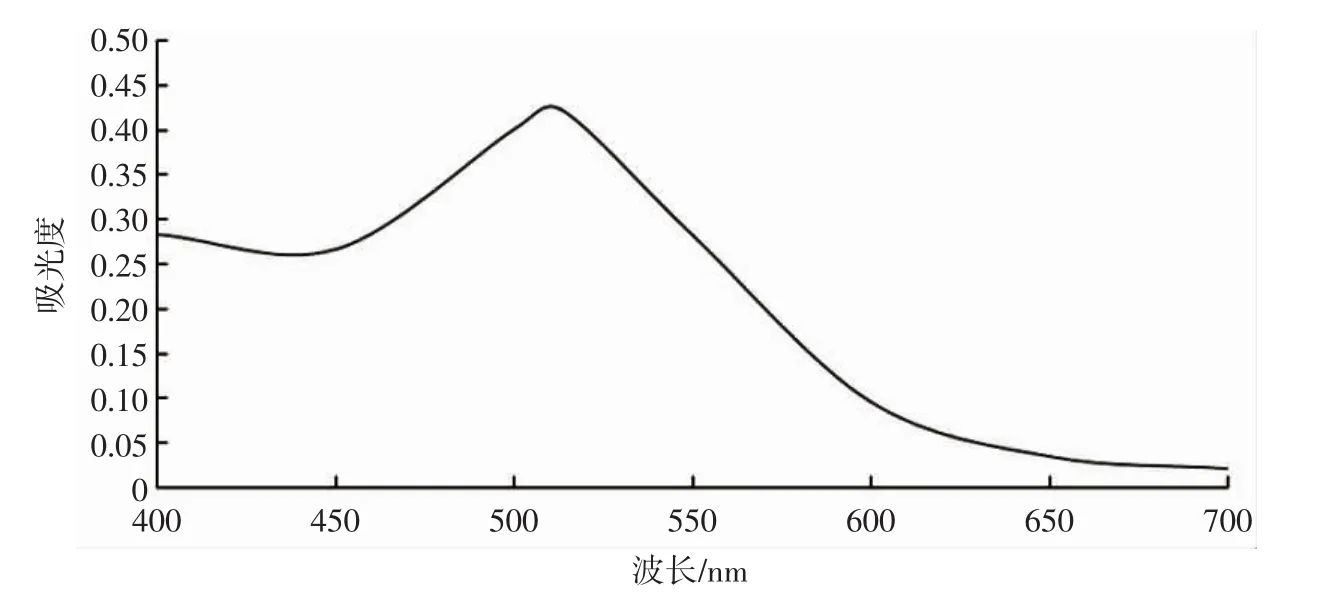
图1 桑葚果渣色素的最佳吸收光谱图Fig.1 Optimal absorption wavelength of mulberry residue pigment
由图1可知,400 nm~700 nm可见光波全段扫描稀释后的提取液在波长513 nm出现最大吸光度,吸光度为0.422 4。
2.2 单因素试验结果
2.2.1 柠檬酸浓度对桑葚果渣色素提取的影响
柠檬酸浓度对桑葚果渣色素提取的影响见图2。

图2 柠檬酸浓度对桑葚果渣色素提取的影响Fig.2 Effect of citric acid concentration on pigment extraction from mulberry residue
由图2可知,提取液的吸光度随着柠檬酸浓度增加先升高后下降,可能是因为花色苷的存在形式随着柠檬酸浓度的增加由醇型假碱转化为黄烊盐[26]。当柠檬酸浓度上升到7.0%时,提取液吸光度达到最大值;之后提取液的吸光度随着柠檬酸浓度的增加而下降,可能是因为随着柠檬酸浓度的增加,黄烊阳离子被水的亲核攻击而水合,浓度下降,使花色苷主要以无色的甲醇假碱或淡黄色查尔酮的形式存在。因此,最佳柠檬酸浓度为7.0%。
2.2.2 料液比对桑葚果渣色素提取的影响
料液比对桑葚果渣色素提取的影响见图3。
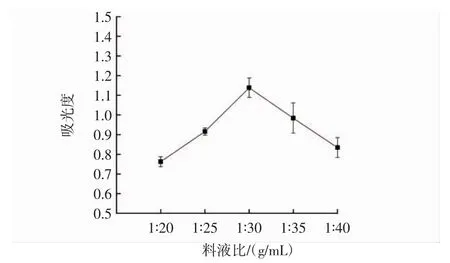
图3 料液比对桑葚果渣色素提取的影响Fig.3 Effect of material-liquid ratio on pigment extraction from mulberry residue
由图3可知,随着溶剂的增加,提取液的吸光度不断增加,料液比为1∶30(g/mL)时吸光度达到最大值,随后溶剂继续增加,桑葚果渣色素溶液被稀释使得溶液浓度下降,吸光度下降。因此,最佳料液比为1∶30(g/mL)。
2.2.3 纤维素酶添加量对桑葚果渣色素提取的影响
纤维素酶添加量对桑葚果渣色素提取的影响见图4。

图4 纤维素酶添加量对桑葚果渣色素提取的影响Fig.4 Effect of cellulase dosage on pigment extraction from mulberry residue
纤维素酶通过降解半纤维素和纤维素,使细胞结构局部变得疏松、膨胀、崩溃,细胞内的色素不断溶出,吸光度不断增加[27]。由图4可知,随着纤维素酶添加量的增加,提取液中的色素含量不断增加,添加量为80 U/mL时吸光度达到最大值,随后酶添加量继续增加,吸光度反而有所下降。因此,最佳纤维素酶添加量为80 U/mL。
2.2.4 超声温度对桑葚果渣色素提取的影响
超声温度对桑葚果渣色素提取的影响见图5。

图5 超声温度对桑葚果渣色素提取的影响Fig.5 Effect of ultrasonic temperature on pigment extraction from mulberry residue
由图5可知,随着超声温度的升高,提取液的吸光度不断增大,超声温度为50℃时吸光度达到最大值,超声温度继续增加,吸光度降低,原因可能是当超声温度较低时,酶活较低,酶促反应慢,色素溶出较少,随着温度的升高,酶促反应加快,色素溶出增多;而当温度过高时,又会抑制酶的活性或使酶失活,酶促反应停止,且高温也会致使桑葚果渣色素大量分解,进一步使吸光度降低。因此,最佳超声温度为50℃。
2.2.5 超声时间对桑葚果渣色素提取的影响
超声时间对桑葚果渣色素提取的影响见图6。
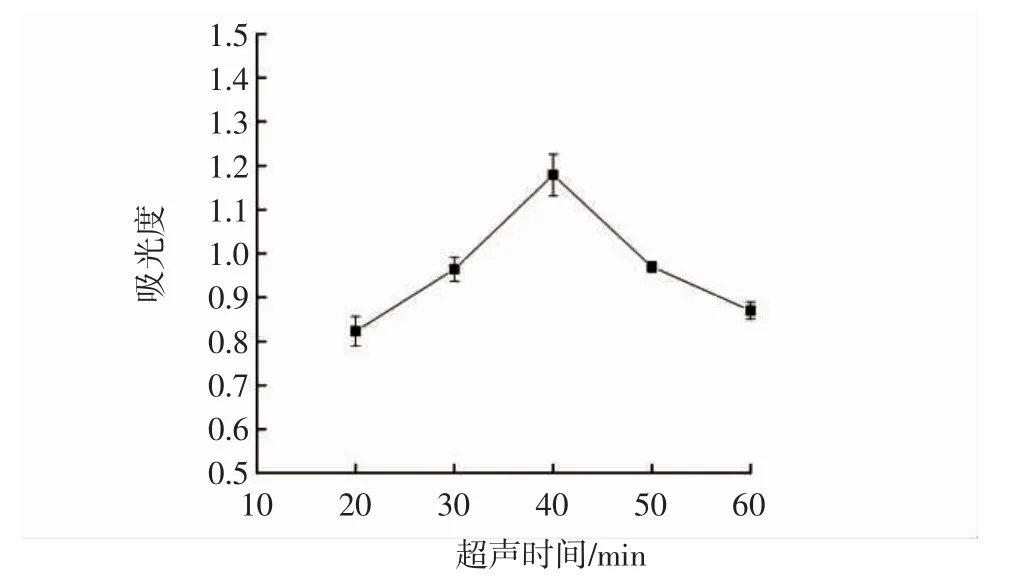
图6 超声时间对桑葚果渣色素提取的影响Fig.6 Effect of ultrasonic time on pigment extraction from mulberry residue
由图6可知,随着超声时间的延长,吸光度不断增大,这是由于超声使得液体体系分子运动速度加快,色素加快溶出,提取液吸光度不断增大。当超声时间达到40 min时,吸光度达到最大值,之后超声时间继续延长吸光度逐渐降低,可能是因为超声时间过长导致桑葚果渣色素大量分解[28]。因此,最佳超声时间为40 min。
2.2.6 超声功率对桑葚果渣色素提取的影响
超声功率对桑葚果渣色素提取的影响见图7。

图7 超声功率对桑葚果渣色素提取的影响Fig.7 Effect of ultrasonic power on pigment extraction from mulberry residue
由图7可知,超声功率低于300 W时,吸光度随着超声功率的增加而增大。功率为300 W时,吸光度达到最大值,可能是因为随着超声功率的增加,溶液中分子之间的碰撞和摩擦频率逐渐增大,从而使产生的机械效应、空化效应、热效应相继增加,加快桑葚色素的溶出。当功率大于300 W时,吸光度开始减小,分析是产生的热效应使桑葚果渣色素分解,使吸光度减小[29]。因此,最佳超声功率为300 W。
2.3 响应面试验结果
2.3.1 响应面试验结果与方差分析
响应面试验结果见表2。

表2 Box-Behnken试验设计方案及结果Table 2 Results of Box-Behnken experiments design
采用Design-Expert 8.0.6分析软件对表2试验结果进行多元回归分析,得到预测模型回归方程为Y=1.36+0.044A-0.14B-0.059C+0.039D-0.045AB-0.084AC-0.011AD-0.029BC-0.045BD+6.000×10-4CD-0.22A2-0.17B2-0.18C2-0.26D2。方差分析见表3。

表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,该模型极显著(P<0.01),失拟项不显著(P=0.832 3>0.05),说明该模型拟合度较好,方程可以较好地预测结果[30]。A、B、C、D、AB、AC、BD、A2、B2、C2、D2对桑葚果渣色素提取效果的影响极显著,说明它们对吸光度的影响比较复杂,不仅是简单的线性关系。R2=0.970 4,R2adj=0.984 8,说明该模型能解释98.48%的变化,拟合度较好,因此能用此模型对桑葚果渣色素提取工艺进行分析和预测。由F值大小可知,4个因素对响应值的影响顺序为超声温度(C)>柠檬酸浓度(A)>料液比(B)>超声时间(D)。
2.3.2 响应面交互作用
以回归方程为依据,绘制各因素之间交互作用的三维空间响应曲面图,结果见图8。

图8 各因素交互作用对桑葚果渣色素提取影响的响应面分析Fig.8 Response surface analysis of the influence of interaction of various factors on pigment extraction from mulberry residue
三维图和等高线能够预测和检验自变量的响应值及自变量之间的关系[31]。由图8可以看出AB、AC和BD的等高线呈椭圆形,说明两者交互作用对吸光度的影响大,达到极显著效果,CD、AD、BC的等高线呈圆形,说明两者的交互作用不显著。
经响应面分析得到桑葚果渣色素最佳提取工艺条件为柠檬酸浓度7.09%、料液比1∶27.73(g/mL)、超声温度48.30℃、超声时间41.08 min,桑葚果渣色素提取液吸光度预测值为1.403 54;为了方便操作,将以上条件调整为柠檬酸浓度7%、料液比1∶28(g/mL)、超声温度48℃、超声时间41 min,在此条件下进行桑葚果渣色素提取,得到桑葚果渣色素提取液吸光度为1.404 5,真实值与预测值相符度高,表明该提取工艺可行。
2.4 桑葚果渣色素抗氧化活性测定结果
桑葚果渣色素提取液的DPPH自由基清除率见图9。

图9 桑葚果渣色素提取液的DPPH自由基清除率Fig.9 DPPH scavenging capacity of mulberry marc pigment solution
由图9可知,样品体积小于140 μL时,桑葚果渣色素提取液、VC溶液、Trolox溶液的DPPH自由基清除率随着样品体积的增加而增加。当样品体积为140 μL时,桑葚果渣色素提取液、VC溶液、Trolox溶液的DPPH自由基清除率分别为97.72%、97.71%和97.05%,样品体积大于140μL时,桑葚果渣色素提取液、VC溶液、Trolox溶液对DPPH自由基清除率的增长缓慢。相同体积的桑葚果渣色素提取液的DPPH自由基清除能力均高于VC溶液和Trolox溶液。
桑葚果渣色素提取液的ABTS+自由基清除率见图10。

图10 桑葚果渣色素提取液的ABTS+自由基清除率Fig.10 ABTS+scavenging capacity of mulberry marc pigment solution
由图10可知,样品体积小于60 μL时,桑葚果渣色素提取液、VC溶液、Trolox溶液的ABTS+自由基清除率随样品体积的增加而增加。当样品体积为60 μL时,桑葚果渣色素提取液、VC溶液、Trolox溶液的ABTS+自由基清除率分别为98.22%、96.68%和98.03%,样品体积大于60 μL时,桑葚果渣色素提取液、VC溶液、Trolox溶液对ABTS+自由基清除率的增长缓慢。相同体积的桑葚果渣色素提取液的ABTS+自由基清除能力要低于Trolox溶液,但略高于VC溶液。
3 结论
通过单因素和响应面分析得到桑葚果渣色素的最佳提取工艺条件:柠檬酸浓度7%、料液比1∶28(g/mL)、超声温度48℃、超声时间41 min,在此条件下进行桑葚果渣色素提取,得到桑葚果渣色素提取液吸光度为1.404 5。表明该模型拟合程度良好,能用此模型对桑葚果渣色素提取进行分析和预测,140 μL桑葚果渣色素提取液的DPPH自由基清除率为97.72%,60 μL的桑葚果渣色素提取液的ABTS+自由基清除率为98.22%。该提取工艺能够提高桑葚果渣色素的提取率,对具有高活性成分天然桑葚色素的提取具有指导意义。
