牛乳乳清中主要过敏原的B细胞表位定位
2022-10-31胡永芯谭宏凯熊子奕袁娟丽潘丽娜汪家琦
胡永芯,谭宏凯,胡 巍,熊子奕,袁娟丽,潘丽娜,汪家琦,李 欣,
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学食品学院,江西 南昌 330047;3.南昌大学药学院,江西 南昌 330047;4.澳优乳业(中国)有限公司,湖南 长沙 410005)
牛乳及乳制品因含有较高的营养价值而备受广大消费者的青睐,但牛乳过敏引发的食品安全问题也被人们广泛关注。牛乳及牛乳制品是世界卫生组织与联合国粮食及农业组织认定的八大类主要过敏食物之一。牛奶蛋白过敏(cow’s milk allergy,CMA)是生命早期的一种常见疾病,患病率为2%~7%,且呈现增加的趋势。据估计,欧洲国家2%~3%的婴儿会出现牛乳过敏症状。在一项针对6 768 名中国婴儿的最新调查中,发现CMA患病率为2.69%。CMA分为免疫球蛋白E(immunoglobulin E,IgE)介导、非IgE介导和混合(IgE与非IgE)介导。大约60%的CMA是IgE介导,即与体液免疫反应异常有关,尽管因研究人群和年龄的不同而略有差异。非IgE介导或两者混合介导的CMA相对少见。IgE介导的CMA发生机制是牛乳过敏原致敏机体免疫细胞并使之产生特异性IgE(specific IgE,sIgE),随后sIgE与效应细胞结合使其处于致敏阶段;机体再次接触到同种过敏原会导致效应细胞脱颗粒和释放介质,如组胺等,最终导致皮肤系统、呼吸系统、胃肠道系统等出现临床症状,如湿疹、呼吸困难、腹痛、呕吐等,牛乳过敏严重时甚至会导致患者休克和死亡。
牛乳中含有30多种蛋白质,都具有潜在致敏性。目前认为酪蛋白、-乳球蛋白(-lactoglobulin,BLG)和-乳白蛋白(-lactalbumin,ALA)是主要过敏原。在20 ℃条件下调节脱脂乳pH值至4.6,可得到两部分:其中凝固状态的酪蛋白占80%,溶液状态的乳清蛋白占20%。乳清蛋白中主要过敏原是BLG和ALA,分别占乳清蛋白组分的50%和25%。BLG是一种属于脂钙蛋白超家族的具有162 个氨基酸残基的视黄醇结合蛋白,在天然状态下以36 kDa二聚体的形式存在,它具有2 个二硫键和1 个游离半胱氨酸。ALA是一种属于溶菌酶家族的具有123 个氨基酸残基的单体球状钙结合金属蛋白,分子质量为14.4 kDa,具有4 个二硫键和1 个钙的高亲和力结合位点。有研究发现大约82%的牛乳过敏患者对BLG过敏,大约75%的牛乳过敏患者可对多种牛乳蛋白过敏。
表位是过敏反应的物质基础,可分为线性表位和构象性表位,前者由氨基酸残基线性排列组成,后者是氨基酸残基在空间相互靠近形成的能被免疫活性物质识别的特定三维结构。表位也可以按照表位受体分为T细胞表位与B细胞表位,B细胞表位指的是B细胞受体或B细胞分泌的特异性抗体识别的表位,如IgE表位和IgG表位。B细胞线性表位的长度通常有8~15 个氨基酸。尽管有报道称线性表位可短至5 个氨基酸,但能与IgE高活性结合的表位至少含有8 个氨基酸。近年来,肽阵列、噬菌体展示、X射线晶体学等技术都已经运用于食物过敏原表位的定位。噬菌体展示技术是一种基于噬菌体表面展示的目标多肽或蛋白进行筛选的体外选择系统,能实现抗体基因型和表现型的统一,由于其便捷、特异性强、操作方便等特点,被广泛用于表位定位。
通过各种物理方法、化学方法、生物方法破坏牛乳蛋白表位能有效降低牛乳蛋白致敏性,其中酶法水解乳蛋白已经被广泛应用于低致敏配方奶粉的制备,也是预防和缓解婴幼儿牛乳过敏的重要途径。市面上的牛乳低致敏水解配方奶粉主要通过酶解酪蛋白或乳清蛋白获得。理论而言,基于乳清蛋白主要过敏原表位进行定向酶解能有效降低致敏性,将是低致敏乳蛋白研发的新趋势。本研究瞄准牛乳乳清中主要过敏原,即ALA和BLG,进行表位定位,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)筛选16 个牛乳过敏儿童患者的血清,以Hitrap Protein G HP亲和层析柱纯化的高纯度牛乳特异性抗体为靶分子,对噬菌体随机十二肽库进行亲和淘选,并利用生物信息学进行预测,最后获得ALA和BLG的表位信息。本研究获得的表位数据可用于指导定向打断表位的蛋白酶筛选和基于表位的低过敏性乳清蛋白制品开发。
1 材料与方法
1.1 材料与试剂
BLG、ALA、明胶、生物素标记羊抗人IgE、辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗人IgG美国Sigma-Aldrich公司;Ph.D.-12噬菌体试剂盒英国Biolabs公司;BCA蛋白定量试剂盒 上海碧云天生物技术有限公司;96 孔酶标板 深圳金灿华实业有限公司;HRP标记的亲和素、3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)底物溶液北京欣博盛生物科技有限公司;Protein G HP预装柱美国GE公司;预染蛋白Marker 美国Thermo公司;5×上样缓冲液(含-巯基乙醇)、0.45 μm 滤膜北京索莱宝科技有限公司;HRP酶标记的抗M13二抗北京义翘神州科技股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
微量蛋白测定仪、PowerPac 3000电泳仪、Mode 1860酶联免疫检测仪、Quantity One凝胶成像系统美国Bio-Rad公司;Amicon Ultra-15超滤离心管、超纯水生成器 美国Millipore公司;高速冷冻离心机 美国Thermo公司;pH计 德国赛多利斯集团;ME104型电子天平 梅特勒托利多仪器上海有限公司;紫外检测仪上海青浦沪西仪器厂。
1.3 方法
1.3.1 牛乳过敏患者血清池的构建
本实验使用的过敏患者血清由北京协和医院惠赠。过敏患者血清中针对牛乳蛋白的sIgE水平由ImmunoCAP检测,选择牛乳蛋白sIgE水平大于等于0.35 kU/L并且年龄在3~12 岁的血清进行ELISA。参考李柳栩的方法并作出适当调整,利用间接ELISA法测定牛乳过敏患者血清中抗ALA特异性免疫球蛋白E(-lactalbumin specific immunoglobulin E,ALA-sIgE)、抗ALA特异性免疫球蛋白G(-lactalbumin specific immunoglobulin G,ALAsIgG)、抗BLG特异性免疫球蛋白E(-lactoglobulin specific immunoglobulin E,BLG-sIgE)、抗BLG特异性免疫球蛋白G(-lactoglobulin specific immunoglobulin G,BLG-sIgG)水平。包被液为pH 9.6的0.05 mol/L碳酸盐缓冲液,洗液、封阻液、血清、二抗等均使用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS),洗液含有0.05%(/)Tween-20,封阻液含有3%明胶。使用包被液将ALA或BLG稀释到1 µg/mL,加入到96 孔酶标板,100 µL/孔,4 ℃过夜。隔日取出酶标板并扣干,洗板3 次,每次5 min。加入封阻液,250 µL/孔,37 ℃保温保湿1 h。取出酶标板扣干后洗涤3 次。加入稀释好的过敏患者血清,100 µL/孔,37 ℃保温保湿1 h。测定IgG水平时,血清稀释倍数为2 000 倍。测定IgE水平时,血清稀释倍数为200 倍。取出酶标板扣干后洗涤3 次,加入1∶5 000稀释的HRP标记羊抗人IgG或生物素标记羊抗人IgE,100 µL/孔,37 ℃保温保湿1 h。对于IgG板,二抗孵育结束后,直接取出酶标板扣干后洗涤3 次,加入TMB底物溶液,100 µL/孔,37 ℃保温保湿15 min。加入2 mol/L HSO溶液终止反应,50 µL/孔。测定450 nm波长处的吸光度。对于IgE板,二抗孵育结束后,还需额外加入HRP标记的亲和素,具体步骤为:取出酶标板扣干后洗涤3 次,加入1∶60稀释的HRP标记的亲和素,100 µL/孔,37 ℃保温保湿1 h。后续显色步骤与IgG板保持一致。
以/>2且>0.2时血清判断为阳性,其中和分别为样品与阴性血清的OD值。根据间接ELISA结果,筛选出ALA-sIgE、BLG-sIgE、ALA-sIgG、BLG-sIgG水平均呈现阳性的患者血清混合血清池。
1.3.2 特异性抗体的纯化
参考袁水林方法使用Protein G柱进行牛乳蛋白抗体的纯化,并加以改进。先后采用200 µL活化液(1 mol/L Tris-HCl,pH 9.0)和10 倍柱体积的平衡缓冲液(20 mmol/L PBS,pH 7.4)冲洗亲和柱,流速均为1 mL/min。采用平衡缓冲液以1∶1(/)的比例稀释血清后通过0.45 μm水系滤膜。过滤后的血清加入亲和柱后,将亲和柱上下的盖子旋紧,37 ℃摇动结合1 h。以平衡缓冲液和洗脱液(0.1 mol/L 甘氨酸-HCl,pH 2.7)分别对亲和柱进行非特异性和特异性洗脱,流速均为1 mL/min,收集流出液200 µL/管。在收集特异性洗脱峰的过程中,加入中和液(1 mol/L Tris-HCl,pH 9.0)到收集管,标准是每毫升特异性洗脱液中加入60~200 µL中和液,直到pH值达到7左右。特异性洗脱结束之后,分别用10 倍柱体积的平衡缓冲液和20%乙醇溶液洗涤亲和柱。收集到的非特异性洗脱液与特异性洗脱液用超滤离心管浓缩并更换缓冲液为0.01 mol/L PBS。采用还原型聚十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)鉴定纯化的抗体,采用BCA试剂盒鉴定浓度。将获得的抗体于-20 ℃冰箱保存。参考1.3.1节进行纯化抗体的IgE和IgG水平测定,作出如下调整:IgE与IgG水平测定时,样品(浓缩非特异性洗脱液与特异性洗脱液)的稀释倍数分别是20 倍和200 倍。
1.3.3 噬菌体展示技术筛选IgE与IgG表位
参考NEB噬菌体试剂盒说明书,利用噬菌体随机肽库进行IgE与IgG模拟表位的淘选。第1~4轮,包被的IgE质量浓度为600、450、300、300 µg/mL,包被的IgG质量浓度分别为100、75、50、50 µg/mL,洗液体积分数分别为0.1%、0.25%、0.5%、0.5%,噬菌体孵育结合时间分别为60、45、30、30 min,甘氨酸洗脱时间分别为6、8、10、10 min。逐步严格的淘选条件有助于选择到特异性更强的噬菌体序列。从IgE或IgG组第4轮测滴度的平板上挑取各10 株噬菌体送往金唯智公司进行测序,测序引物为-96III。
1.3.4 间接ELISA鉴定阳性噬菌体克隆
通过噬菌体ELISA 检测所选多肽对抗体的结合。按照噬菌体试剂盒说明书,并基于实验方案作出以下调整:包被蛋白是2 µg/mL的抗牛乳蛋白IgE(IgG),100 µL/孔,包被于96 孔微孔板上,4 ℃孵育过夜,同时包被3% BSA-PBS作阴性对照。倾去孔内液体,用含0.05%(/)Tween-20的PBS洗涤3 次。用3%的明胶封阻,300 µL/孔,37 ℃孵育1 h。洗板3 次,加入经扩增纯化的噬菌体,100 µL/孔,37 ℃孵育1 h。加入的噬菌体数量有4 组梯度,分别约为10、10、10、10个/孔,阴性对照加入噬菌体量为10个/孔,空白对照加PBS。洗板6 次,加入HRP标记的抗M13二抗,100 µL/孔,37 ℃孵育1 h。洗板6 次,加入TMB显色液,100 µL/孔,37 ℃避光显色15 min。加入2 mol/L HSO溶液终止反应,50 µL/孔,测定OD值。/>2且>0.2时,噬菌体判断为阳性,其中和分别为样品与阴性对照的OD值。
1.4 数据处理
用于序列分析的ALA和BLG的氨基酸序列从NCBI数据库(www.ncbi.nlm.nih.gov)获取。使用DNAStar的Editseq软件模块对插入的噬菌体外源基因序列进行翻译。分别使用DNAman 7.0软件和The Pepitope Server网络服务器(http://pepitope.tau.ac.il/)进行线性表位与构象性模拟表位的定位。采用GraphPad Prism 8.0.1处理ELISA数据,使用检验方法评价准确性,<0.05,差异显著。
2 结果与分析
2.1 牛乳过敏患者血清信息
牛乳过敏患者血清信息见表1。16 名患者包括9 名男性7 名女性,患者年龄的平均值为4.4 岁,6 岁以上儿童仅有4 名,可能原因是牛奶过敏在6 岁后消退。患者的临床症状表现为湿疹、特异性皮炎、食物过敏反应等,其中食物过敏包括皮肤系统症状(风团、瘙痒、充血等)、胃肠道系统症状(腹痛、腹泻、恶心、呕吐等)、呼吸系统症状(咳嗽、喘息、胸闷、呼吸困难等),以及严重过敏反应(头晕、晕厥、黑朦等)。ImmunoCAP是检验IgE水平的金标准,已经证实在牛奶、鸡蛋和花生过敏的诊断上有很高的准确性。本实验根据ImmunoCAP系统检测牛乳蛋白sIgE抗体水平,高于0.35 kU/L阈值的血清被视为阳性。本实验所用的患者sIgE值集中在1.0 kU/L附近,其中15号血清的sIgE值最高,超过100 kU/L。15号患者未显示出较严重的过敏反应,说明sIgE水平与过敏症状无正相关关系。Anvari等报道sIgE水平高,过敏反应发生的几率更高,这是值得注意的问题。

表1 牛乳过敏患者的特征Table 1 Characteristics of patients with cow milk allergy enrolled in this study
2.2 牛乳过敏患者ALA和BLG IgE水平测定
通过间接ELISA测定患者血清中针对乳清主要过敏原的特异性抗体水平。本研究中有75%(14份)牛乳过敏患者血清对BLG存在IgE阳性反应,有25%(4 份)患者对ALA存在IgE阳性反应。本实验结果说明BLG确实是主要过敏原,同时,在此16 个牛乳过敏患者中,ALA可被认为是次要过敏原,这与Tsabouri等研究结果相似,他们获得的牛乳患者对BLG和ALA过敏率分别为51%和19%。另外过敏患者的牛乳蛋白sIgE水平并未显示出与性别等因素相关。从图1还发现,ImmunoCAP的牛乳蛋白sIgE结果与ELISA结果存在差异,因为前者是通过粗蛋白进行检测,后者只检测了某一种组分蛋白,而部分不可能代表整体,后者会遗漏部分特异性抗体的检测。而对于sIgG,ALA和BLG具有相似的特异性识别,主要是1、3、4、7、12、13、14、15号血清,其中7号血清对ALA识别的显著性差异最为明显。
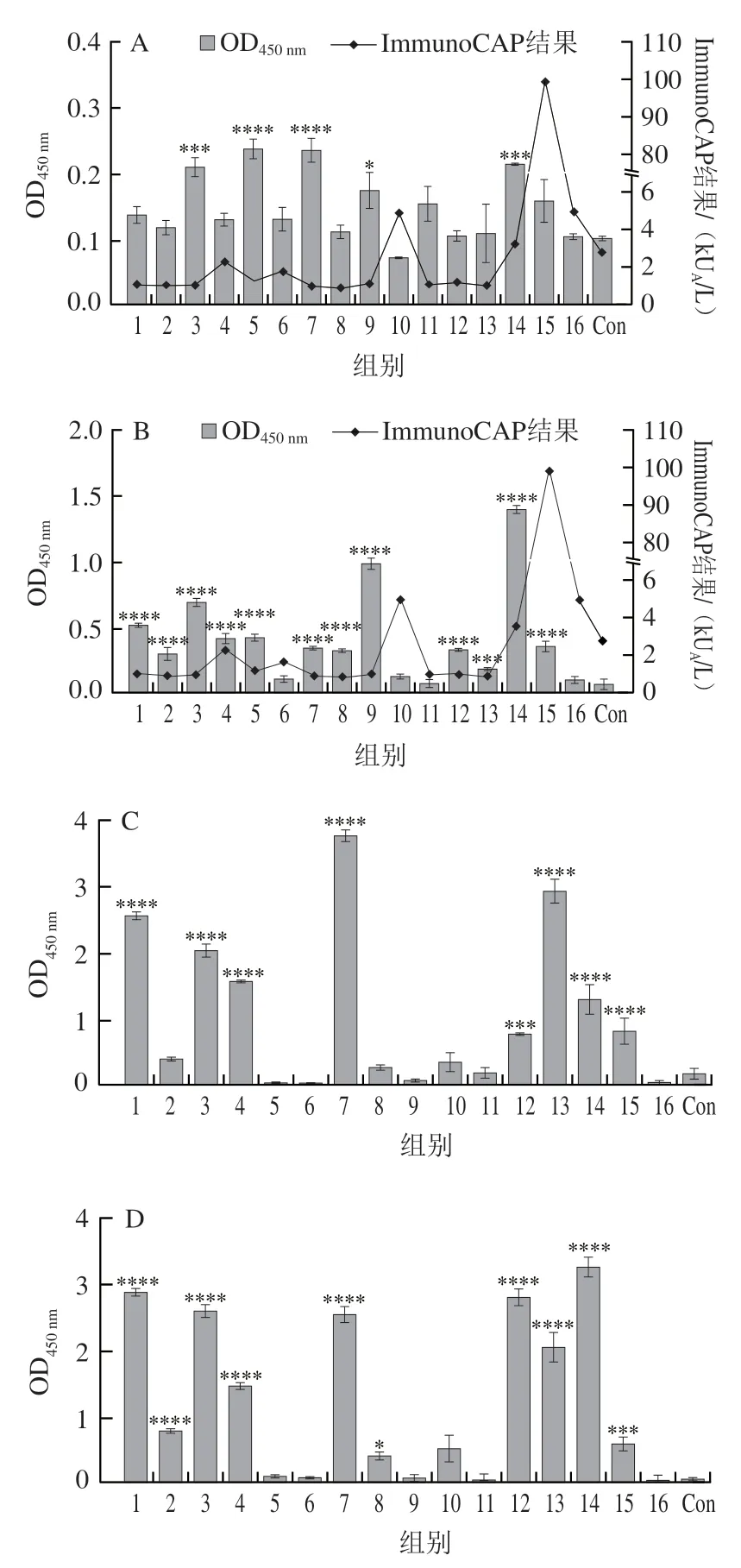
图1 牛乳过敏患者特异性抗体水平Fig.1 Levels of specific antibodies in patients with milk allergy
为后续噬菌体展示技术筛选表位,需要挑选特异性抗体水平较高的血清制备血清池。血清5、6、9、11、16的ALA-sIgG和BLG-sIgG水平都偏低,6、10、11、16号血清的ALA-sIgE和BLG-sIgE水平较低,但血清5和9号的BLG-sIgE水平较高。综上,6、10、11、16号不参与血清池构建,其余12 份混血清池。
2.3 抗牛乳蛋白抗体的亲和纯化与效价测定结果
采用蛋白G柱纯化血清池的IgE与IgG抗体。链球菌G蛋白是链球菌菌株的细胞壁中的一种蛋白质,能在不改变IgG结构的前提下与其特异结合。与蛋白A柱相比,蛋白G柱具有亲和力强,结合谱广,结构稳定等特点。
IgG由两条相同的重链和两条相同的轻链组成“Y”形结构,每条重链包含两个不同的区域:可变区和恒定区。经Protein G柱纯化后的IgG(图2泳道3),在还原型电泳的结果中显示为两条蛋白条带,分别位于50 kDa和25 kDa,仅含有少量的杂蛋白,主要集中在125 kDa左右。由图2可知,未经任何处理的血清含有较多的杂蛋白(泳道1)。泳道2为非特异性洗脱液,在72 kDa附近有明显的条带,在50 kDa处没有明显条带,说明其中的IgG已经被分离。经过Image J软件计算,泳道2和泳道3的纯度分别是90%和95.2%,因此认为获得了没有IgG抗体的非特异性洗脱液和高纯度的抗牛乳IgG抗体。
纯化前的血清池体积为200 µL,经过超滤浓缩更换缓冲液,将获得的IgG保存于PBS中,最终各获得600 µL的非特异性洗脱液和特异性洗脱液。BCA测定结果表明,非特异性洗脱液和特异性洗脱液的质量浓度分为为3 000 µg/mL和1 700 µg/mL。进行间接ELISA测定效价,由图2B可知,特异性洗脱峰收集液中,ALA-sIgG和BLG-sIgG水平很高,而ALA-sIgE和BLG-sIgE水平很低,相反,非特异性洗脱液有较高的ALA-sIgE和BLG-sIgE水平。因此,认为蛋白G柱能有效从血清中分离IgG(特异性洗脱液)与IgE(非特异性洗脱液)。
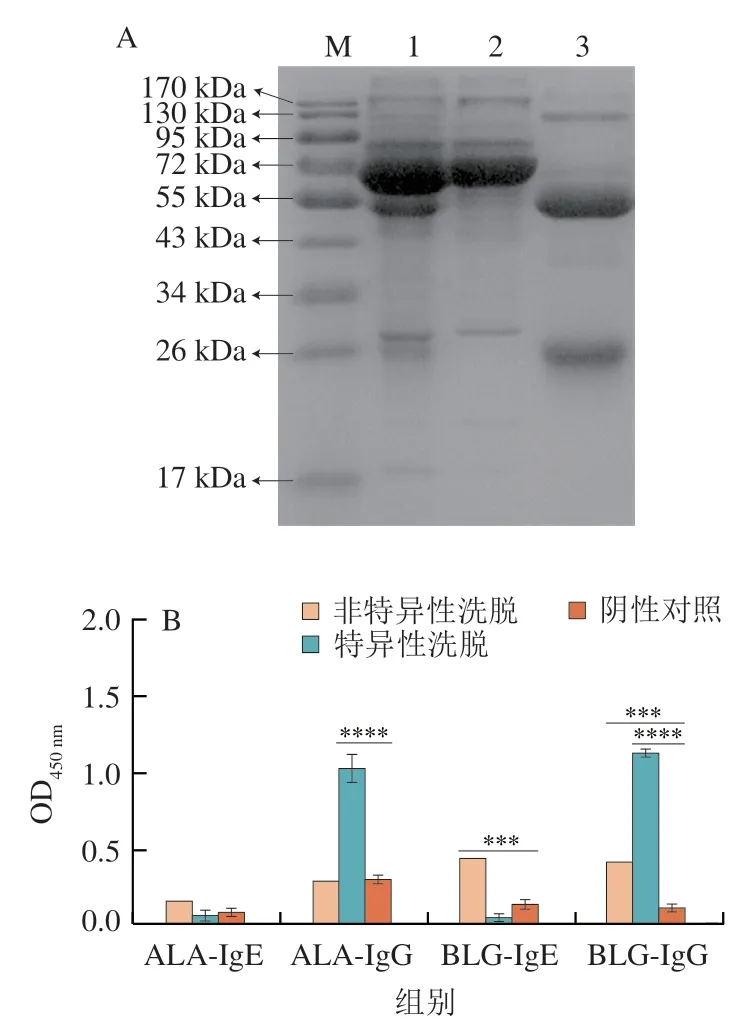
图2 Protein G亲和纯化SDS-PAGE(A)和纯化抗体的ELISA(B)Fig.2 SDS-PAGE patterns of proteins purified by Protein G affinity chromatography (A) and results of ELISA for purified antibodies (B)
2.4 亲和淘选过程中噬菌体的富集
本实验共进行了4 轮淘选,逐渐降低抗体(IgG与IgE)的包被量,增加洗液的Tween-20含量,噬菌体结合时间逐渐减少,洗脱时间逐渐延长,目的是增加淘选的严格程度以便筛选出特异性更强的噬菌体。表2展示了淘选过程中噬菌体的富集效果,可以发现每经过1 次淘选,噬菌体产出量和回收率都有所增加。在第4轮中,在IgE与IgG洗脱液中,每10 µL噬菌体的空斑形成单位滴度分别达到1.2×10PFU和1.3×10PFU,表明特异性结合的噬菌体在此过程中得到了有效富集。

表2 儿童IgE和IgG 4 轮亲和淘选中噬菌体的富集Table 2 Phage enrichment in four rounds of affinity panning for IgE and IgG in children
2.5 噬菌体测序与噬菌体ELISA结果
第4轮的平板中,分别在IgG和IgE组中挑选10 个噬菌斑,分别命名为IgG1~IgG10、IgE1~IgE10,表3展示了噬菌体外源序列。送往金唯智公司进行测序并获得19 个12肽随机序列,另外一个克隆子未检测到序列,可能是由于外源基因的丢失。在这19 个12肽中,有3 个序列出现了2 次,分别为VVGRAMAYSTIP、VSVPGIITGTLR、CFARTPSILMLA,其余序列均出现1 次。采用间接ELISA检测所选多肽对抗体的结合能力。发现随着加入噬菌体数量的降低,吸光度也呈现降低的趋势。图3展示了噬菌体加入量为10个/孔时的OD值。发现除了IgE5,其余克隆子的OD值全部高于阴性对照组的2 倍,因此18 个克隆子被判断为阳性克隆。
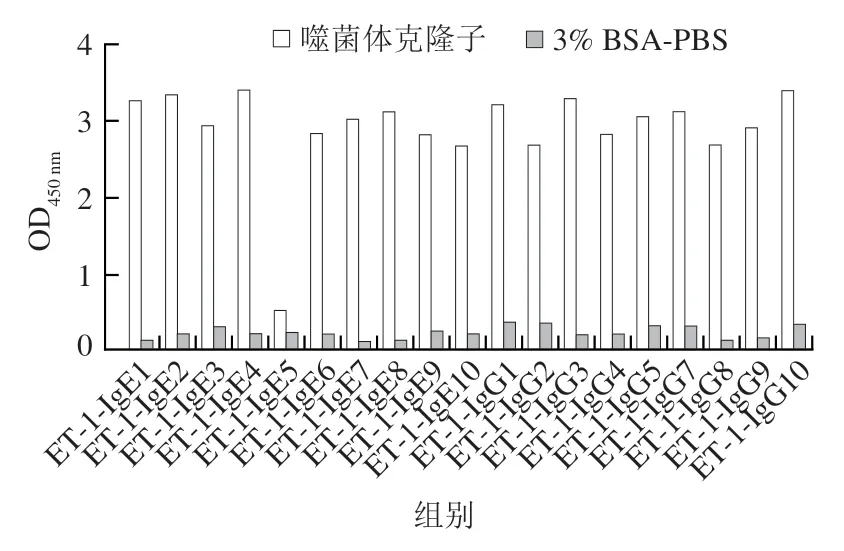
图3 噬菌体克隆子的间接ELISA检测结果Fig.3 Results of indirect ELISA for phage clones
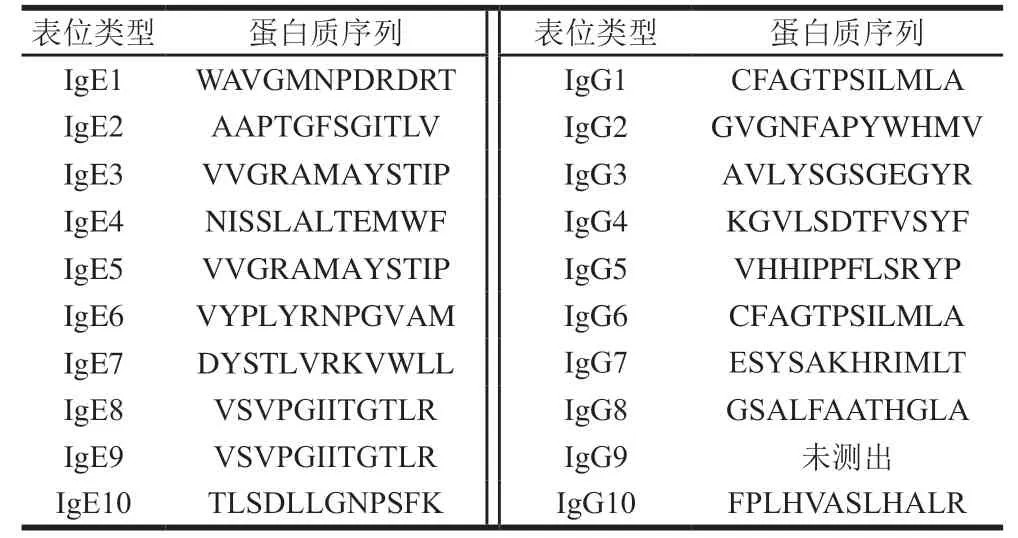
表3 儿童血清池模拟表位Table 3 Mimotopes panned in children’s serum pool
2.6 线性表位定位
使用软件DNAman 7.0的多序列对比功能将噬菌体外源序列与ALA和BLG氨基酸序列进行对比,默认参数不变,分析肽段的识别位点与出现频率,含有连续重合3 个氨基酸以上的肽序列和非连续重合5 个氨基酸以上的肽序列被定义为线性表位。由于杂蛋白不具有ALA和BLG特异性,所以假阳性序列只有极低的可能性与ALA或BLG序列的重合度较高。通过舍去多重对比结果中重合度较低的外源序列,能有效筛去噬菌体展示技术淘选到的可能结合杂蛋白的假阳性序列。图4和图5分别展示了ALA和BLG的线性表位。定位出ALA的IgE线性表位位于AA11~27,IgG线性表位位于AA17~29。BLG的IgE线性表位有3 个,分别为AA15~32、AA89~104、AA111~133,IgG线性表位为AA121~132。发现在测序结果中,重复出现两次的VVGRAMAYSTIP和CFARTPSILMLA分别被定位为BLG的IgE和IgG线性表位,说明结合肽中的共有序列更可能是表位。从图4和图5可知,ALA的AA17~27区域和BLG的AA121~132区域能同时被IgE和IgG识别,可能是IgE和IgG的共有表位。研究表明,血清IgG4能阻止IgE与其受体的结合。IgG4抑制IgE活性可能有两种机制:IgG4与IgE直接竞争结合过敏原或IgG4结合抑制性FcγRIIb。还有研究表明,能识别相同过敏原但亚类不同的抗体,即IgG1、IgG2、IgG3、IgA1和IgA2,能够同等程度地阻断嗜碱性粒细胞的激活。IgE和IgG共有表位的发现支持以上结论,即任何对过敏原具有足够亲和力的抗体都有可能通过与IgE竞争结合共有表位来有效防止IgE与其受体的交联。

图4 ALA的线性表位Fig.4 Linear epitopes of ALA

图5 BLG的线性表位Fig.5 Linear epitopes of BLG
2.7 构象性表位定位
使用The Pepitope Server网络服务器(http://pepitope.tau.ac.il/)进行构象性模拟表位的定位,考虑算法分值、值等参考因素,分别选择前5 个评分最高的序列作为ALA和BLG的构象性模拟表位。表4、5分别展示了ALA和BLG构象性表位的氨基酸组成和评分,图6、7分别展示了ALA和BLG的构象性表位的三维结构。发现ALA的构象性表位都位于-螺旋区域,这提示-螺旋结构在ALA构象性表位中非常重要。而BLG的多数构象性表位位于无规则区域,没有在-折叠区域发现构象性表位,需要进一步深入探索和研究。

表4 ALA构象性表位Table 4 Conformational epitopes of ALA
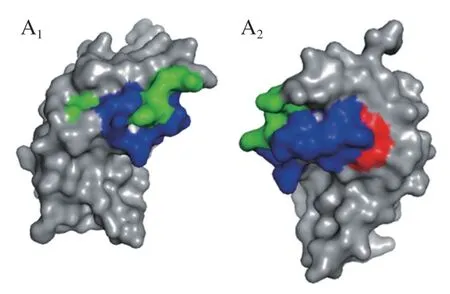
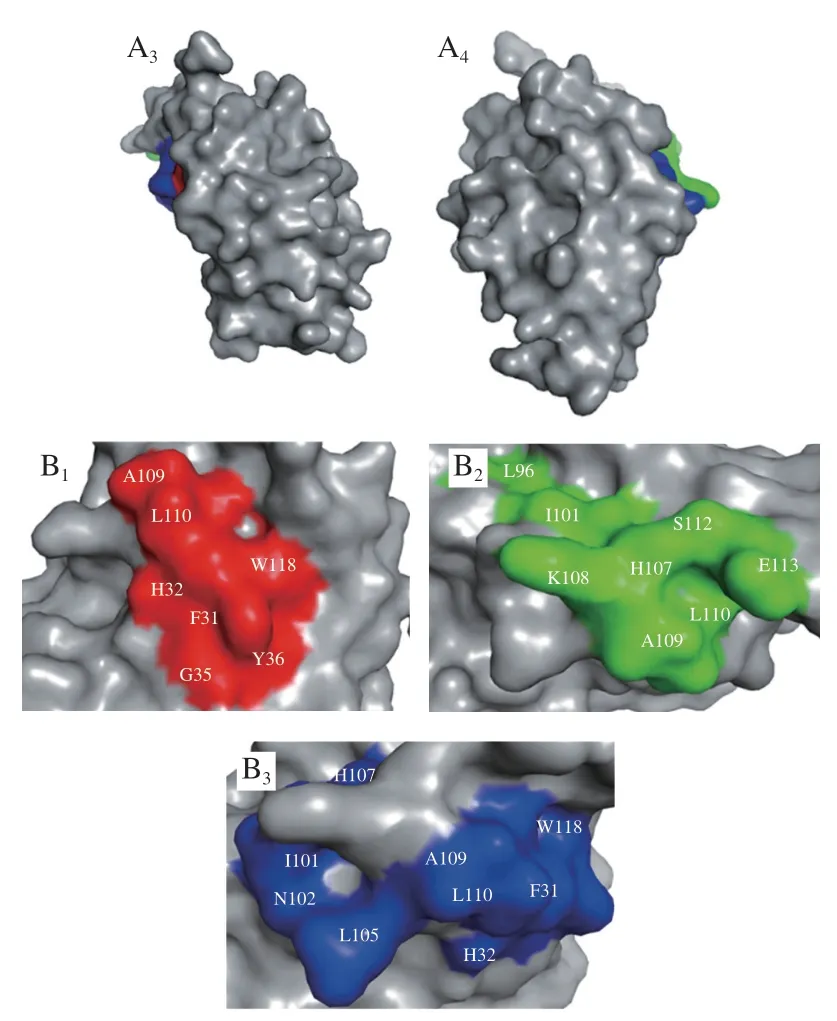
图6 ALA的3 个构象性表位的分子表面(A)和构象性表位氨基酸组成(B)Fig.6 Molecular surface representation (A) and amino acid composition (B) of the three conformational epitopes of ALA
另外发现在ALA的构象性表位氨基酸组成中,L和A是3 个构象性表位的共有氨基酸,W和F能同时被IgG2和IgE4识别,H和I能同时被IgG7和IgE4识别,表明这些氨基酸可能在构象性表位的形成中发挥着至关重要的作用。ALA的3 个构象性表位的氨基酸组成相似,且在空间结构的位置较为紧密,集中在AA101~113,说明该区域很可能是ALA的关键表位。BLG的两个构象性表位氨基酸组成不相似,空间位置不接近,表明牛乳过敏患者可能识别BLG的不同构象性表位。

表5 BLG构象性表位Table 5 Conformational epitopes of BLG
图7 BLG的2 个构象性表位的分子表面(A)和构象性表位氨基酸组成(B)Fig.7 Molecular surface representation (A) and amino acid composition (B) of the two conformational epitopes of BLG
3 讨论
牛乳过敏大多数是IgE介导的I型速发型超敏反应,一般在摄入牛乳24 h内出现过敏症状,通常基于临床病史和牛乳蛋白sIgE水平或皮肤点刺实验确诊。除了过敏原sIgE,IgG在食物过敏中的作用同样值得关注。IgG是血清中含量最多的免疫球蛋白(约占70%),IgG水平的升高与儿童牛奶过敏的自然消退呈正相关。在花生蛋白sIgE抗体检测呈阳性的受试者中,Santos等发现更高水平的花生蛋白sIgG4与耐受性相关。IgG4也已经被确定为皮下过敏原免疫疗法中非常强大的生物标志物。
众所周知,X射线是一种精确的表位定位方法,但天然IgE抗体的缺乏限制了X射线在表位定位的广泛应用。噬菌体展示技术可作为一种食物过敏原表位定位的替代方法,通过生物淘选噬菌体库定位出线性与构象表位。袁水林等采用两步亲和层析法从8 名儿童中分离纯化了抗ALA的特异性抗体,随后,分别从Ph.D.-12和Ph.D.-C7C中淘选到ALA的线性表位与构象性表位。花生主要过敏原Ara h 1的IgE和IgG4表位也通过噬菌体展示随机七肽库的竞争性免疫淘选被鉴定,结果显示每个患者都有自己独特的IgE和IgG4表位识别谱,但一些重要的IgE表位对所有患者都是通用的。
本研究识别到ALA的IgE线性表位位于AA11~27,IgG线性表位位于AA17~29。前者与Järvinenet等报道的IgE线性表位AA13~26完全重合,后者与丛艳君等识别到的IgG线性表位AA21~35完全重合,也识别到他们报道的关键氨基酸Pro。本研究与Li Xin等均采用噬菌体展示和二代测序相结合的方法筛选不同血清样本之间共享的表位,但定位出的ALA线性表位并不一致,可能是血清的样本差异导致识别不同表位图谱。定位出BLG的IgE线性表位位于AA15~32、AA89~104、AA111~133,IgG表位为AA121~132。Cong Yanjun等的初始数据也显示AA17~31、AA92~106是BLG的IgE线性表位,AA127~141是BLG的IgG表位。另一项对14 名牛乳过敏患者的研究表明,所有患者血清均识别AA95~113,而单个过敏患者血清显示出与AA12~27及AA124~135的反应。本研究还发现一些IgE线性表位与IgG线性表位存在重叠,如ALA的AA17~27区域和BLG的AA121~132区域能同时被IgE和IgG识别,表明这些区域可能是IgE和IgG的共有表位。研究表明,非IgE抗体在过敏反应中的对IgE抑制作用可能是由于它们与IgE竞争结合过敏原上的共有表位,这些阻断抗体是一种潜在的有价值的免疫治疗抗体,可用于被动过敏原免疫疗法。同时,表位重叠位置的共同氨基酸可能是检测和诊断牛奶过敏的潜在有效信息标记物。
在本研究中,定位出ALA的2 个IgG构象性表位和1 个IgE构象性表位,BLG的1 个IgG构象性表位和1 个IgE构象性表位,其中ESLAKHIL与Li Xin等定位出的ALA的构象性LHKL高度吻合,表明L、H、L这3 个氨基酸可能是ALA构象性表位的关键组成氨基酸。同时,在本研究中,一些氨基酸能同时被IgE和IgG构象性识别,如ALA的L、A、W等,表明IgE和IgG的构象性表位存在一定相似性。研究还发现一些线性表位的残基也出现在构象性表位中,如BLG的AA28~31,这些发现也支持了Ferdous等的观点:在过敏反应中,超过90%的表位是构象表位,一些线性表位是构象表位的组成部分。
4 结论
通过噬菌体展示技术结合生物信息学成功定位出ALA和BLG的B细胞表位,包括线性与构象性表位。ALA的IgE线性表位为AA11~27;IgG线性表位为AA17~29;BLG的IgE线性表位为AA15~32、AA89~104、AA111~133;IgG 线性表位为AA121~132。研究发现IgE和IgG线性表位存在共同区域,表明对同种过敏原具有特异性的非IgE抗体可能通过与IgE竞争结合过敏原表位而发挥阻断作用。同时,定位出ALA和BLG的构象性表位,并发现线性表位与构象性表位存在重叠区域,证明某些线性表位是构象性表位的一部分。
