酵母甘露聚糖肽对致病性大肠杆菌感染小鼠的保护作用
2022-10-29王海迪蔡钦岭于旻睆刘卫敏魏玉西
王海迪,蔡钦岭,马 瑞,于旻睆,刘卫敏,魏玉西
(青岛大学生命科学学院,青岛 266071)
甘露聚糖肽(mannatide)是我国首次采用溶血性链球菌发酵法成功制备的一种新型免疫增强剂,具有调节机体防御功能和提高自身抗肿瘤能力的作用,系由不同链长度的甘露聚糖肽分子组成,其中,不存在单糖、双糖等小分子糖类和游离氨基酸。即使甘露聚糖肽原料中含有其他单糖或单糖组成的多糖及不同连接方式构成的糖肽,其含量也很低。因其制备原料单一、价格昂贵,探究甘露聚糖肽其他来源和制备方法成为国内研究热点。
我国食品发酵产业发达,酵母产量巨大,亟待开发高值化利用产品。根据文献报道,酵母细胞壁厚约70 nm,约占细胞干重的20%~30%,酵母细胞壁主要由三类多糖构成:甘露聚糖共价连接到多肽的聚合物(甘露聚糖蛋白,约占细胞壁干重的40%)、葡萄糖聚合物(β-D-葡聚糖,约占细胞壁干重的60%)和-乙酰氨基葡萄糖聚合物(甲壳素,约占细胞壁干重的2%)。啤酒酵母细胞壁中含有丰富的甘露聚糖及蛋白,是制备酵母甘露聚糖肽的良好资源。
甘露聚糖肽在人类临床上主要应用于治疗肿瘤的辅助药,免疫力低下以及白细胞减少症,减轻放化疗对肠胃反应影响等,同时还具有抗病毒、抗呼吸道感染以及特殊的抗菌效果。李守现等通过研究α-甘露聚糖肽对断奶仔猪生长性能的影响,发现甘露聚糖肽可以降低断奶仔猪的发病率及死亡率,增强机体细胞免疫,增强小肠原始淋巴细胞的活性和小肠内白细胞吞噬能力。王利菊和刘耀强发现甘露聚糖肽可以提高机体对各种疾病的抵抗力。甘露聚糖肽进入肠道后可以改善细胞内外的生物活性,主动修复受损的肠道黏膜组织,增强对营养物质的吸收和利用,但目前国内尚未有酵母甘露聚糖肽对动物肠道保护作用的研究报道。
本文将通过酶解、醇沉获得酵母甘露聚糖肽,研究其对致病性大肠杆菌(PEC)感染小鼠的保护作用。研究结果为酵母甘露聚糖肽作为新型饲料添加剂提供理论基础。
1 材料与方法
1.1 材料
健康同龄20日龄昆明小鼠(SPF级)40只,体质量18 g±2 g;健康同龄60日龄昆明小鼠(SPF级)60只,体质量35 g±2 g,购自斯贝福(北京)生物技术有限公司。
致病性大肠杆菌(PEC),菌株编号:BNCC186732,血清型:O,由青岛大学生命科学学院微生物实验室保存。
本文所用酵母为商品啤酒酵母(),批号:20191208,购自青岛啤酒酵母有限公司。
1.2 方法
1.2.1 酵母甘露聚糖肽(MTY)制备 参照文献[9]的方法制备并进行含量测定,结果为MTY含量达40.04%。
1.2.2 试验分组 小鼠适应性饲喂7 d后,将40只体质量为(18±2)g SPF级昆明小鼠随机分为4组:空白组、模型组、阳性药物组、酵母甘露聚糖肽(MTY)组,每组10个重复,每个重复1只小鼠。对小鼠进行编号,置于洁净动物房中饲养,采取自由采食、饮水方式,连续喂养28 d。
1.2.3 菌种复苏 参照文献[10]方法,对致病性大肠杆菌(PEC)进行复苏。并将复苏后无杂菌的PEC接种液体培养基中,收集对数生长期的大肠杆菌,重悬于无菌的PBS中,进行后期注射试验。
1.2.4 灌胃样品 空白组、模型组灌胃生理盐水,用无菌生理盐水根据体质量按1 000 mg·(kg·d)剂量配制MTY溶液,按照体质量以100 mg·(kg·d)剂量配制阳性药物(阿莫西林),各组每次均灌胃0.2 mL,灌胃药现用现配。灌胃期间,均任其自由饮水、采食,并每天观察小鼠的健康状况。
1.3 小鼠体质量
试验开始后,每5 d称量1次小鼠体质量,记录体质量变化情况并绘制图表。
1.4 肠道微生物分析
在攻毒前一天取各组小鼠粪便置于灭菌的EP管中,每组取5只,并保存于-80 ℃冰箱,进行后续肠道微生物检测。具体检测方法参照文献[12],并利用I-Sanger平台(美吉生物,上海)进行分析。
1.5 PEC半数致死模型试验
小鼠适应性生长7 d后,将60只体质量为(35±2)g的试验鼠分组,按每组10只分为6组,设为6组不同浓度为LDPEC半数致死量组,期间均自由采食、饮水。将复苏后PEC用PBS稀释至所需浓度,设置6个浓度分别为4.13×10、4.09×10、4.02×10、3.98×10、3.82×10、3.78×10CFU·mL,0.2 mL·只,观察、记录注射PEC后小鼠状态及死亡情况。
1.6 半数致死量PEC对小鼠攻毒试验
对模型组、阳性药物组和MTY组小鼠进行PEC腹腔注射攻毒,每只注射半数致死量浓度的PEC溶液0.2 mL,观察小鼠的精神状态。用小鼠存活率来评价MTY对PEC感染的预防效果。
1.7 脏器指数测定
将小鼠处死后,取各器官组织,除去脂肪以及筋膜,在电子称上称重并记录质量,计算脏器指数。公式:
脏器指数(mg·g)=器官质量(mg)/活体质量(g)。
1.8 器官切片组织病理分析
1.8.1 空肠组织PAS染色 采血后,颈椎脱臼处死小鼠,剖开腹腔取空肠组织,用灭菌后的生理盐水冲洗干净,置于甲醛溶液固定24 h后,组织脱水、包埋、切片,石蜡切片脱蜡至水,进行空肠组织PAS染色。经染色后杯状细胞被染成紫红色,选取各组空肠组织切片,在200倍显微镜下,每张切片选取10个视野,分别计数后,并取平均数。
1.8.2 MUC2、ZO-1的免疫组化分析蛋白质表达量 将上述“1.8.1”的石蜡切片经过抗原修复、阻断内源性过氧化物酶、血清封闭、加一抗MUC2(厂家Servicebio,货号GB11344,稀释比1∶1 000)和一抗ZO-1(厂家Servicebio,货号GB111981,稀释比1∶400)、加二抗HRP标记山羊抗兔IgG(厂家Servicebio,货号GB23303,稀释比1∶200)、DAB显色、复染细胞核、脱水封片等处理,进行空肠组织MUC2、ZO-1免疫组化分析,利用统计软件Image J对免疫组化结果进行分析,通过测量总面积、阳性区域面积与阳性区域累计光密度值,并计算出平均光密度值来衡量蛋白表达量。
1.8.3 器官切片HE染色及组织病理分析 取处死后小鼠的空肠、脾、肺、肝,按“1.8.1”步骤制作石蜡切片,随后进行苏木精-伊红(HE)染色,镜检在200倍下挑选典型视野拍照,进一步对组织病理进行分析。
1.9 数据处理

2 结 果
2.1 小鼠状态及体质量
饲喂MTY未对小鼠体质产生明显影响,小鼠被毛顺滑,活动正常,与空白对照相比未见肉眼可见异常。灌胃期间小鼠表现出较好的状态,饮食、饮水、排泄均正常,并有增加小鼠体质量的趋势,但不显著(>0.05)。阳性药物组相比空白组和MTY组,体质量增长较慢,其他未见异常(表1)。
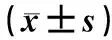
表1 MTY对小鼠平均体质量变化的影响Table 1 Effect of mannatide on the changes of average body weight in g
2.2 肠道微生物
2.2.1 各组微生物OTU 微生物OTU数由图1可知,3组中共有OTU数为413,空白组、阳性药物组、MTY组微生物特有的OTU数分别为79、57、71。
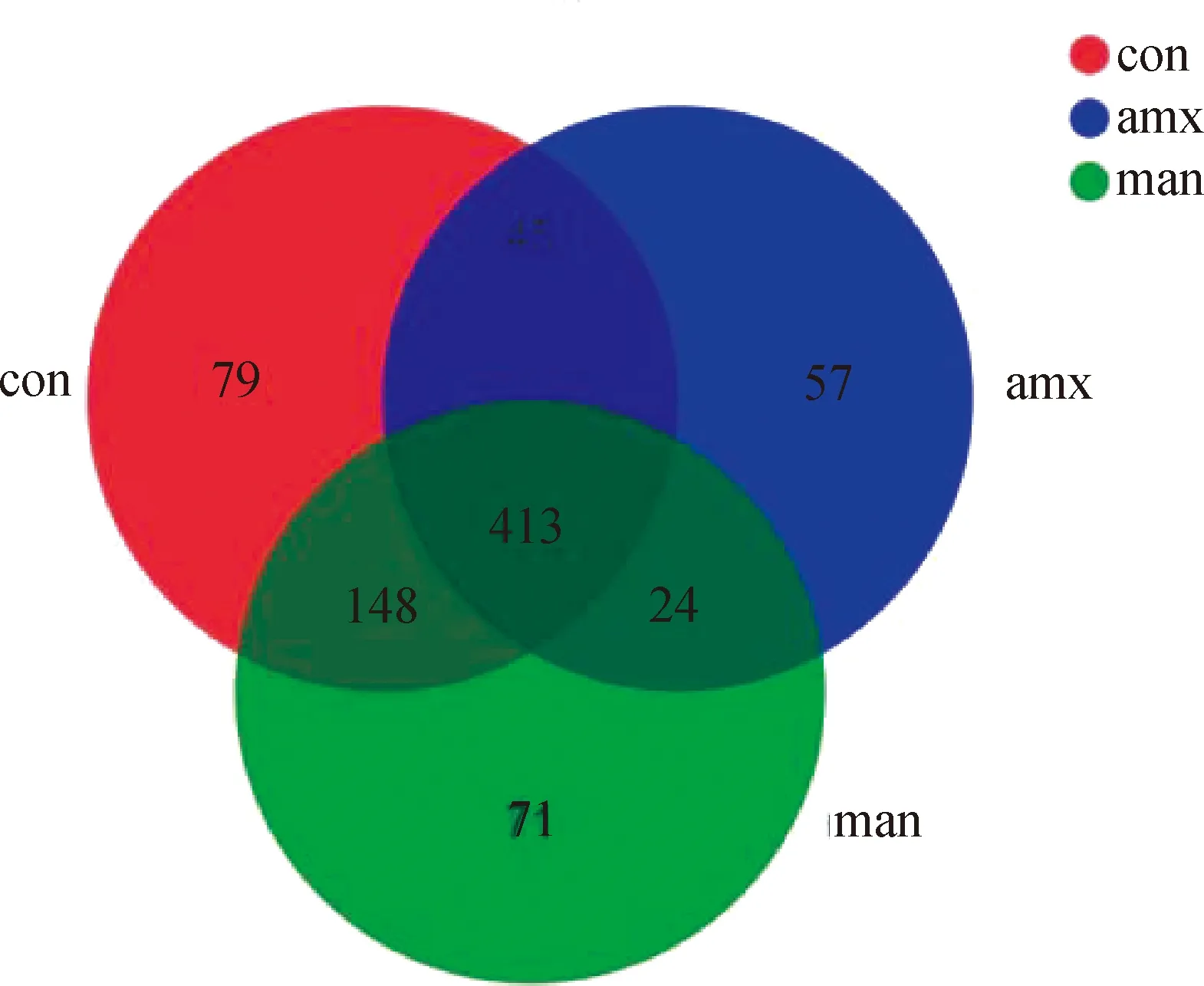
con. 空白组;amx. 阳性药物组;man. 酵母甘露聚糖肽组。下同Con. Blank group; amx. Positive drug group; man. Yeast mannatide group. The same as below图1 MTY对小鼠肠道微生物OTU的影响(韦恩图)Fig.1 Effects of MTY on intestinal microbe OTU in mice (Venn)
2.2.2 Beta多样性 Bate多样性分析可以评价肠道中物种复杂性方面的差异程度,距离越接近且聚集在一起的样品,表明物种组成结构越相似,通过主坐标分析(PCoA)生成二维散点图2显示,MTY组与空白组和阳性药物组之间距离较远,说明MTY组与空白组和阳性药物组菌群组成存在差异性。
(1)分隔土体。可采用土工膜等防渗隔水材料,或者非分散性黏土及改性分散性黏土,将低溶盐水和分散性黏土隔离开来。
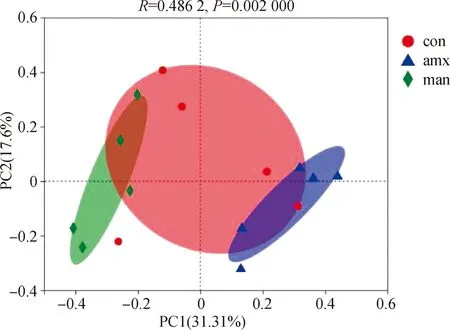
OTU水平上的主成分(PcoA)分析; PC1.主成分1; PC2. 主成分2Principal component (PCoA) analysis on OTU level; PC1. Principal component 1; PC2. Principal component 2图2 小鼠肠道内微生物主成分分析Fig.2 Microbe PcoA analysis in intestinal tract of mice
2.2.3 Alpha多样性分析 小鼠肠道微生物Alpha多样性见图3、4,Alpha多样性可以评价样品内的微生物群落的丰度和多样性,ACE指数和Chao指数反映群落丰富度,香农·威纳指数(Shannon)和辛普森指数(Simpson)反映菌群多样性。
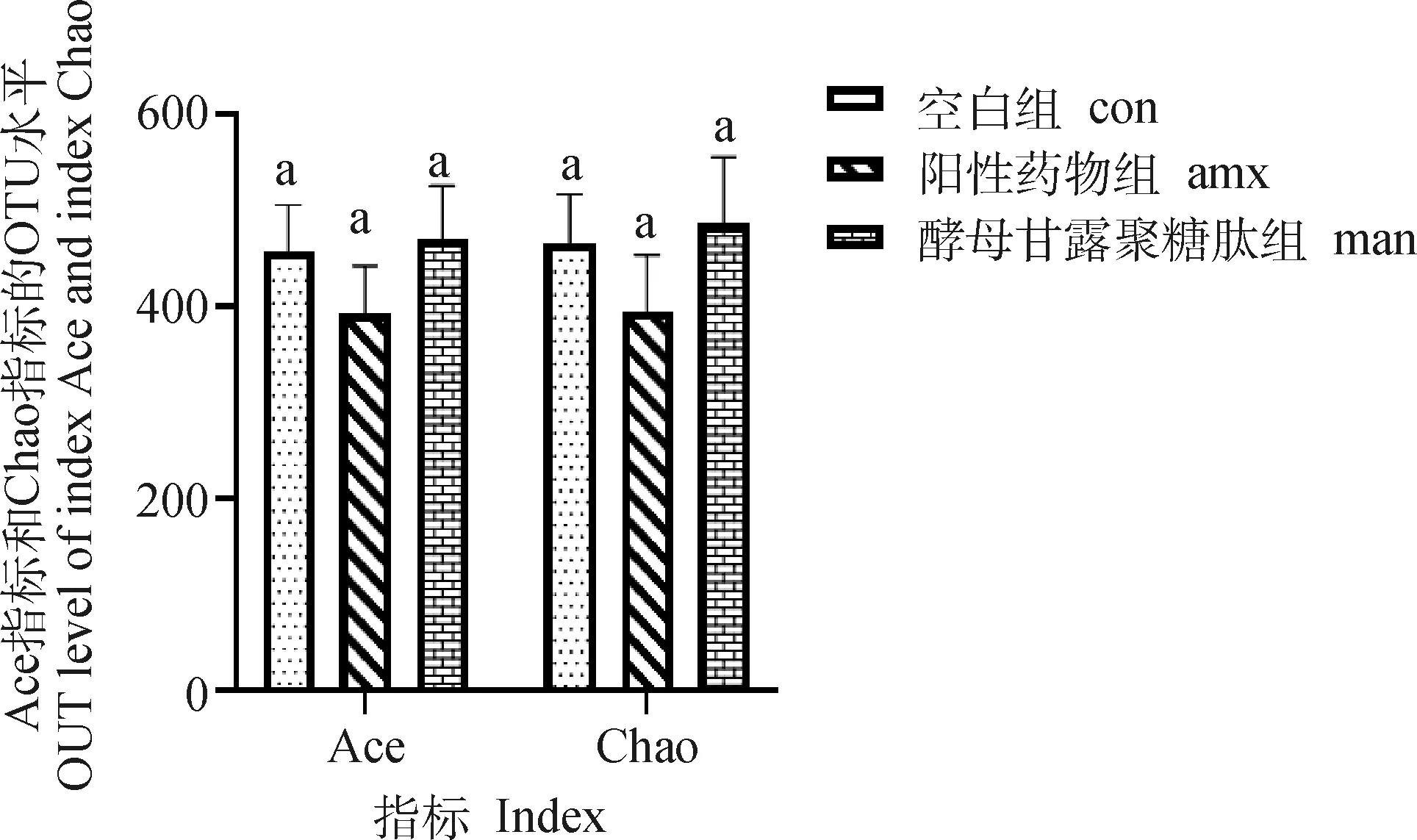
α 多样性分析结果;数据柱形标注无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下同Alpha diversity estimators. Value columns with no letter or the same letter superscripts mean no significant difference (P>0.05),while with different small letters mean significant difference (P<0.05).The same as below图3 MTY对肠道内微生物丰度的影响Fig.3 Effect of MTY on microbial abundance in intestinal tract
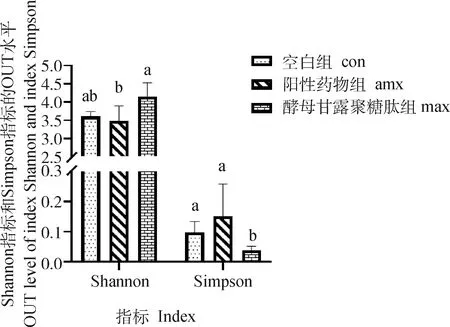
图4 MTY对肠道内微生物多样性的影响(α 多样性分析结果) Fig.4 Effects of MTY on intestinal microbial diversity (Alpha diversity estimators)
Alpha多样性结果显示,MTY组ACE指数和Chao指数均略高于空白组和阳性药物组,其中阳性药物组指数最低,但差异不显著(>0.05),说明MTY
组有增加菌群丰度的趋势。MTY组香农(Shannon)指数均高于阳性药物和空白组,并显著高于阳性药物组(<0.05);MTY组辛普森指数(Simpson)显著低于阳性药物组、空白组(<0.05)。结果表明,MTY组的物种的丰度及多样性均高于空白组与阳性药物组,其中MTY组多样性显著高于空白组与阳性药物组(<0.05)。
2.2.4 肠道菌群组成及其相对丰度 由图5、6可知,在门水平上,各组的优势菌群为拟杆菌门(Bacteroidota)和厚壁菌门(Firmicultes),其中阳性药物组拟杆菌门较空白组提高16.18%,厚壁菌门较空白组降低12.54%,而MTY组拟杆菌门较空白组降低10.29%,厚壁菌门提高7.48%。
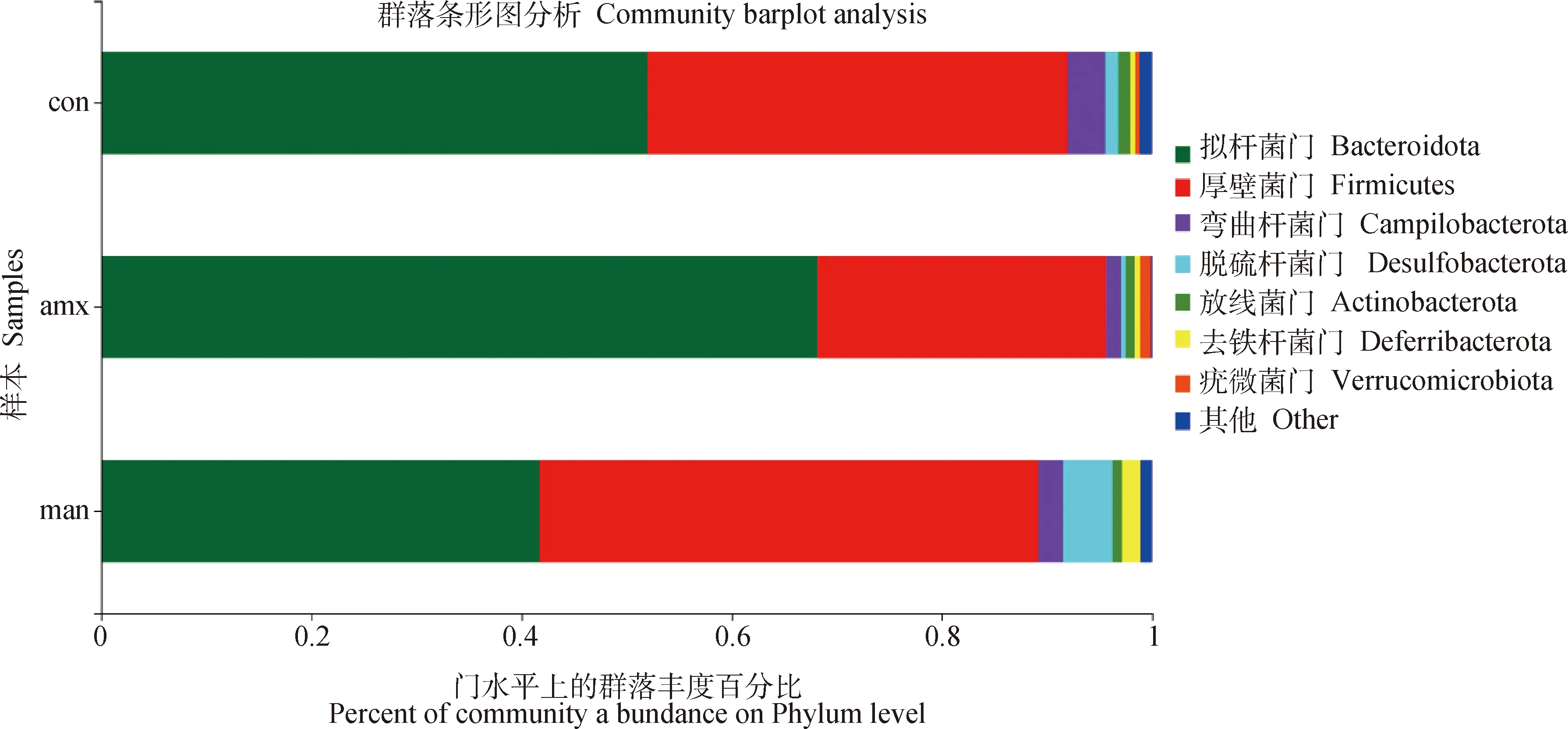
图5 门水平上的肠道菌群组成及相对丰度Fig.5 Composition and relative abundance of gut microflora on phylum level

图6 属水平上的肠道菌群组成及相对丰度Fig.6 Composition and relative abundance of gut microflora on genus level
在属水平上,除未命名属外,乳酸菌属、另枝菌属、臭味杆菌属、拟杆菌属、幽门螺旋杆菌属、拟普雷沃菌属丰度最高,其中,MTY组的另枝菌属(7.41%)、臭味杆菌属(6.71%)、拟普雷沃菌属(3.00%)和脱硫弧菌属(4.38%)等均较空白组、阳性药物组的菌群丰度有所提高。
为了探讨各组间菌群丰度的差异,采用kruskal-wallis轶和检验进行各组比较(图7、8)。在门水平上,脱硫杆菌门、髌骨细菌门有显著差异(<0.05),蓝细菌门有极显著差异(<0.01)。在属水平上,另枝菌属、拟杆菌属、脱硫弧菌属等有显著差异(<0.05),而臭味杆菌属、考拉杆菌属有极显著差异(<0.01)。
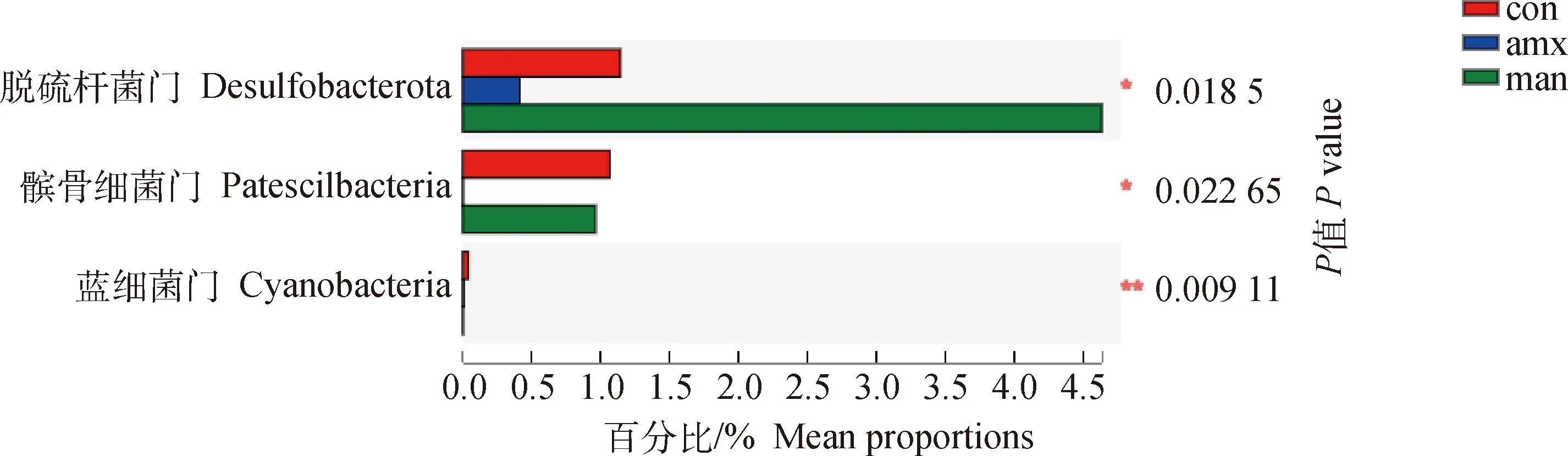
图7 不同组间门水平上Kruskal-Wallis H检验条形图Fig.7 Kruskal-Wallis H test bar plot on phylum level between different groups

图8 不同组间属水平上Kruskal-Wallis H检验条形图Fig.8 Kruskal-Wallis H test bar plot on genus level between different groups
2.3 PEC半数致死量模型试验
PEC半数致死模型试验结果见表2。攻毒8 h,小鼠被毛粗糙发黄,精神不振,不愿活动,多蜷缩在一起,眼角多有白色分泌物流出,少数小鼠紧闭双眼,多数小鼠肛门处附近沾有稀便。攻毒10 h,小鼠开始出现死亡,集中死亡出现在攻毒后24 h内,之后无死亡情况增加。通过SPSS 20.0软件采用线性回归方法,计算出PEC半数致死量为3.98×10CFU·mL。
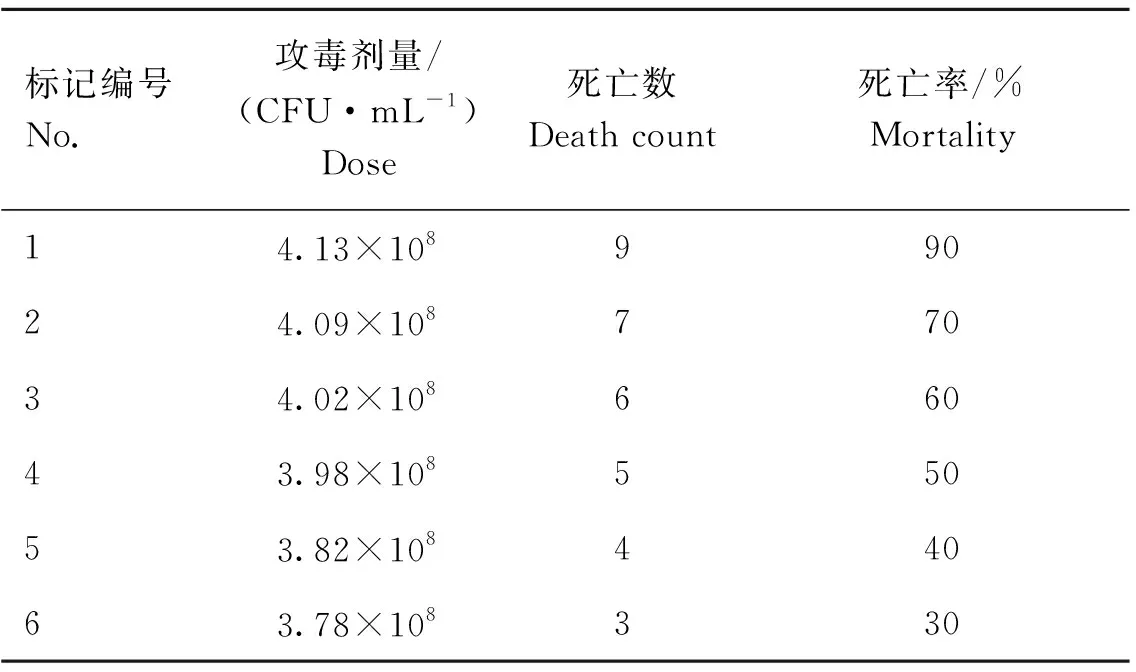
表2 小鼠人工感染PEC后LD50测定结果Table 2 LD50 assay result of PEC infected mouse
2.4 PEC半数致死量攻毒试验
本试验将灌胃28 d后的模型组、阳性药物组和MTY组小鼠进行PEC腹腔注射攻毒试验,每只小鼠攻毒0.2 mL,剂量为3.98×10CFU·mL,注射后观察24 h,之后进行解剖,取所需脏器进行后续试验。PEC半数致死量攻毒试验结果见表3。
由表3可见,空白组无死亡情况,模型组死亡最多(5只),阳性药物组死亡3只,MTY组死亡数(2只)低于模型组和阳性药物组,表明MTY对PEC有抑制作用。而且,MTY组在灌胃期间,小鼠体态与质量均呈现健康生长状态,说明MTY没有毒性,食用安全。

表3 PEC半数致死量攻毒试验结果Table 3 Result of PEC attack with LD50 dose
2.5 器官指数分析
如表4所示,被PEC感染后小鼠胸腺指数极显著降低(<0.01),但灌服MTY组小鼠胸腺指数显著高于模型组(<0.05)。被PEC感染后小鼠脾由于发生肿胀,出现脾指数显著升高(<0.05),而灌服MTY的小鼠脾指数较模型组降低。相比于空白组,PEC极显著的提高了小鼠的肝指数(<0.01),而MTY组的肝指数相比模型组发生极显著降低(<0.01)。说明酵母甘露聚糖肽对被攻毒PEC小鼠的免疫器官具有保护作用。
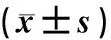
表4 MTY对PEC感染小鼠脏器指数的影响Table 4 Effects of MTY on organ indexes in mice infected with mg·g-1
2.6 器官切片组织病理分析
2.6.1 MTY抑制了PEC感染小鼠空肠杯状细胞的减少 本研究使用PAS染色研究MTY对空肠中杯状细胞的影响,结果表明(图9),致病性大肠杆菌能显著减少肠腔中杯状细胞数量(<0.05),阳性药物处理的小鼠杯状细胞也明显减少(<0.05),而经灌胃MTY的小鼠杯状细胞相比阳性药物组及模型组均有较大程度地增多,但不显著(>0.05)。因此,MTY可抑制PEC诱导的空肠杯状细胞的减少,起到保护空肠的作用。

A. 空肠PAS染色图片(200×);B. 小鼠空肠中杯状细胞的数量A. PAS staining of jejunum (200×); B. The number of goblet cells in mouse jejunum图9 MTY对攻毒后小鼠空肠中杯状细胞数量的影响Fig.9 Effect of MTY on goblet cells in jejunum of mice after PEC challenge
2.6.2 MTY抑制了PEC感染小鼠肠道中MUC2和ZO-1表达下调 通过免疫组化分析小鼠肠道组织中MUC2及紧密连接蛋白ZO-1的蛋白表达,PEC可显著降低小鼠肠道中MUC2及ZO-1的表达量,如图10A所示,MTY组空肠MUC2及ZO-1染色阳性区域(黄棕色)面积大于模型组,定量分析结果如图10B、C显示,MTY组空肠中MUC2及ZO-1表达量显著高于模型组(<0.05),说明MTY可以抑制PEC感染后小鼠肠道中的MUC2和ZO-1表达下调。

A. 空肠中MUC2和ZO-1表达量免疫组化染色图(200×);B. Image J对MUC2表达量半定量分析;C. Image J对ZO-1表达量半定量分析A. Immunohistochemical staining of MUC2 and ZO-1 expression levels in jejunum (200×); B. Image J semi-quantitative analysis of MUC2 expression; C. Image J semi-quantitative analysis of ZO-1 expression图10 MTY对攻毒后小鼠肠道中MUC2和ZO-1表达量的影响Fig.10 Effects of MTY on the expression of MUC2 and ZO-1 in intestinal tract of mice after PEC challenge
2.6.3 MTY对PEC感染后小鼠器官的保护作用 MTY对攻毒后小鼠各器官的影响结果见图11。

A. 空肠HE染色;B. 脾HE染色;C. 肺HE染色;D. 肝HE染色;a. 肠绒毛断裂;b. 肠绒毛排列混乱;c. 脾小动脉玻璃样变;d. 炎性坏死灶;e. 炎性细胞浸润,肺泡腔内充满红细胞;f. 肺泡壁增厚,肺泡腔内充满红细胞;g. 炎性细胞浸润;h. 部分肝组织坏死A. HE staining of jejunum; B. HE staining of spleen; C. HE staining of lung; D. HE staining of liver; a. Broken intestinal villi; b. Disordered intestinal villi; c. Hyaline lesion of splenic arteriole; d. Inflammatory necrotic lesion; e. Inflammatory cell infiltration, alveolar cavity filled with red blood cells; f. Alveolar wall thickening, alveolar cavity filled with red blood cells; g. Inflammatory cell infiltration; h. Partial liver tissue necrosis图11 MTY对攻毒后小鼠各器官的影响(200×)Fig.11 Effects of MTY on various organs of mice after PEC challenge (200×)
由图11A可见,MTY降低了PEC攻毒对小鼠小肠的影响,抑制了小肠绒毛断裂及隐窝萎缩。PEC感染后空肠内绒毛出现断裂,排列混乱;使用抗生素灌胃,经PEC感染后,小肠绒毛排列混乱,几乎不可见隐窝;而灌胃MTY后的小肠绒毛排列整齐,隐窝正常。
脾切片见图11B,可见空白组未见明显异常;模型组出现脾小动脉玻璃样变,脾小节淋巴细胞坏死,红白髓界限不清,红髓内中性粒细胞增多;阳性对照组有大小不一的炎性坏死灶,出现轻微脾小节淋巴细胞坏死;MTY灌胃组轻微脾小动脉玻璃样变,其他未见明显异常。
从肺组织切片图11C,可以观察到空白组未见明显异常,模型组出现肺泡壁增厚,炎性细胞浸润,肺泡腔充满红细胞;阳性对照组出现严重的肺泡壁增厚,肺泡壁毛细血管扩张,肺泡腔内充满红细胞,炎性细胞浸润;MTY组肺部未出现异常。
肝病理切片11D显示,空白组中央静脉周边肝细胞增厚,未有明显炎性浸润区和肝组织坏死部位;模型组肝组织部分有炎性细胞浸润,少数细胞胞质内有空泡;阳性对照组肝组织部分坏死,肝索基本消失;MTY组显示组织未见明显异常,肝索结构比较明显。
3 讨 论
甘露聚糖肽在消化道中消化酶的作用下被分解为低聚甘露糖和碱性多肽,而甘露聚糖通过相应酶催化被降解成甘露寡糖,进而经过产生的生物活性物质而发挥作用。甘露聚糖肽具有特殊的抗菌效果,可以与肠道病原菌发生凝集现象从而抑制微生物在肠道内的定植,并进一步抑制其生长,为有益菌提供营养促进有益菌的增殖。在对肠道微生物分析中,有研究表明,相同物种丰度的情况下,Simpson指数越低,Shannon指数越高,说明样品的物种多样性越高。本研究发现,酵母甘露聚糖肽组较空白组菌群组成有明显差异,多样性有显著性提高,菌群丰度有较大提高,其中,酵母甘露聚糖肽组中厚壁菌门较空白组有显著提高,而厚壁菌门中许多成员都是有益菌,如乳酸杆菌、瘤胃球菌等,这些有益菌的增多,在一定程度上竞争性抑制了有害菌的生长增殖。甘露聚糖肽可调节动物体的免疫机能,提高抵抗力,能最大程度地减少各类疾病和细菌病毒对动物产生的伤害。本研究对小鼠进行攻毒试验,灌胃酵母甘露聚糖肽的小鼠死亡率呈现下降趋势,表明酵母甘露聚糖肽对致病性大肠杆菌(PEC)有抑制作用。通过肝、脾、肺切片HE染色结果分析可见,酵母甘露聚糖肽可以改善炎症反应,使各器官保持在健康状态的作用。肠道是机体重要消化、吸收营养物质的器官,而肠绒毛和隐窝是小肠的重要组成部分。有研究表明,浒苔多糖可以保护肠绒毛及隐窝,改善空肠形态,促进肠道消化吸收功能。本研究中,PEC感染后破坏小肠绒毛及隐窝,而MTY可减轻PEC对小肠绒毛和隐窝的损坏,保护肠道健康。肠杯状细胞合成分泌黏蛋白,二者共同作用形成覆盖肠上皮表面的黏液层,并维持了肠上皮屏障的完整性。此外,Masuda等、Ikeda等发现杯状细胞还参与肠道损伤后的修复过程。有研究表明香菇多糖可以增加杯状细胞数量及肠道紧密连接蛋白的含量,提高肠屏障免疫力。PEC可破坏小肠中黏液层,本研究结果表明,MTY提高了注射PEC后黏蛋白MUC2的表达量及杯状细胞数量,因而在一定程度上保护肠道健康。ZO-1是肠上皮细胞中重要的紧密连接蛋白,PEC可破坏肠道紧密连接结构,改变ZO-1的分布;酵母甘露聚糖肽提高了被PEC感染后ZO-1的表达量,保护肠道紧密连接功能,进一步保护肠屏障功能。
抗生素的应用极大的提升了防疫水平,但是,抗生素在杀灭有害菌的同时也损害了一部分有益菌,在被致病性菌感染后,反而会加剧致病菌对机体的伤害,还导致一些耐药菌株的产生。寻找一种天然无公害的抗生素替代产品成为目前人们需要亟待解决问题。本研究结果表明,酵母甘露聚糖肽没有毒性,食用安全,具有代替抗生素的潜质,作为一种新型的饲料添加剂市场前景十分广阔。
4 结 论
酵母甘露聚糖肽可提高肠道菌群多样性及增加益生菌的数量,可抑制致病性大肠杆菌攻毒后小鼠肠道黏膜蛋白表达下调和杯状细胞减少,对肠道、肝、脾和肺等器官均具有显著的保护作用,从而提高了小鼠的生存率。
