ART3抑制剂3-MBA对小鼠睾丸生精功能的影响
2022-10-29段晨莹赵羚均许师源原开敏董智豪郭冠华
段晨莹,李 欣,赵羚均,许师源,原开敏,董智豪,3,郭冠华,4,王 栋*
(1.吉林农业大学动物科学技术学院,长春 130118;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.河南科技大学动物科技学院,洛阳 471203; 4.山西农业大学动物科学学院,太谷 030801)
睾丸和附睾是哺乳动物精子发生和成熟的主要场所,精子发生需经过精原干细胞增殖、减数分裂和精子变形等过程,变形后的精子离开睾丸进入附睾后,进一步发育成熟并逐渐获得运动能力。该过程正常、高效、有序运行,是确保精子功能正常的必要条件,需要精细而复杂的表达调控,期间的基因表达也就成为精子发生机制研究的重要内容,为此,很多研究通过精子基因组、转录组和蛋白质组挖掘雄性生育力的分子靶标。据统计,1头种公牛一次射精可产生数十亿精子,但精子功能基因组缺陷导致种公牛生精功能紊乱,生育能力变差,增加不孕风险,降低生产效率。为深入探究精子发生机制,深度挖掘种公畜的繁殖潜能,本团队前期对牛和小鼠精子变形期间差异基因进行富集分析和蛋白网络互作分析,发现了差异表达基因ADP-核糖基转移酶3(ADP-ribosyl transferase 3,3),该基因对精子变形发挥了重要的调控作用。
ART3是单-ADP-核糖基转移酶(mono(ADP-ribosyl) transferases,ARTs)家族成员,该家族以烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)为底物,将ADP-核糖基团转移至目标蛋白的氨基酸残基上,完成对目标蛋白的ADP-核糖基化修饰。研究发现,参与ADP-核糖基作用的主要氨基酸残基为精氨酸和半胱氨酸,然而,Friedrich等通过ART3蛋白结构分析和体外转染ART3酶活试验,发现ART3不具有ARTs家族特有的精氨酸特异性酶活性,也不具有半胱氨酸特异性酶活性,推测体外条件下ART3可能完全丧失了ADP-核糖基转移酶活性,但是,该研究没有深入挖掘该基因的生物学功能。研究发现,在人和牛精母细胞上可检测到ART3蛋白,也可在小鼠和牛精子变形期间检测到其表达,并且检测到3基因与人非阻塞性无精症(non-obstructive azoospermia,NOA)显著相关,是导致男性不育的重要因素。但是,目前尚未见到关于3基因参与调控精子发生机制的报道,也未见到该基因缺陷导致NOA和男性不育机制的报道,ART3的确切生物学功能还需深入研究。
为此,本试验以小鼠为模式动物,通过睾丸注射不同剂量ART3抑制剂3-甲氧基苯甲酰胺(3-methoxybenzamide,3-MBA),检测小鼠睾丸生理指标,分析附睾尾精子的动力学和形态学特征,探究ART3调控小鼠精子发生机制,为提高雄性动物繁殖性能提供理论依据,也为治疗雄性不育提供可治疗的分子靶点。
1 材料与方法
1.1 试验动物及饲养管理
试验动物为6~8周龄健康且繁殖性能正常的雄性ICR小鼠,购自北京维通利华实验动物技术有限公司。整个试验过程中,试验动物在20~25 ℃、自然光照条件下饲养,自由采食、饮水,每周更换1次垫料。试验鼠及试验方法均符合中国农业科学院北京畜牧兽医研究所动物实验福利伦理审查(No:IAS2019-13)要求。
1.2 主要试剂及药品配制
3-MBA、二甲基亚砜(DMSO)购自美国Sigma公司;戊巴比妥钠购自德国Merck公司;无水乙醇、75%医用酒精和二甲苯购自北京化学试剂公司;石蜡购自上海华灵康复器械厂;多聚甲醛购自天津市光复精细化工研究所;生理盐水购自北京萃锋科技有限公司;苏木素、苏木素分化液、苏木素返蓝液、伊红购自武汉赛维尔生物有限公司。
3-MBA溶液配制:参考Shi和Lodhi等的方法,用DMSO将3-MBA粉末配置为浓度为0.302、0.906和1.510 mg·mL的溶液,配置方法如下:电子天平称取0.302、0.906和1.510 mg的3-MBA粉末,分别溶解在1 mL DMSO中。
1.3 试验鼠注射ART3抑制剂
随机选取66只雄性小鼠,其中63只分为3组,每组21只,分别注射浓度为0.302、0.906和1.510 mg·mL的3-MBA,其余3只为对照组,注射DMSO溶液。在注射3-MBA前,以60 mg·kg体重剂量腹腔注射2%戊巴比妥钠,待小鼠完全处于麻醉状态后使其保持仰卧姿势,将睾丸从腹腔轻轻揉入阴囊后,用75%医用酒精对阴囊部位消毒,左手食指与拇指固定单侧睾丸,右手持连接1 mL注射器的无菌静脉输液针(内含3-MBA注射液),根据睾丸表面血管分布情况,避开睾丸白膜上的血管直接穿透阴囊进入睾丸,用力推注射器将3-MBA注射液缓慢注入睾丸,根据小鼠体重决定注射剂量,计算方法为3-MBA注射液体积等于小鼠体重(V=M,V为注射体积,单位μL;M为小鼠体重,单位g)。对侧睾丸同样处理后,处理鼠单笼饲养。对照组雄性ICR小鼠双侧睾丸分别注射与处理组等体积的DMSO溶液。
1.4 样本采集
于注射3-MBA溶液3 h、6 h、12 h、1 d、2 d、3 d、5 d后,脱颈处死试验鼠,用剪刀打开小鼠腹腔,从阴囊中取出小鼠双侧睾丸和附睾,将睾丸置于含4%多聚甲醛溶液的1.5 mL离心管中固定24~48 h;附睾置于含1 mL生理盐水的1.5 mL离心管中,并用眼科剪剪碎附睾尾组织。然后,将离心管置于37 ℃水浴锅恒温保存20 min,以使精子从附睾尾充分浮游至上清液。
1.5 睾丸组织HE染色
1.5.1 制作睾丸组织石蜡切片 将固定好的小鼠睾丸组织依次置于50%乙醇(1.5 h)、75%乙醇(1.5 h)、85%乙醇(1 h)、95%乙醇(1 h)、无水乙醇Ⅰ(30 min)、无水乙醇Ⅱ(30 min)的梯度酒精中脱水,然后依次采用二甲苯∶无水乙醇=1∶1的混合液(1 h)、二甲苯Ⅰ(1 h)、二甲苯Ⅱ(1 h)透明后,于溶解好的石蜡中浸泡3 h。包埋好后,经石蜡切片机切割成5 μm厚睾丸切片,将切片置于40 ℃左右温水中展片,再用黏附载玻片贴片后置于55 ℃恒温干燥箱中烤片5 h,使组织切片完全贴合在载玻片上。
1.5.2 HE染色 石蜡切片经二甲苯Ⅰ(30 min)、二甲苯Ⅱ(30 min)脱蜡后,依次置于二甲苯∶无水乙醇=1∶1的混合液、无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、85%乙醇、75%乙醇、50%乙醇中各复水5 min,再用蒸馏水洗5 min;然后用苏木素染色3 min、蒸馏水洗3 min、分化液分化10 s、蒸馏水洗2 min、返蓝液返蓝20 s、蒸馏水洗2 min、伊红染色8 min、蒸馏水洗5 min,睾丸石蜡切片经H&E染色后,依次经85%乙醇(1 min)、95%乙醇(1 min)、无水乙醇Ⅰ(5 min)、无水乙醇Ⅱ(5 min)的梯度酒精脱水,再经二甲苯Ⅰ(5 min)、二甲苯Ⅱ(5 min)透明;最后,用中性树脂封片,置于正置荧光显微镜下观察。
1.6 3-MBA处理鼠附睾尾精子的生理指标检测
1.6.1 附睾尾精子的精液质量分析 用移液枪从附睾上清液中吸取10份精子悬液(每份5~10 μL)分别滴至37 ℃预热的Leja板中,静置2 min,用HamiltonThorne IVOS II全自动精子分析仪分别在200×和400×镜下进行镜检。镜检时,随机选取Leja板中的8个不同区域进行分析。镜检后统计每份精液的浓度、前向运动精子百分率和活力,并计算出均值。
1.6.2 精子畸形率分析 用移液枪从附睾上清液中吸取10 μL精子悬液滴至黏附载玻片上,并用枪头涂抹均匀,涂片后用酒精擦拭过的盖玻片封片,并在室温下风干。然后,将制作好的切片置于100×油镜下检查精子形态,计数结构完整和畸形的精子,畸形精子主要类别有:胖头精子、圆头精子、双头精子、无头精子和尾部角弯折、卷曲、断裂、双尾精子等。每只小鼠检查1 000个精子,畸形率(%)=((1 000-正常精子)/1 000)×100。
1.7 数据分析
使用Excel和SPSS 20.0软件进行数据整理和统计分析,采用单因素ANOVA法进行方差分析,采用检验进行组间差异显著性检验,<0.05表示差异显著,<0.01表示差异极显著。
2 结 果
2.1 不同剂量3-MBA对小鼠睾丸生精细胞的影响
图1显示,小鼠睾丸注射不同剂量3-MBA后,0.302、0.906和1.510 mg·mL剂量组分别在注射后12 h、6 h和3 h曲细精管内观察到空泡,并随时间推移空泡逐渐增多增大,同时观察到曲细精管内生精细胞逐渐减少,排布变得散乱不规则。0.906 和1.510 mg·mL剂量组于注射后5 d空泡面积达到最大,且曲细精管出现空管现象,而0.302 mg·mL剂量组则于注射后3 d空泡面积达到最大,与注射后3 d相比,注射后5 d空泡面积减少,生精细胞数量增加,有恢复趋势。
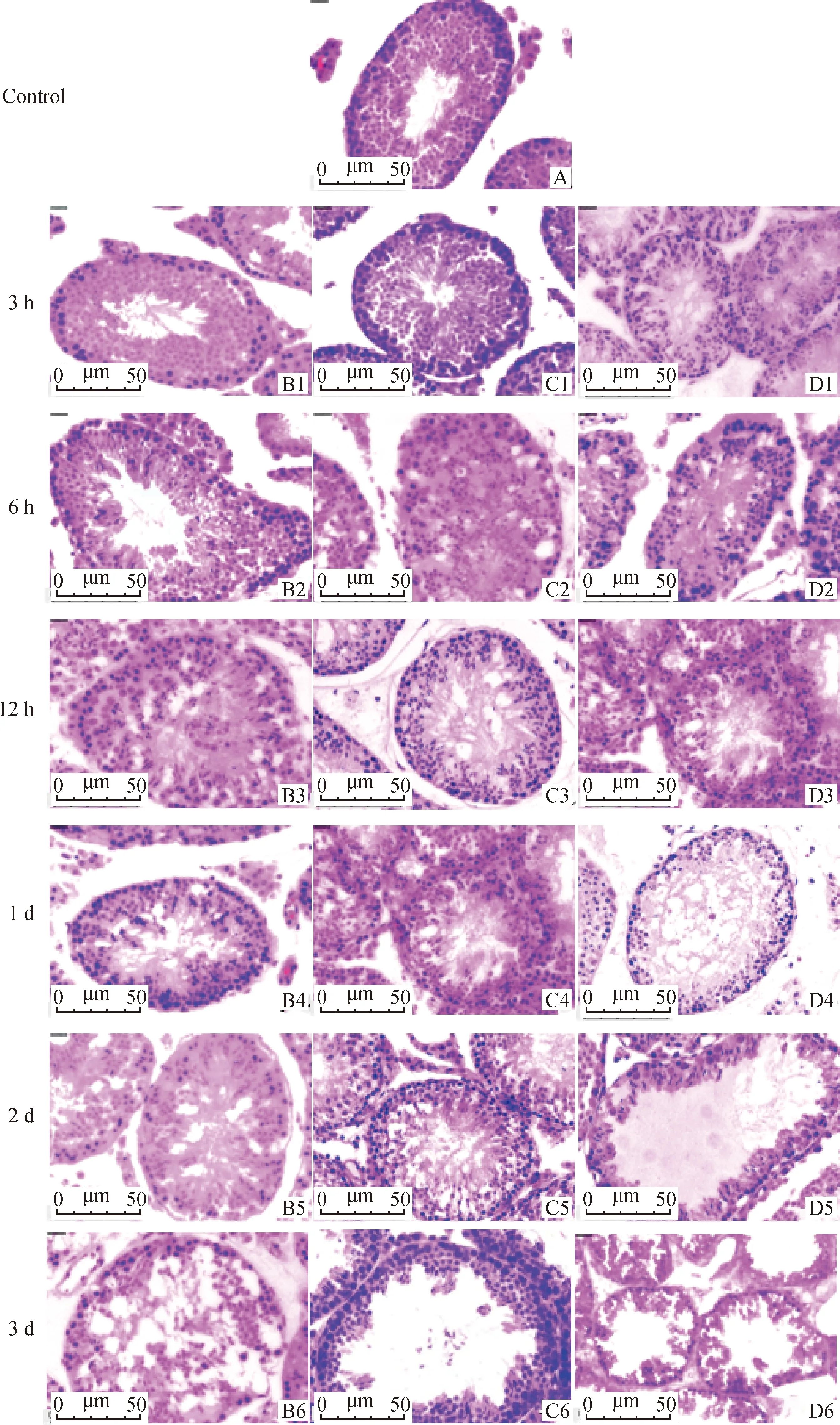

A.对照组小鼠睾丸切片;B1-B7分别为注射0.302 mg·mL-1 3-MBA后3 h、6 h、12 h、1 d、2 d、3 d和5 d切片;C1-C7分别为注射0.906 mg·mL-1 3-MBA后3 h、6 h、12 h、1 d、2 d、3 d和5 d切片;D1-D7分别为注射1.510 mg·mL-1 3-MBA后3 h、6 h、12 h、1 d、2 d、3 d和5 d切片A. Testicular section of control mice; B1-B7 are sections at 3 h, 6 h, 12 h, 1 d, 2 d, 3 d and 5 d after 0.302 mg·mL-1 3-MBA injection, respectively; C1-C7 are sections at 3 h, 6 h, 12 h, 1 d, 2 d, 3 d and 5 d after 0.906 mg·mL-1 3-MBA injection, respectively; D1-D7 are sections at 3 h, 6 h, 12 h, 1 d, 2 d, 3 d and 5 d after 1.510 mg·mL-1 3-MBA injection, respectively 图1 不同剂量3-MBA处理后小鼠睾丸切片HE染色结果(40×)Fig.1 HE staining results of testicular section of mice treated with different doses of 3-MBA(40×)
2.2 注射不同剂量3-MBA后附睾尾精子动力学分析
2.2.1 不同剂量3-MBA对精子密度的影响 表1显示,小鼠睾丸注射不同剂量3-MBA后,与对照组相比,0.302 mg·mL剂量组无显著差异(>0.05),而0.906和1.510 mg·mL剂量组附睾尾精子密度从注射后3 d开始极显著降低(<0.01),且呈剂量依赖性降低。

表1 注射不同剂量3-MBA后附睾尾的精子密度Table 1 The density of sperms in caudal epididymis after injection of different doses of 3-MBA 106·mL-1
2.2.2 不同剂量3-MBA对精子活力的影响 表2显示,小鼠睾丸注射不同剂量3-MBA后,与对照组相比,3个剂量组于注射后3、6和12 h附睾尾精子活力均无显著差异(>0.05),1.510 mg·mL剂量组从注射后1 d开始显著降低(<0.05),注射后2 d达到极显著水平(<0.01)。0.906 mg·mL剂量组从注射后2 d开始精子活力极显著降低(<0.01),且随时间推移进一步降低,而0.302 mg·mL剂量组精子活力于注射后5 d后才开始显著降低(<0.05)。

表2 注射不同剂量3-MBA后附睾尾精子活力Table 2 The motility of sperm in caudal epididymis after injection of different doses of 3-MBA %
2.2.3 不同剂量3-MBA对精子前向运动比例的影响 表3显示,小鼠睾丸注射不同剂量3-MBA后,与对照组相比,3个剂量组于注射后3、6和12 h附睾尾前向运动精子比例均无显著差异(>0.05),1.510 mg·mL剂量组于注射后1 d极显著降低(<0.01),0.906 mg·mL剂量组于注射后2 d开始显著降低(<0.05),第3天达到极显著水平(<0.01),且随时间推移进一步降低,而0.302 mg·mL剂量组于注射后3 d精子前向运动比例才开始极显著降低(<0.01)。

表3 注射不同剂量3-MBA后附睾尾精子前向运动比率Table 3 The progressive of sperms in caudal epididymis after injection of different doses of 3-MBA %
2.3 不同剂量3-MBA对附睾尾精子形态的影响
表4显示,小鼠睾丸注射不同剂量3-MBA后,与对照组相比,3个剂量组于注射后3 h、6 h、12 h和1 d附睾尾精子畸形率均无显著差异(>0.05),1.510和0.906 mg·mL剂量组均从注射后2 d开始精子畸形率显著增加(<0.05),第3天达到极显著水平(<0.01),而0.302 mg·mL剂量组则从注射后3 d才观察到精子畸形率极显著增加(<0.01)。与对照组小鼠相比,抑制ART3后,小鼠精子头部与颈部连接处断裂(图2C),精子尾部出现断裂(图2B)、弯折(图2D~F)和卷曲(图2G~H)等异常形态。

表4 注射不同剂量3-MBA后附睾尾精子畸形率Table 4 The malformation rate of sperms in caudal epididymis after injection of different doses of 3-MBA %

A.形态正常的精子。B~H.异常形态精子(红色箭头指向精子畸形处):B.精子尾部断裂;C.头部和颈部弯折;D~E.精子尾部弯折;F精子尾部成角弯折;G~H.精子尾部卷曲A. The normal morphology sperms. B-H. The abnormal morphology sperms (the red arrows point to the site of the sperm deformity): B. Break of the sperm tail; C. Bent of the sperm head and tail; D-E. Bent of the sperm tail; F. Angular bending of the sperm tail; G-H. Curl of the sperm tail图2 3-MBA处理后附睾尾精子畸形形态图片(100×)Fig.2 Image of abnormal morphology sperms in caudal epididymis after 3-MBA treatment(100×)
3 讨 论
ART3参与细胞代谢的多种途径,对肿瘤细胞增殖、分化、凋亡均具有重要意义,但ART3调控精子发生过程中细胞增殖、分化的研究还未见报道。研究表明,人和牛精母细胞均检测到ART3表达,推测其可能为信号传导重要分子节点,可确保精母细胞成熟和分裂有序发生,促进精母细胞向单倍体精细胞发育。本研究通过在小鼠睾丸注射3-MBA抑制ART3后,发现小鼠睾丸曲细精管内生精细胞明显减少,附睾尾精子浓度在注射3-MBA 后不同处理组均逐渐降低,到5 d后约降低0.358×10·mL~1.528×10·mL,降低的显著程度因抑制剂用量和处理时间而异。结果表明,抑制ART3导致小鼠睾丸精子发生过程受阻,降低了生精数量,损害了雄性生育力。研究发现,精子发生和肿瘤发生具有相似性,目前,已发现28B、2、等是在睾丸生殖细胞和癌症细胞特异性表达的肿瘤-睾丸(cancer-testis,CT)基因。研究发现,三阴性乳腺癌(triple-negative breast cancers,TNBCs)是基因显著表达的癌症之一,TNBCs细胞过表达3研究发现,过表达使细胞增殖更快,凋亡率更低,并发现ART3通过诱导Akt和ERK磷酸化促进了TNBC细胞增殖并抑制其凋亡。因此,推测3基因可能也像上述基因一样,是一种新型基因,其在睾丸生殖细胞和TNBCs细胞中的表达模式可能具有一定相似性。未来的研究将继续通过在小鼠睾丸抑制ART3,探讨ART3是否通过诱导Akt和ERK磷酸化,进而调控生精细胞增殖分化,以深入阐明ART3在小鼠精子发生过程中的分子机制。
精子发生是以支持细胞(sertoli cells,SCs)与生殖细胞相互协调为前提的,SCs与生殖细胞相互作用,为精子发生提供形态学和营养支持,SCs还通过内分泌、旁分泌和自分泌释放各种细胞因子,以维持精子发生所需的微环境稳态,确保精子发生正常高效。一旦SCs功能障碍,将直接导致精子发生失败。据报道,无精子症患者中支持细胞综合征(sertoli cell-only syndrome,SCOS)患病率高达26.3%~57.8%。本研究发现,抑制3后小鼠睾丸曲细精管内出现空泡化,且随剂量增加和时间的推移,空泡面积也随之增大,生精细胞排布紊乱。作为一种GPI锚定膜蛋白,ART3可能与SCs产生的各种分泌因子及细胞连接蛋白相互作用,参与并维持了SCs和生殖细胞之间的相互支撑和相互调节关系。抑制3后,可能导致SCs和生精细胞间的连接变得松散,SCs对生精细胞的支撑、营养、调控作用受损,使精子发生受阻,影响了精子发生的进程,并导致精子发生不完全不充分。
精子结构和功能的完整性可直接影响精子成熟、活力、获能等,是动物成功受精的先决条件,是提升家畜精液品质需要研究和解决的重要瓶颈之一。本研究中,注射3-MBA后小鼠精子活力和前向运动精子比例这两个运动参数均逐渐降低,虽然因注射剂量不同下降程度有所差异,但都逐渐达到了显著水平,尤其是注射5 d后,精子活力显著降低了5.93%~26.33%;前向运动精子减少了7.39%~22.68%。结果表明,注射3-MBA抑制了ART3蛋白的生理功能,可能损害了睾丸精子结构的完整性,进而影响到精子活力和前向运动等功能。已有研究表明,附睾尾精子活力降低是雄性生育能力下降的关键因素。另外,精子尾部结构的完整性和功能性是精子活力的重要影响因素,也是精子能够成功抵达受精地点,确保精卵结合和融合的前提条件,若精子尾部形成相关基因表达缺陷或蛋白结构和功能缺陷,就可能导致少精子症和畸形精子症,最终导致受精失败或生育能力丧失。本团队前期研究发现,ART3定位于牛和小鼠圆形、长形精细胞,且呈趋向于精子尾部形成方向的极性分布特点,ART3还定位于牛和小鼠附睾尾精子的头部以及尾部靠近头部部分,推测ART3可能与精子头和尾部形成有关。本研究发现,睾丸注射3-MBA后,小鼠精子畸形率逐渐增加,5 d后达到显著水平,比注射前增加约10.2%~26.9%,精子尾部主要表现为断裂、弯折和卷曲等,头颈出现对折,说明ART3与精子尾部、颈部形成有关,并通过影响精子形态结构,进一步影响了精子的活力、精卵结合等功能。
综上所述,本研究推测,精子发生是在SCs构成的稳态微环境下有序进行的,ART3作为一个膜锚定蛋白,可能在维持SCs与生精细胞的关系中发挥了重要作用,也可能促进了精子发生过程中系列生精细胞的有序迁移,并且,ART3还可能促进了曲细精管中进行性变化的系列生精细胞的结构完善和功能发挥。总而言之,该基因的正常表达是精子发生正常有序进行的前提基础。
4 结 论
本研究通过抑制ART3导致附睾尾精子尾部形成发生缺陷,精子畸形率增加,结构异常,进一步影响了精子运动能力、活力等功能,说明ART3通过参与调控精子发生影响精子的结构和功能,降低精子数量和质量,并导致精子发生紊乱。然而其调控精子发生的详细机制还需进一步研究确认。相关研究将对提高动物精液品质具有重要意义,也可为治疗雄性不育提供新的靶向基因。
