miR-138靶向PGC-1α调控牦牛肌内前体脂肪细胞增殖及分化
2022-10-29冉宏标柴志欣王嘉博钟金城
冉宏标,王 会 *,柴志欣,王嘉博,张 明,蔡 欣,钟金城*
(1.西南民族大学 青藏高原动物遗传资源保护与利用四川省/教育部重点实验室,成都 610041;2.西南民族大学青藏高原研究院,成都 610041)
牦牛()是我国青藏高原地区重要的牛种,具备抗逆性强、耐低氧和高压、抗强紫外线特点等。牦牛肉极低的肌内脂肪含量严重影响牦牛肉口感、嫩度、肉色及风味,制约了牦牛肉产业的发展。肌内脂肪沉积的影响因素有品种、年龄、营养、管理等,研究表明其遗传力为0.36~0.54,属于中高遗传力性状;且营养与管理等因素也是通过调控基因表达及蛋白修饰等方式影响肌内脂肪含量。因此,阐明牦牛肌内脂肪沉积的调控机制对于牦牛优良品种选育和牦牛肉品质改善及牦牛产业健康发展具有重要的社会经济意义。
miR-138作为一种肿瘤抑制因子,在疾病的发生与干预过程中得到了广泛研究。研究表明,miR-138表达水平在肥胖患者结肠和血清中都呈显著下调,对肥胖及正常孕妇羊膜间充质干细胞进行测序分析发现,miR-138-5p在肥胖孕妇羊膜间充质干细胞中的表达显著高于正常孕妇,通过生物信息学分析发现,miR-138靶基因的KEGG pathway富集于脂肪细胞分化、脂肪沉积和脂肪代谢等通路。miR-138在人脂肪间充质干细胞(hAD-MSCs)成脂分化过程中被显著下调,当miR-138过表达时可靶向负调控E1A样分化抑制因子1(-1)的表达,从而抑制hAD-MSCs成脂分化,减少脂滴沉积。这些研究表明,miR-138在动物脂肪生成过程中具有重要的调控作用。且在黄牛上的研究结果表明,不同品种间肌内脂肪差异表达基因也存在较大差异,提示不同品种对肌内脂肪代谢调控存在特异性。因此,研究miR-138对牦牛肌内前体脂肪细胞脂质沉积的影响对揭示牦牛肉低肌内脂肪含量形成的机制具有重要意义。
本研究旨在利用过表达和干扰技术探究miR-138对牦牛肌内前体脂肪细胞增殖、分化及脂质沉积的影响;利用生物信息学分析预测miR-138在牦牛脂肪生成过程中的潜在靶基因,初步筛选miR-138在脂质沉积中的下游调控靶基因并进行验证,为阐明miR-138在牦牛肌内脂肪沉积过程中的遗传调控机制、构建相关的调控网络奠定基础和提供数据支持。
1 材料与方法
1.1 试验材料
DMEM/F12(1∶1)基础培养基购自Hyclone公司;HBSS缓冲液购自Gibco公司;0.25%胰蛋白酶和青霉素/链霉素(双抗)购自博士德(北京)公司;I型胶原酶、II型胶原酶、油红O染料和油酸试剂均购自Sigma公司;4%多聚甲醛购自Biosharp生物科技公司;DEPC水、PBS溶液、胎牛血清和Lipofectamine3000购自赛默飞(Thermo Fisher Scientific)公司;反转录及定量PCR试剂盒购自TaKaRa公司;PI试剂购自索莱宝科技公司;CCK-8试剂盒和TRIzol试剂购自天根生物;miR-138 mimics、inhibitor及引物均由擎科生物公司合成。
1.2 主要仪器
倒置光学显微镜购自蔡司(Zeiss)公司;水浴锅(HWS-240);多功能酶标仪(Thermo Fisher Scientific Varioskan LUX);荧光定量PCR仪(Thermo Fisher Scientific QuantStudio 3.0);流式细胞仪(SYSMEX CyFlow Cube 8)。
1.3 试剂配制
称取0.1 g油红O染色液溶于100 mL异丙醇制成油红O染色原液,于4 ℃冰箱避光保存,染色前按(原液)∶(灭菌水)=3∶2配制并过滤;称取0.1 g Ⅰ型胶原酶和0.1 g Ⅱ型胶原酶分别溶于100 mL HBSS缓冲溶液,过0.22 μm除菌过滤器后,按(0.1% Ⅰ型胶原酶)∶(0.1% Ⅱ型胶原酶)=2∶1比例配制组织消化液;完全培养基(10%血清+1% 双抗的DMEM/F12基础培养基);诱导分化培养基(10% 血清+1% 双抗+50 μmol·L油酸的DMEM/F12基础培养基)。
1.4 试验方法
1.4.1 牦牛前体脂肪细胞分离 于都江堰(成都)辉润屠宰场采集新鲜屠宰的,年龄约2岁的健康麦洼牦牛的背最长肌,使用含3%双抗冰PBS缓冲液清洗样本数次至无血渍,转移至含3%双抗基础培养基中于冰上带回实验室,使用含2%双抗的PBS缓冲液清洗采回的组织样本,在PBS湿润环境下使用无菌剪刀剔除肉眼可见筋膜、血管,将剩余组织剪碎至1 mm大小肉糜;按(组织)∶(消化液)约为2∶1加入消化液,于37 ℃水浴消化4 h,期间每5 min混匀1次;消化结束后依次过70 μm和40 μm细胞筛,取滤液2 000 r·min离心5 min,使用无血清DMEM/F12基础培养基重悬沉淀,并依次1 800、1 500 r·min梯度离心5 min,沉淀加入完全培养基重悬后转移至培养皿,37 ℃恒温培养箱(50 mL·LCO)贴壁1.5 h后更换新鲜培养基,之后每2 d更换培养基培养至传代及冻存。
1.4.2 Mimics、inhibitor设计合成及转染浓度筛选 参照bta-miR-138成熟序列(MIMAT 0003813)设计mimics和inhibitor,交由擎科(北京)生物公司合成。设置30、50、100和150 nmol·L共4个浓度,待肌内前体脂肪细胞培养至第三代(F3)开始转染。细胞按参考接种量接种至12孔板,设置mimics、mimics NC、inhibitor、inhibitor NC 组,每组3个重复,待细胞密度达80%~90%时参照Lipofectamine3000说明书进行mimics、mimics NC、inhibitor、inhibitor NC转染。37 ℃恒温培养箱转染6 h后更换诱导培养基诱导分化48 h,收集细胞并提取总RNA用于测定miR-138表达情况,筛选转染效率最优浓度用于后续试验。
1.4.3 MiR-138靶基因预测及功能分析 利用在线预测网站TargetScan7.2(http://www.targetscan.org/vert_72/)、miRWalk(http://mirwalk.umm.uni-heidelberg.de/)和miRDB(http://www.mirdb.org/)对bta-miR-138靶基因进行预测,并对预测结果取交集;利用DAVID数据库(https://david.ncifcrf.gov/)对预测靶基因进行KEGG和GO富集分析,筛选脂质代谢过程相关的潜在靶基因。
1.4.4 总RNA提取及cDNA合成 按TRIzol法提取细胞总RNA,具体方法参照说明书。miR-138 定量用cDNA合成参照PrimerScriptRT reagent kit with gDNA Eraser说明书(TaKaRa RR047A)进行,miR-138反转录引物为5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGT-TGAGCGGCCTGA-3′;内参6引物参照前人研究。
1.4.5 实时荧光定量(qPCR) 使用TB GreenPremix EX TaqII试剂盒(TaKaRa RR820A)进行qPCR试验,定量引物序列信息见表1。反应体系为95 ℃预变性30 s;95 ℃变性10 s,60 ℃(引物退火温度详见表1)退火30 s,共40个循环。分别以6和作为miR-138及目的mRNA内参,采用2法计算相对表达量。

表1 qPCR引物信息Table 1 qPCR primer information
1.4.6 油红O染色 细胞诱导分化后进行油红O染色测定细胞脂滴积累情况:吸去培养基后使用PBS轻柔冲洗细胞,每孔加入500 μL 4%多聚甲醛,室温固定1 h;使用无菌ddHO轻柔冲洗细胞3次,加入油红O染液室温染色30 min;无菌ddHO冲洗细胞5次,每次1 min,至无明显红色背景,镜检拍照。转染后细胞参照正常细胞诱导分化时间点和染色步骤进行油红O染色,用于检测miR-138对细胞脂质沉积的影响。镜检完成后每孔加入200 μL异丙醇萃取细胞中油红O染色液,于510 nm波长下测定萃取液OD值。
1.4.7 细胞增殖活性测定 转染后细胞接种至96孔板,加入新鲜完全培养基培养分别在12、24、36和48 h后进行CCK-8测定:向每孔中加入10 μL CCK-8试剂,37 ℃培养箱孵育1 h,恢复室温后于480 nm波长下测定OD值。划痕试验待细胞密度达80%~90%时进行:使用无菌枪头沿贴壁细胞中轴匀速划出划痕,分别培养12、24和36 h后观察细胞增殖情况并拍照。
1.4.8 流式细胞周期检测 细胞培养至12孔板,待细胞密度达80%~90%时进行转染;48 h后使用胰蛋白酶消化收集细胞,PBS清洗细胞沉淀并加入70%乙醇于4 ℃过夜固定细胞;加入浓度为100 μg·mL的PI染料室温避光孵育30 min后上机检测。
1.4.9 双荧光素酶报告试验 根据TargetScan7.2数据库预测结合位点,参考-1序列设计3′ UTR扩增引物(F:5′-AACCATTCTTTTCCTTTCTC-3′,R:5′-ATACCTGCATTTAACCTACA-3′),用于扩增包含结合位点3′ UTR序列,连接pmD-19T载体后转化感受态细胞,扩大培养并测序验证。设计突变引物Fm:5′-GCATTCATTTATAGCATATTGTGTTC-AGAGTGAATCCACTGTCTGTCCTGTCGG-3′;Rm:5′-AACACAATATGCTATAAATGA-ATGCAGCTTTCAAAATTAGCTGCATTGGCC-3′(粗体为突变位点)。采用overlap PCR完成结合位点突变,回收片段并转化感受态细胞,扩大培养并提取质粒用于测序验证。使用I和II双酶切构建野生型表达载体(-1-Wt-PGL3-basic)和突变型表达载体(-1-Mut-PGL3-basic)。利用Lipofectamine3000将miR-138 mimics或mimics NC与双荧光素酶表达载体分别共转入牦牛前体脂肪细胞,转染48 h后参照双荧光素酶检测试剂盒(Promega E1910)说明书测定相对荧光强度。
1.4.10 数据分析 数据均用“Mean±SD”表示,试验结果使用SPSS 25.0软件进行统计学分析,两组样本采用独立样本检验,多组间比较采用单因素方差分析(One-way ANOVA),利用Duncan’s 法进行多重比较,使用GraphPad Prism 8完成数据可视化作图。
2 结 果
2.1 牦牛肌内前体脂肪细胞分离鉴定
原代肌内前体脂肪细胞分离后贴壁1.5 h可观察到前体脂肪细胞呈梭型贴壁生长;培养24 h后细胞数量增多,形态呈梭形或椭圆形;72 h细胞开始融合;培养至第8天,细胞密度达到90%左右,呈梭形、螺旋状排列,此时开始传代培养。对F3代细胞诱导分化鉴定,油红O染色结果显示,诱导分化第8天时,细胞质出现大量脂滴积累,形成较大脂滴(图1)。获得细胞与实验室前期分离鉴定获得的肌内前体脂肪细胞特征相符,表明成功获得具有分化潜能的牦牛背最长肌肌内前体脂肪细胞。

A. 培养1.5 h,箭头所示为梭形贴壁细胞(100×);B. 分离培养72 h,细胞开始融合(100×);C. 诱导分化第8天油红O染色(100×);D. 诱导第8天脂滴形成情况(400×)A. Cell culture for 1.5 h, the arrowheads indicates fusiform adherent cell (100×); B. Cell culture for 72 h, cells begin to fusion (100×); C. The Oil red O staining after induced differentiation for 8 days (100×); D. Lipid droplet formation after induced 8 days (400×)图1 前体脂肪细胞分离鉴定Fig.1 Preadipocyte isolation and identification
2.2 miR-138 mimics及inhibitor转染效率
利用RT-qPCR技术分别测定4个不同转染浓度下miR-138相对表达情况,结果显示(图2),相较NC组,细胞转染miR-138 mimics后miR-138表达量极显著上调(<0.01),转染miR-138 inhibitor后miR-138表达水平极显著下调(<0.01),且mimics和inhibitor转染浓度为100 nmol·L时过表达及干扰效率分别为570%和63%,因此选择100 nmol·L作为后续试验转染浓度。

A. miR-138 mimics 转染结果;B. miR-138 inhibitor 转染结果。*表示P <0.05,**表示P <0.01,下同A. Transfection result of miR-138 mimics; A. Transfection result of miR-138 inhibitor. *indicate P <0.05, **indicate P <0.01, the same as below图2 转染浓度筛选Fig.2 Transfection concentration screening
2.3 miR-138抑制前体脂肪细胞脂质沉积
F3代牦牛肌内前体脂肪细胞进行mimics和inhibitor转染后,诱导分化至第8天,油红O染色检测脂肪细胞脂质沉积情况,结果如图3所示,过表达miR-138后,细胞内脂滴累积显著降低,而抑制miR-138后,细胞脂滴积累显著增多;油红O染液吸光值与染色结果一致(图3A),表明过表达miR-138可抑制牦牛肌内前体脂肪细胞脂质沉积,抑制miR-138可促进细胞脂质沉积。

A. 油红O染色结果(100×); B. 脂肪分化标志基因表达水平A. Oil red O staining result (100×); B. The expression level of adipose differentiation marker genes图3 miR-138对脂肪细胞分化的影响Fig.3 Effects of miR-138 on adipocyte differentiation
利用qPCR测定miR-138过表达及干扰后脂肪细胞分化标志基因和表达水平(图3B),结果表明,过表达miR-138显著降低了和的表达(<0.01),干扰miR-138表达可显著上调和的表达(<0.05),表明miR-138可能通过抑制肌内前体脂肪细胞分化水平,从而减少胞内脂滴积累。
2.4 miR-138对前体脂肪细胞增殖活性的影响
转染后细胞接种至96孔板,12 h后细胞密度可恢复至80%~90%,此时开始划痕试验。结果显示,与mimics NC相比,过表达miR-138后36 h后细胞仍存在明显空隙,而NC组转染36 h后细胞空隙完全消失;抑制miR-138组细胞同样在36 h时空隙完全消失,而对照组划痕恢复速度明显低于inhibitor组细胞(图4A)。CCK-8检测结果(图4B)表明,转染miR-138 mimics 24 h后细胞活性显著低于NC组(<0.01),并在36 h极显著低于NC组;与inhibitor NC相比,转染miR-138 inhibitor后细胞增殖活力表现为相反趋势;该结果与划痕试验结果相符,表明过表达miR-138可显著降低牦牛前体脂肪细胞增殖活性,抑制miR-138表达则可增强细胞增殖活性。
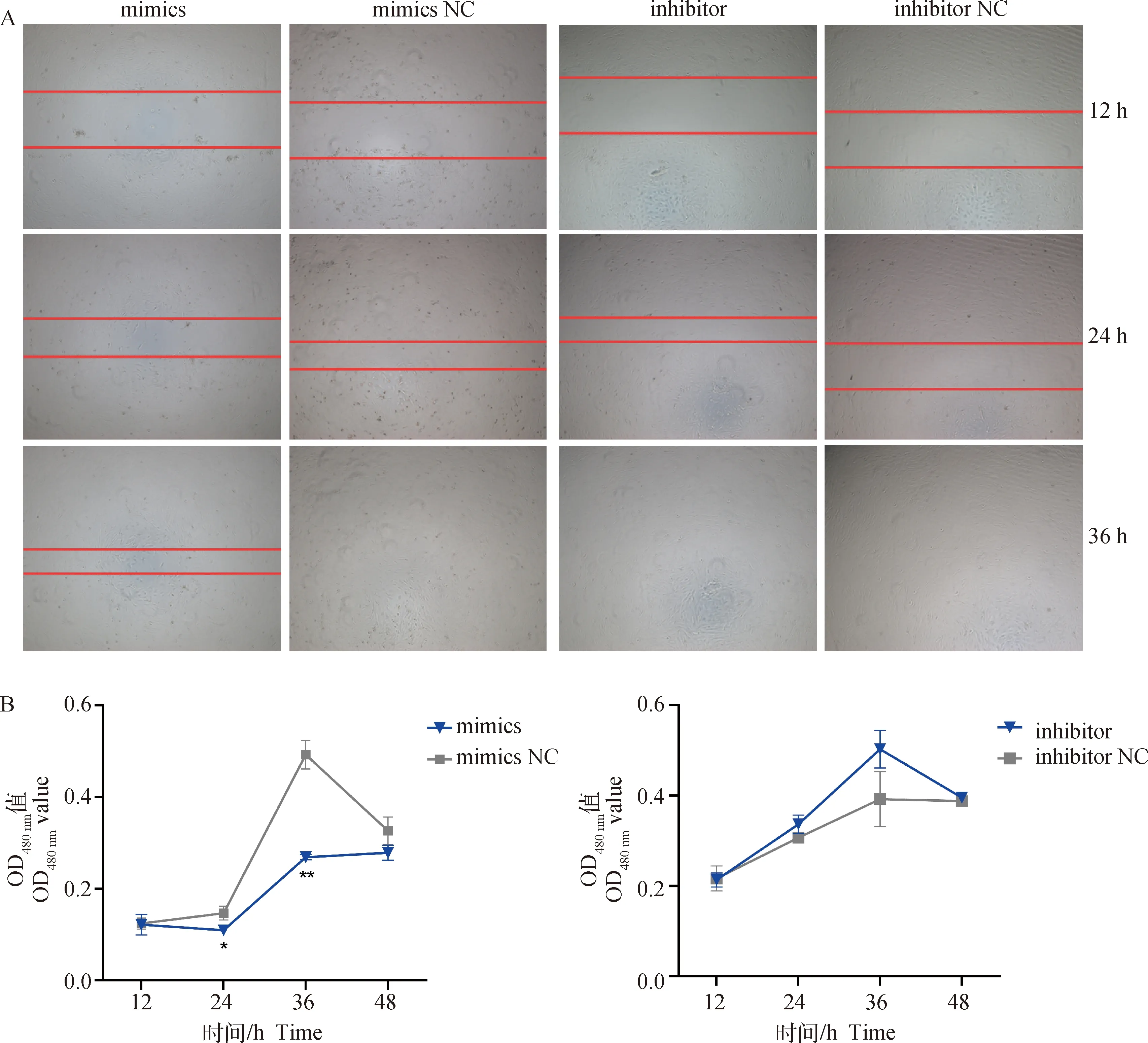
A. 划痕试验结果(50×);B. CCK-8检测结果A. Scratch test results (50×); B. CCK-8 test results图4 miR-138对脂肪细胞增殖活性的影响Fig.4 Effects of miR-138 on adipocyte proliferation
进一步通过流式检测分析细胞周期变化情况,结果(图5A)显示,与对照组相比,过表达miR-138后细胞主要停滞在G0期;抑制miR-138后G1期细胞数量显著减少,而G2-M期细胞明显增多。结果表明miR-138可能通过阻滞细胞由G1向S期的进程影响细胞增殖。通过RT-qPCR分析细胞增殖相关基因的mRNA表达变化(图5),结果表明,过表达miR-138后细胞周期相关基因1、1和增殖标记基因67 mRNA表达受到显著抑制,而抑制miR-138则增强了上述基因的表达,且67和1表达量显著上升(<005)。结果表明,过表达miR-138可通过影响细胞周期相关基因1和1以及增殖标志基因67的表达,阻滞细胞G1-S进程,抑制细胞增殖。

A. 流式周期分析;B. 增殖标志基因表达变化A. Flow analysis; B. Expression level of proliferation marker genes图5 miR-138对细胞周期的影响Fig.5 Effects of miR-138 on cell cycle
2.5 miR-138靶基因预测与功能分析
利用TargetScan、miRWalk和miRDB数据库分别预测到672、14 020和657个潜在靶基因,其中263个靶基因为共有靶基因(图6A),包括-1、1、1、11等与脂肪代谢相关基因。对潜在靶基因进行KEGG和GO富集分析,GO结果(图6C)显示主要富集在RNA聚合酶II启动子对转录的正/负调控、I型肺细胞分化、蛋白酶体介导的泛素依赖蛋白分解代谢过程、Wnt信号通路和磷脂酰肌醇磷酸化等生物学过程(BP);核染色质、胞质mRNA处理体、细胞核等细胞定位(CC)过程;染色质DNA结合、RNA聚合酶II启动子核心区特异性DNA结合和锌离子结合等分子功能(MF)过程。KEGG通路富集分析结果(图6B)显示,相关靶基因参与轴突导引、胰岛素抵抗、RNA降解和胰岛素分泌等通路。由于胰岛素抵抗与脂肪酸代谢过程密切相关,故从胰岛素相关通路筛选出6个参与脂肪生成调控的潜在靶基因(表2),进行后续验证试验。
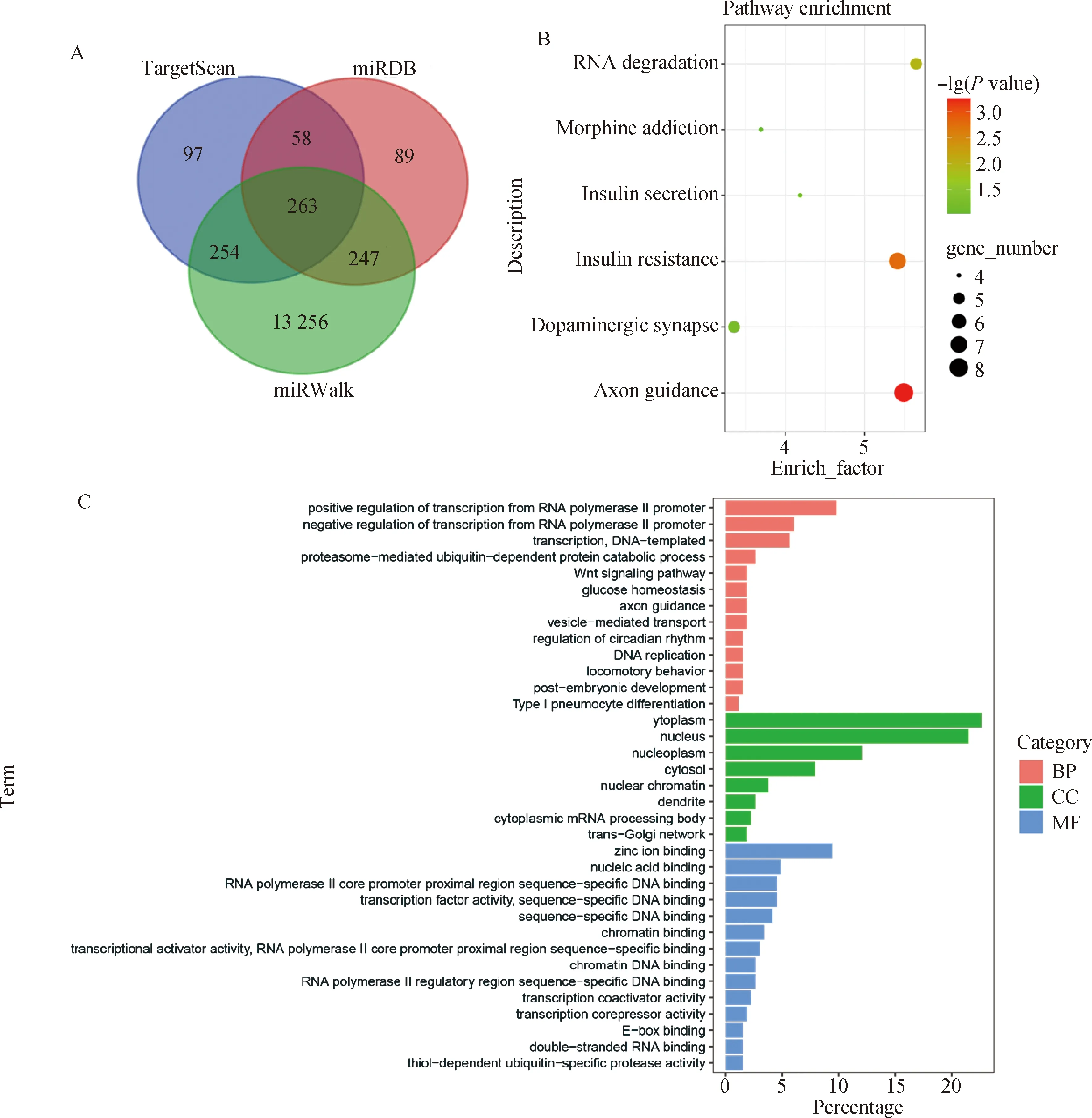
A. 靶基因预测结果;B. GO富集分析;C. KEGG pathway 富集分析A. Target gene predict result; B. Analysis of GO enrichment; C. Analysis of KEGG pathway enrichment图6 miR-138生物信息学分析Fig.6 Bioinformatics analysis of miR-138

表2 靶基因筛选结果Table 2 Results of target genes screening
2.6 过表达及抑制miR-138对靶基因的影响
细胞转染mimics及inhibitor并诱导分化48 h后,利用RT-qPCR测定靶基因的mRNA表达水平。结果显示过表达miR-138后,靶基因11、1和11的mRNA表达显著下调(<0.05),-1α和25 mRNA表达水平极显著下调(<0.01),的mRNA表达无显著差异(>0.05,图7A);抑制miR-138的表达后,和25的mRNA表达水平显著上调(<0.05),11和-1α的mRNA表达水平极显著上调(<0.01),而1和11的mRNA表达水平无显著差异(>0.05,图7B)。
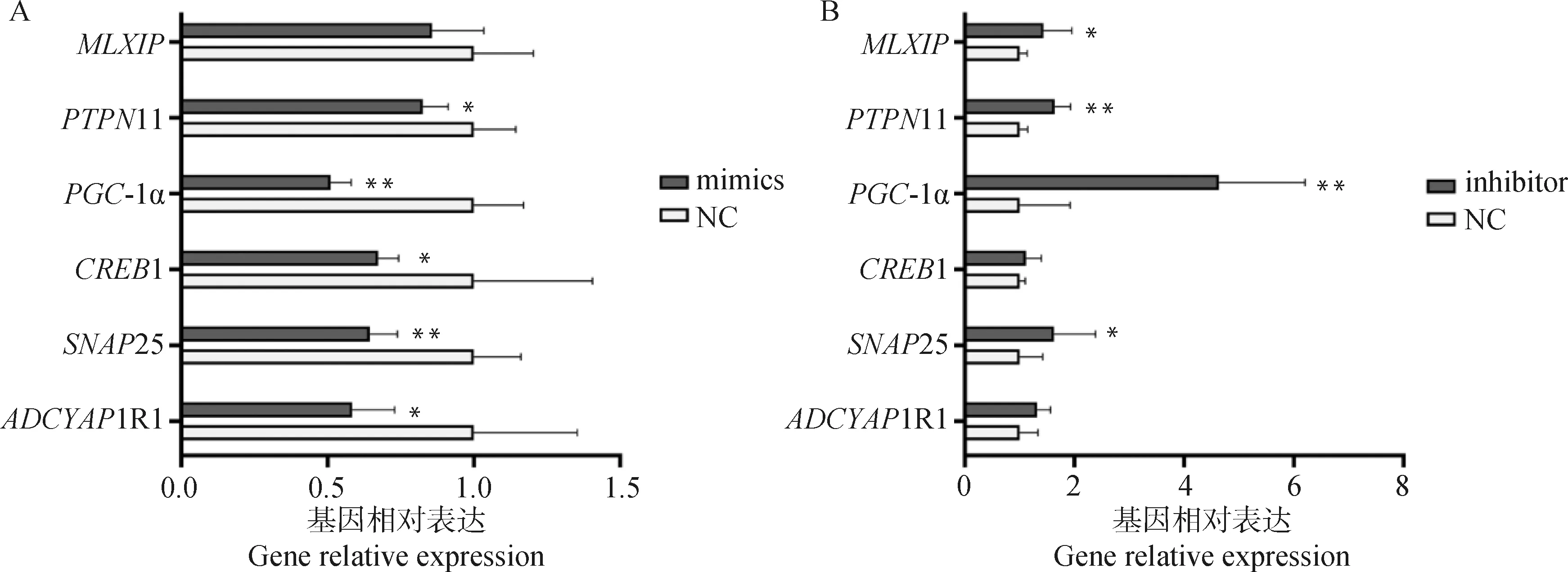
A. 过表达miR-138对靶基因的影响;B. 抑制miR-138表达对靶基因的影响A. Effects of miR-138 overexpression on target genes; B. Effects of miR-138 suppression on target genes图7 miR-138对靶基因的影响Fig.7 Effects of miR-138 on target genes
2.7 miR-138靶向PGC-1α 3′ UTR序列
RT-qPCR结果显示,过表达和抑制miR-138都可极显著影响-1的mRNA表达水平,暗示miR-138可能通过靶向-1影响前体脂肪细胞增殖分化过程。利用双荧光素酶试验进一步验证miR-138与-1的靶向关系,结果显示,细胞共转染miR-138 mimics和-1-Wt-PGL3-basic后,对比其他组荧光强度显著降低(<0.01),且转染miR-138 inhibitor和-1-Wt-PGL3-basic后荧光强度最高(图8)。结果表明-1是miR-138的下游直接作用靶标,miR-138可特异性结合-1mRNA的3′ UTR序列,降低mRNA表达水平。

A. 结合位点预测; B. 位点突变验证; C.双荧光素酶报告试验结果A. Predicted binding site; B. Site mutation verification; C. The result of dual-luciferase reporter assay图8 双荧光素酶试验结果Fig.8 Results of dual-luciferase reporter assay
3 讨 论
动物脂肪生成是一个复杂的协作体系,受到脂肪细胞的分化、脂质代谢等生物学过程的影响,miRNAs在该过程中发挥着重要的转录后调控作用。前人研究发现,在细胞脂质代谢过程中miR-138可以靶向1基因,激活AMPK通路,进而抑制1表达,从而降低癌细胞甘油三酯(TG)和胆固醇含量,抑制前列腺癌细胞脂质代谢。在脂肪肝细胞中miR-138还可作为1上游调控因子,当抑制miR-138-5p表达时,可促进1表达,加速脂肪酸β-氧化,降低脂肪含量,进而改变肝脂肪变性进程。此外,miR-138可以靶向调控脂肪生成关键酶(lipoprotein lipase)的活性,抑制脂肪源干细胞向脂肪细胞分化;还可靶向-1影响人间充质干细胞分化过程,进而减少细胞脂滴沉积。本研究发现,在牦牛肌内前体脂肪细胞诱导分化过程中,过表达miR-138可显著下调脂肪分化标志基因和的表达(<0.01),抑制脂肪细胞分化过程,进而减少细胞脂质沉积;抑制miR-138表达则可显著上调、的表达水平(<0.05),促进细胞分化和脂质沉积,此结果与前人研究结果一致。
miR-138常被视作为一种肿瘤抑制因子,可在肿瘤的发生与发展过程抑制细胞的增殖能力;在神经干细胞的分化过程中,miR-138可靶向结合6的3′UTR序列调节其mRNA表达水平,进而促进细胞分化,抑制细胞增殖;还可通过抑制RhoC的表达抑制去分化软骨细胞的分化和增殖。此外,miR-138也可作为circRNA的海绵(sponges),通过竞争性吸附从而降低对牛成肌细胞的凋亡和分化的抑制作用,抑制细胞增殖;这些研究证明miR-138可对细胞增殖能力起到抑制调控。此外,miR-138还可对细胞增殖发挥正向调控作用,如可靶向-1促进人肺动脉平滑肌细胞的增殖,抑制细胞线粒体去极化;在小鼠平滑肌细胞中,靶向1 3′ UTR促进小鼠平滑肌细胞的增殖;这些研究成果证明,miR-138在细胞增殖过程中发挥着重要的调控作用。在本研究中发现,过表达和抑制miR-138可分别抑制和增强牦牛肌内前体脂肪细胞增殖活性(<0.05),表明miR-138在抑制牦牛肌内前体脂肪细胞分化的同时,可抑制脂肪细胞增殖能力。进一步研究发现,过表达miR-138可使细胞阻滞于G1期,过表达miR-138后细胞周期相关蛋白1、1,及细胞增殖标志基因67显著下调。而抑制miR-138后,1和67显著上调。表明miR-138在前体脂肪细胞中可通过影响细胞周期和增殖相关基因的表达调控细胞增殖,但其具体作用机制有待深入研究。
-1(过氧化物酶体增殖物激活受体γ共激活因子1α)是细胞线粒体生物合成与功能发挥的关键因子,可调控线粒体基因和线粒体蛋白的表达,参与调控葡萄糖稳态、脂质代谢平衡和生物时钟稳态等多种生理进程。本研究发现,miR-138可特异性结合-1的3′UTR序列,下调其mRNA表达水平,并抑制前体脂肪细胞脂滴积累,结果暗示,miR-138可能是通过靶向-1影响前体脂肪细胞脂质代谢过程,进而降低细胞脂质沉积。此外,-1作为脂肪分化标志基因的共激活因子,上调-1的表达水平可增强的表达,促进胚胎干细胞向心肌细胞分化;而下调-1的表达水平可抑制成纤维细胞向肌成纤维细胞分化并降低胶原蛋白的释放;有研究发现,-1还在骨骼干细胞向成骨或成脂细胞分化过程中扮演着调控开关的角色;在小鼠胚胎成骨细胞前体细胞分化抑制改善后,细胞-1表达水平也显著增加;这些研究结果表明-1的表达与细胞分化过程密切相关。本研究中过表达miR-138同时显著降低了的表达水平,抑制miR-138的表达则相反的促进的表达,因此推测,miR-138在前体脂肪细胞分化过程中,可能是通过特异性调控-1的表达,进而影响的激活,从而抑制牦牛肌内前体脂肪细胞分化和脂滴形成。
PTPN11是蛋白酪氨酸磷酸酶(PTPs)家族成员之一,被报道可作为胰岛素作用的负调节因子,与肥胖及糖尿病等疾病的发生发展密切相关,参与调节细胞存活、增殖、分化、迁移和黏附等生命过程;11编码蛋白酪氨酸磷酸酶2(SHP-2),在骨髓间充质干细胞中可通过抑制AKT的磷酸化和Cyclin D1的表达,从而调控细胞的增殖分化水平。突触体相关蛋白-25(SNAP25)属于可溶性N-乙基马来酰亚胺敏感的融合蛋白附着蛋白受体(SNARE)家族成员,对脑胶质瘤细胞的增殖、迁移及谷氨酰胺代谢过程具有调控作用,还可促进神经元细胞的分化。本研究同时发现miR-138可影响11和25的mRNA表达情况,结果暗示miR-138对牦牛前体脂肪细胞增殖、分化的调控作用,可能与25和11的表达有关,这也为揭示miR-138在动物脂肪生成过程中的调控机制提供了研究方向。
4 结 论
本研究证明了miR-138可抑制牦牛肌内前体脂肪细胞分化及增殖,减少胞内脂滴沉积;进一步试验表明miR-138可通过靶向-1参与肌内前体脂肪细胞的增殖分化调控。本研究为阐明miR-138对动物脂肪生成的调控机制提供了数据参考,为牦牛肉品质的改善奠定了基础。
