黄沙鳖β-防御素Hs-BD1的原核表达及抗菌活性检测
2022-10-28韩书煜许飘尹吴志刚杨祖鹏谭雯予杨廷雅施金谷梁静真
韩书煜,许飘尹,魏 华,吴志刚,杨祖鹏,谭雯予,杨廷雅,施金谷,梁静真,黄 钧
(1.广西大学动物科学技术学院/广西水生动物病害诊断实验室/广西高校水生生物健康养殖与营养调控重点实验室,南宁 530004;2.广西水产技术推广站,南宁 530022)
【研究意义】近年来,抗生素滥用引起的细菌耐药性问题已受到广泛关注,而具有广谱抗微生物活性防御素的出现为解决细菌耐药难题提供了新思路[1]。防御素是一种小分子阳离子抗菌肽,在帮助机体抵抗病原入侵的过程中发挥重要作用,根据生物种类来源和二硫键连接方式可将其划分为植物防御素、昆虫防御素、α-防御素、β-防御素和θ-防御素等[2]。β-防御素具有β-折叠片结构、6个保守半胱氨酸残基(Cys)和1个保守甘氨酸(Gly)残基,广泛分布于哺乳类、禽类、爬行类和鱼类等多种生物体内,具有抗细菌、真菌和病毒等活性[3]。黄沙鳖(Huangsha soft-shelled turtle)是中华鳖(Pelodiscussinensis)的地理种群[4],原产于我国华南的左江、右江和西江流域。本研究课题组前期已成功克隆获得黄沙鳖β-防御素1基因(Hs-BD1)的开放阅读框(ORF)序列[5],但未对Hs-BD1进行蛋白表达和纯化。因此,开展黄沙鳖β-防御素的蛋白表达和活性分析,对新型黄沙鳖生物工程药物开发利用具有重要意义。【前人研究进展】目前,获得具有抑菌活性防御素蛋白的主要手段是采用基因工程表达和化学合成法[6-8],如利用蛋白自动合成仪合成绿蝇防御素phormicin A对金黄色葡萄球菌(Staphylococcusaureus)的最小抑菌浓度(MIC)为2.0 μg/mL,对几种芽孢杆菌(Bacillussp.)和四联微球菌(Micrococcustetragenus)的MIC为12.5~25.0 μg/mL,对大肠杆菌(Escherichiacoli)的MIC为300.0 μg/mL[8];以大肠杆菌为宿主细胞表达的人类巨噬细胞β-防御素130重组蛋白对革兰氏阳性菌金黄色葡萄球菌ATCC25923(MIC为45.0 μg/mL)和革兰氏阴性菌绿脓杆菌(Pseudomonasaeruginosa) ATCC27853(MIC为50.0 μg/mL)均表现出极强的抗菌活性[9];将鸡β-防御素Gal-4成熟肽区基因克隆到原核表达载体pET-30a并转化至大肠杆菌感受态细胞中,所获得的重组蛋白Gal-4对金黄色葡萄球菌和多杀性巴氏杆菌(Pasteurellamultocida)均表现良好的抑菌效果[10];通过构建鹅β-防御素7(AvBD7)的重组表达质粒pProEX-AvBD7,将其转化至大肠杆菌Rosetta感受态细胞中进行IPTG诱导表达,结果显示鹅AvBD7重组蛋白对大肠杆菌、鸡白痢沙门氏菌(Salmonellapullorum)、金黄色葡萄球菌、四联球菌和枯草芽孢杆菌(Bacillussubtilis)5种细菌均有显著的抗菌活性[11]。β-防御素是龟鳖类先天免疫系统的重要组成部分,其种类较多,已从欧洲池塘龟(Emysorbicularis)[12]、中华鳖[13]和刺鳖(Apalonespinifera)[14]等龟鳖类体内分离到30余种[15]。此外,天然提取或基因工程表达的龟鳖类β-防御素均具有一定抗菌活性,如天然提取的欧洲池塘龟β-防御素tBD-1对单增李斯特菌(Listeriamonocytogenes)、大肠杆菌、白色念珠菌(Candidaalbicans)及耐甲氧西林的金黄色葡萄球菌均具有较强抑菌效果[12]。中华鳖β-防御素2的重组蛋白rPs-BD2具有较强的抗微生物活性,对金黄色葡萄球菌08032706、枯草芽孢杆菌08042313和表皮葡萄球菌(S.epidermidis) 09021325的MIC在9.38~18.75 μg/mL,对大肠杆菌ATCC25922的MIC为37.50 μg/mL;rPs-BD2对人类红细胞的溶血性和对鼠源性巨噬细胞的细胞毒性均较弱,表明重组蛋白rPs-BD2对机体具有较高的生物安全性[13]。龟鳖类多生活在污脏的陆地或水环境中,这些恶劣环境是微生物滋生的良好条件,为抵抗病原微生物感染、适应生活环境,龟鳖类在长期的自然选择中其体内已形成包括β-防御素在内比较有效的防御系统[14-15],因此,龟鳖类β-防御素在新型药物或饲料添加剂开发上可能具有潜在的应用价值。【本研究切入点】至今,有关黄沙鳖β-防御素蛋白表达及活性检测的研究鲜见报道。【拟解决的关键问题】构建Hs-BD1成熟肽原核表达,并对重组蛋白rHs-BD1进行抗菌活性、溶血性和抗氧化能力等生物学活性检测分析,旨在为黄沙鳖β-防御素功能的深入分析及新型黄沙鳖抗菌药物开发利用提供参考依据。
1 材料与方法
1.1 试验材料
试验用菌株为水产动物临床分离细菌,包括无乳链球菌(Streptococcusagalactiae)HPG1、金黄色葡萄球菌HPN1、类志贺邻单胞菌(Plesiomonsshigelloides)DAL1、迟钝爱德华氏菌(Edwardsiellatarda)FCH1和大肠杆菌YLG1。克隆感受态细胞大肠杆菌DH5α、质粒pMD18-T和pCold-TF均购自宝日医生物技术(北京)有限公司;表达菌株大肠杆菌BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;His标签蛋白(可溶性)纯化试剂盒购自北京康为世纪生物科技有限公司;微孔BCA蛋白含量测定试剂盒、阿氏液(红细胞保存液)、Triton X-100(聚乙二醇辛基苯基醚)、1,1-二苯基-2-苦肼基(DPPH)购自北京索莱宝科技有限公司;96微量孔板购自美国康宁公司;采血针管购自江苏华达医疗器械有限公司。
1.2 Hs-BD1基因成熟肽片段克隆
提取黄沙鳖肝脏总RNA,并反转录合成cDNA。参考许飘尹等[5]的方法获得Hs-BD1基因ORF序列,在其成熟肽基因编码区5'端和3'端分别设计1个带有限制性酶切位点BamHⅠ的上游引物及带有EcoRⅠ的下游引物,用于扩增Hs-BD1基因成熟肽部分。引物序列分别为rBD-F:5′-CGGGATCCACTAGGGACCGAGCATGTG-3′;rBD-R:5′-CGGAATTC CTAGACTCTGATCCTGC-3′。其中,单下划线分别为BamHⅠ和EcoRⅠ的酶切位点,波浪线为终止密码子位点,粗体为限制性内切酶的保护碱基。PCR反应体系(25.0 μL):2×EASYTaqSupermix聚合酶12.5 μL,上、下游引物各1.0 μL,ddH2O 8.5 μL,cDNA模板2.0 μL。扩增程序:95 ℃预变性3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,进行30个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后,将目的片段条带进行胶回收纯化并送至北京六合华大基因科技有限公司进行测序,以验证所扩增的Hs-BD1基因成熟肽片段是否正确。
1.3 重组质粒pCold-TF-Hs-BD1构建及鉴定
将1.2回收获得的PCR产物与载体pCold-TF分别用限制性内切酶BamHⅠ和EcoRⅠ进行双酶切过夜反应,用DNA纯化回收试剂盒[天根生化科技(北京)有限公司]回收目的基因及载体片段,随后将酶切纯化后的pCold-TF质粒及Hs-BD1基因成熟肽序列片段进行连接,再将连接产物转化至大肠杆菌DH5α感受态细胞中进行蓝白斑筛选。以1.2的引物进行菌落PCR筛选阳性克隆菌落,阳性菌液送至北京六合华大基因科技有限公司进行测序,将鉴定正确的阳性菌液采用质粒小量快速提取试剂盒(北京艾德莱生物科技有限公司)提取重组质粒pCold-TF-Hs-BD1。
1.4 重组蛋白rHs-BD1诱导表达及鉴定
1.4.1 重组蛋白rHs-BD1诱导表达 将重组质粒pCold-TF-Hs-BD1转化至大肠杆菌BL21(DE3)感受态细胞中。分别将30.0 μL含重组质粒pCold-TF-Hs-BD1和空质粒pCold-TF的大肠杆菌BL21(DE3)菌液转移至5.0 mL LB液体培养基(含氨苄青霉素)中复苏;将30.0 μL不含任何质粒的大肠杆菌BL21(DE3)菌液转移至5.0 mL LB液体培养基(不含氨苄青霉素)复苏,37 ℃下120 r/min振荡过夜培养。随后将这几种培养液置于37 ℃下180 r/min振荡培养6 h,每隔30 min测定1次菌液的OD值,直至菌液OD600 nm为0.4~0.5,然后将上述菌液置于15 ℃低温摇床预冷30 min。加入终浓度为0.2、0.5、0.8和1.0 mmol/L的IPTG,15 ℃下180 r/min继续诱导24 h。取1.0 mL已诱导的菌液置于1.5 mL离心管中,4 ℃下12 000 r/min离心5 min,去除上清液。然后向每个管内加入1.0 μL PMSF蛋白酶抑制剂和100.0 μL RIPA细胞快速裂解液,充分混匀并简短离心后将其置于冰上静置30 min。4 ℃下12 000 r/min离心5 min,分别收集沉淀和上清液。此时,重组蛋白rHs-BD1存在于该沉淀或上清液中,置于-80 ℃保存备用。
1.4.2 十二硫酸酯钠—聚丙烯酰胺凝胶电泳(SDS-PAGE)和Western blotting检测 按照SDS-PAGE凝胶制备试剂盒说明进行操作,表达上清液按4∶1比例加入5×SDS蛋白上样缓冲液,表达沉淀则先加入100.0 μL 1×PBS吸打混匀,再加入适量上样缓冲液混匀,简短离心,100 ℃加热5 min使蛋白充分变性。使用SDS-PAGE凝胶对表达上清液和表达沉淀进行重组蛋白rHs-BD1的电泳,以考马斯亮蓝染色检测蛋白表达情况。经SDS-PAGE后,将重组蛋白rHs-BD1转移到PVDF膜上,将一抗Anti-6×His Tag抗体用Western一抗稀释液按照1∶800的比例进行稀释,于4 ℃避光过夜孵育。然后用1×TBST漂洗液洗去多余的一抗残留物(避光摇床孵育约0.5 h),每5 min更换1次漂洗液。将二抗辣根过氧化物酶标记的羊抗鼠IgG(H+L)抗体用二抗稀释液以1∶5000比例稀释,室温避光摇床孵育1.0 h,去除二抗时用1×TBST漂洗液洗涤5~6次,每次约5 min。抗体孵育完成后,去除多余的液体,晾干PVDF膜。用移液枪将混合显色液均匀地加在PVDF膜上,于暗处放置3~5 min。将已显色的PVDF膜置于ImageQuant LAS 500成像仪器中拍照观察,利用ImageJ软件对不同浓度IPTG诱导下重组蛋白rHs-BD1的Western blotting检测结果进行灰度分析,比较蛋白的表达量。
1.5 重组蛋白rHs-BD1纯化
利用Ni柱亲和层析法进行重组蛋白rHs-BD1纯化。将100.0 mL含重组蛋白rHs-BD1的大肠杆菌菌液12 000 r/min离心7 min后收集菌体,去除上层液体培养基后,加入100.0 μL PMSF蛋白酶抑制剂和10.0 mL RIPA细胞裂解液充分混匀,在冰上静置30 min以裂解细菌细胞,然后4 ℃下12 000 r/min离心5 min,收集上清液,采用His标签蛋白(可溶性)纯化试剂盒进行分离纯化。用20.0 mL Binding Buffer平衡纯化柱后,以Binding Buffer等体积稀释重组蛋白rHs-BD1样品并上纯化柱;分别用10.0和15.0 mmol/L咪唑洗脱杂蛋白,最后用Elution Buffer洗涤层析柱,洗涤、收集重组蛋白rHs-BD1,并进行SDS-PAGE验证;纯化后的重组蛋白rHs-BD1含量采用微孔BCA蛋白含量测定试剂盒进行测定。
1.6 抗菌活性检测
采用最小抑菌浓度(MIC)法进行抗菌活性检测。以氨苄青霉素、去离子水为对照,以大肠杆菌ATCC25922为质控菌株。将细菌划线接种于LB固体培养基中,37 ℃过夜培养。将培养好的菌落用生理盐水洗脱制成0.5 McF的菌悬液备用。首先,将重组蛋白rHs-BD1用灭菌生理盐水进行倍比稀释,在96孔板的一行12个孔中分别加入400.0、200.0、100.0 μg/mL……的2倍稀释重组蛋白rHs-BD1样品各30.0 μL,每个样品设3个平行组;其次在各孔内分别加入90.0 μL脑心浸液(BHI)培养基混匀;最后,向各孔内分别加入已制备好的各种菌悬液30.0 μL,混匀。至此,12个孔的重组蛋白rHs-BD1样品终含量依次为80.0、40.0、20.0 μg/mL……的2倍递减浓度。阳性对照为等体积氨苄青霉素,12个孔的氨苄青霉素含量依次为400.0、200.0、100.0 μg/mL……的2倍递减浓度,阴性对照为等体积去离子水。将96孔板置于37 ℃培养箱培养48.0 h,经肉眼观察无细菌生长孔的最小药物浓度即为该药物的MIC。
1.7 溶血性分析
参照广慧娟[16]的方法进行溶血性分析。利用加入抗凝剂阿氏液的注射器采集4.0~5.0 mL新鲜黄沙鳖血液置于10.0 mL无菌EP管中,颠倒轻柔混匀。将采集的新鲜血液与生理盐水按照1∶1比例上下颠倒轻柔混匀,4 ℃下2000 r/min离心5 min,弃上清液。再将等体积生理盐水加入剩余沉淀中,缓慢颠倒混匀,4 ℃下2000 r/min离心5 min,反复洗涤直至上清液呈透明颜色为止。血细胞稀释液制备:吸取上述血细胞沉淀100.0 μL置于15.0 mL无菌EP管中,加入10.0 mL生理盐水颠倒混匀。试验组设置:在血细胞稀释液中加入不同含量的重组蛋白rHs-BD1,使其终含量分别为20.0、40.0、60.0和80.0 μg/mL;以1% Triton X-100为阳性对照,以生理盐水为阴性对照,37 ℃孵育30 min,2000 r/min离心5 min。取上清液加入酶标板中,用酶标仪测定样品在540 nm处的吸光值。每个样品或对照设3个平行。
溶血率(%)=(样品吸光值-生理盐水组吸光值)/(阳性对照吸光值-生理盐水组吸光值)×100
1.8 抗氧化能力检测
参照广慧娟[16]的方法,通过计算DPPH自由基清除率进行抗氧化能力检测,整个试验过程避光进行。称取1.2 mg DPPH溶解于500.0 μL甲醇中获得6×10-3mol/L DPPH母液,4 ℃避光保存备用。试验前用甲醇溶液将DPPH母液稀释至终浓度为6×10-5mol/L的DPPH工作液。在DPPH工作液中加入不同含量的重组蛋白rHs-BD1,使其终含量分别为20.0、40.0、80.0和120.0 μg/mL,充分混合。以无菌生理盐水为空白对照,室温避光放置30 min,随后用酶标仪检测517 nm处的吸光值,每个样品或对照设3个平行。
DPPH自由基清除率(%)=(样品吸光值-空白对照吸光值)/空白对照吸光值×100
2 结果与分析
2.1 pCold-TF-Hs-BD1原核表达载体的构建及鉴定
以引物rBD-F和rBD-R扩增Hs-BD1基因成熟肽序列片段,经琼脂糖凝胶电泳检测,结果(图1-A)显示,扩增片段长度约126 bp,片段大小与预期结果相符。PCR产物测序结果与Hs-BD1基因cDNA序列的成熟肽区比对无误,表明序列扩增成功。pCold-TF质粒双酶切结果(图1-B)显示,在5769 bp处有1条明显的条带,该条带应为pCold-TF线性片段;重组质粒pCold-TF-Hs-BD1的双酶切结果(图1-C)显示,在5769和126 bp处各有1条特异性条带,其中,5769 bp处的特异性条带应为pCold-TF线性片段,126 bp处的特异性条带应为Hs-BD1基因成熟肽序列片段,均与预计结果相符,表明重组质粒pCold-TF-Hs-BD1构建成功。
2.2 重组蛋白rHs-BD1表达
SDS-PAGE分析结果(图2)显示,经IPTG诱导且含重组质粒pCold-TF-Hs-BD1的大肠杆菌上清液和沉淀表达产物在58.1 kDa处均有1条特异性条带,与融合蛋白分子量预测值一致,而未经IPTG诱导的大肠杆菌表达产物无该特异性条带,说明经IPTG诱导后重组蛋白rHs-BD1成功获得表达;重组蛋白rHs-BD1在上清液(泳道3~6)和沉淀(泳道9~12)中均有分布,说明诱导获得表达的重组蛋白rHs-BD1存在可溶性和包涵体2种形式,后续试验仅取上清液进行重组蛋白rHs-BD1纯化。
Western blotting检测结果(图3)表明,由不同浓度IPTG诱导的含pCold-TF-Hs-BD1的大肠杆菌上清液表达产物在约58.1 kDa附近均有1条特异性显色条带,该条带大小与融合蛋白分子量预测值一致,表明重组蛋白rHs-BD1与Anti-6×His Tag抗体发生特异性反应;未经IPTG诱导的大肠杆菌表达产物无该特异性显示条带;当IPTG诱导浓度为0.2 mmol/L时重组蛋白rHs-BD1在上清液中的表达量最大(泳道2~5)。灰度分析结果(图4)显示,当IPTG浓度为0.5、0.8和1.0 mmol/L时重组蛋白rHs-BD1条带的灰度均显著低于当IPTG浓度为0.2 mmol/L时重组蛋白rHs-BD1条带的灰度(P<0.05)。可见,Western blotting检测结果可进一步证实重组蛋白rHs-BD1在大肠杆菌中已成功表达,且IPTG对含pCold-TF-Hs-BD1大肠杆菌上清液表达产物的最佳诱导浓度为0.2 mmol/L。
2.3 重组蛋白rHs-BD1的纯化结果
SDS-PAGE检测蛋白纯化结果(图5)显示,经IPTG诱导含pCold-TF-Hs-BD1的大肠杆菌上清液表达产物在约58.1 kDa处有明显条带(泳道1),与融合蛋白预测值相符;将重组蛋白rHs-BD1上样至纯化柱后的样品流出液在约58.1 kDa处未观察到明显条带(泳道2~3),说明重组蛋白rHs-BD1与纯化柱中的Ni2+结合程度较好;经10.0 mmol/L咪唑逐步洗脱(泳道4~6),可见流出液中杂蛋白含量逐渐减少;采用15.0 mmol/L咪唑洗脱,可见流出液中杂蛋白含量进一步减少(泳道7~9);采用Elution Buffer洗脱,在约58.1 kDa处可见较单一的蛋白条带,该蛋白条带应为重组蛋白rHs-BD1(泳道10)。说明以15.0 mmol/L咪唑可充分洗脱杂蛋白,以Elution Buffer可洗脱重组蛋白rHs-BD1。因此,以Elution Buffer洗脱的重组蛋白rHs-BD1进行后续蛋白含量测定和抗菌活性分析。
利用微孔BCA蛋白含量测定试剂盒所得测定值绘制标准曲线,计算重组蛋白rHs-BD1含量,得到试剂盒自带标准品(BSA)的标准曲线公式为y=0.0009x+0.0016(图6)。其中,x表示蛋白含量,y表示OD562 nm。已纯化的重组蛋白rHs-BD1在OD562 nm处的吸光值为0.362,因此,根据标准曲线公式计算出其蛋白含量为400.0 μg/mL。
2.4 重组蛋白rHs-BD1的抗菌活性分析
由表1可知,重组蛋白rHs-BD1对革兰氏阴性菌大肠杆菌YLG1、类志贺邻单胞菌DAL1和迟钝爱德华氏菌FCH1的MIC均为20.00 μg/mL,对革兰氏阳性菌无乳链球菌HPG1和金黄色葡萄球菌HPN1的MIC为40.00 μg/mL,均高于传统抗生素氨苄青霉素对这些细菌的MIC。说明重组蛋白rHs-BD1对这些革兰氏阳性和阴性菌均具有一定的抗菌活性,但抗菌活性弱于氨苄青霉素。
2.5 重组蛋白rHs-BD1的溶血性分析
由表2可知,当重组蛋白rHs-BD1含量为20.0、40.0、60.0和80.0 μg/mL时,其对黄沙鳖血细胞的溶血性分别为1.5%、2.7%、3.3%和4.2%,即在含量为20.0~80.0 μg/mL范围内,重组蛋白rHs-BD1的溶血性随着其含量的升高而增强,但总体上未超过5.0%,说明重组蛋白rHs-BD1对黄沙鳖血细胞的溶血作用较弱。
2.6 重组蛋白rHs-BD1的抗氧化能力分析
由表3可知,当重组蛋白rHs-BD1含量为20.0、40.0、80.0和120.0 μg/mL时,其对DPPH自由基的清除率分别为2.6%、5.2%、11.6%和17.0%,即在含量为20.0~120.0 μg/mL范围内,重组蛋白rHs-BD1的抗氧化能力随着其含量的升高而增强,说明重组蛋白rHs-BD1具有一定的抗氧化能力。

表1 重组蛋白rHs-BD1和氨苄青霉素对几种细菌的MIC比较
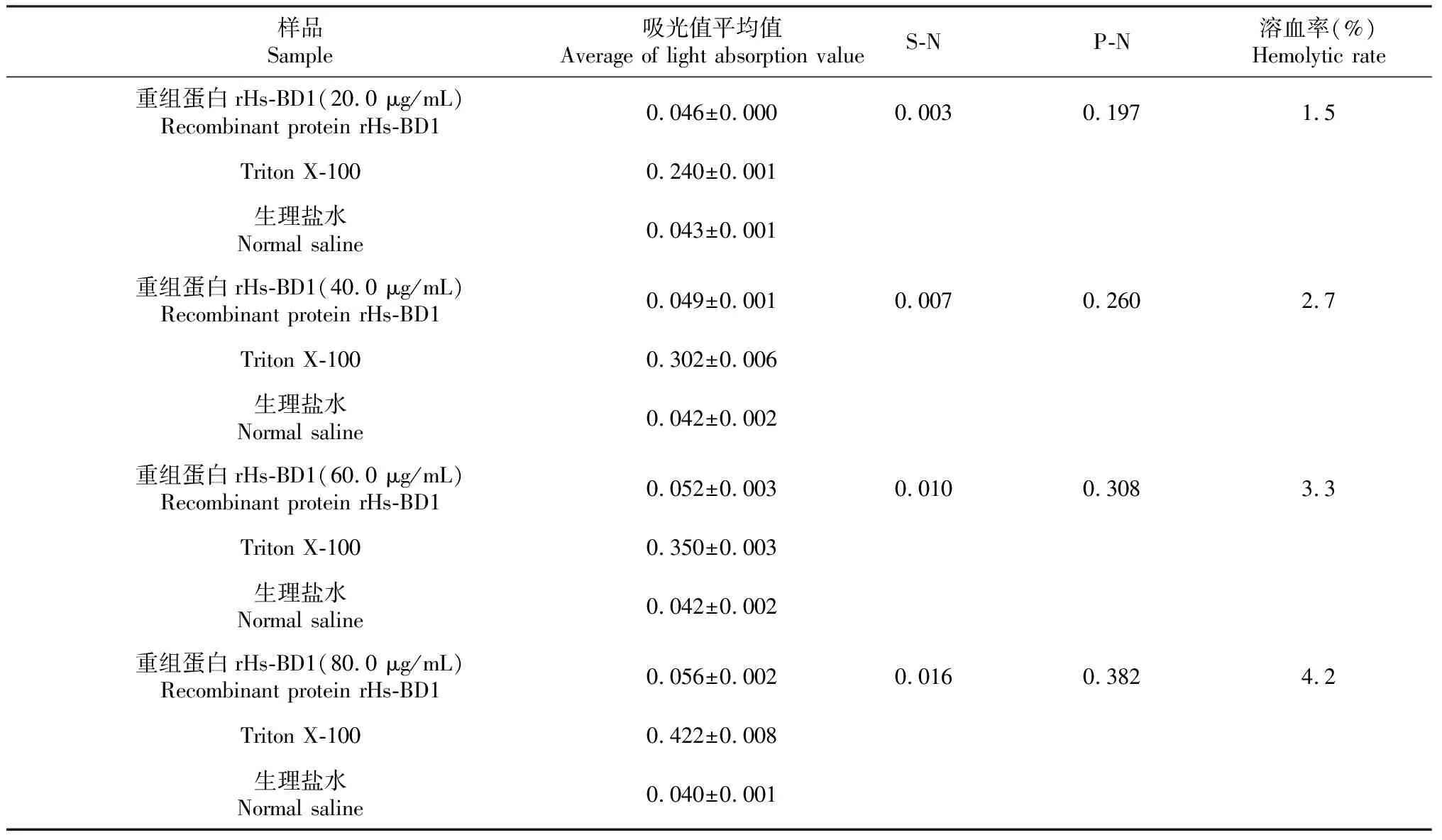
表2 黄沙鳖重组蛋白rHs-BD1的溶血性分析
3 讨 论
采用大肠杆菌系统对真核生物来源的蛋白进行表达易出现错误折叠问题[17-18],重组蛋白不能正确折叠可能会形成难溶解的包涵体,在重组蛋白的N端融合有助于蛋白表达和折叠的触发因子TF可避免重组蛋白包涵体的形成[18]。本研究将Hs-BD1基因成熟肽片段序列连接到pCold-TF载体,通过分别收集裂解菌体的上清液和沉淀分析表达蛋白的可溶性,结果表明,重组蛋白rHs-BD1在上清液和沉淀中均有较明显表达,但由于重组蛋白rHs-BD1在上清液的表达量较大,上清液表达产物能与Anti-6×His Tag抗体发生特异性反应,因此,可认为重组蛋白rHs-BD1为可溶性表达;重组蛋白rHs-BD1在沉淀中也有明显表达,究其原因可能与裂解菌体的上清液和沉淀分离不彻底有关,但仍需进一步验证。本研究中,使用0.2、0.5、0.8和1.0 mmol/L IPTG进行重组蛋白rHs-BD1的表达诱导,结果发现当IPTG诱导浓度为0.2 mmol/L时重组蛋白rHs-BD1在上清液中表达量最大,推测较高浓度的IPTG可能对细菌生长具有抑制作用,后续可通过测定OD600 nm来量化不同浓度IPTG对表达菌株生长的影响程度[19]。综合考虑试验成本,本研究中IPTG的最佳诱导浓度为0.2 mmol/L。经过Ni亲和层析柱纯化后的重组蛋白rHs-BD1含量为400.0 μg/mL,低于部分文献[6,10]报道β-防御素重组蛋白的纯化浓度,其原因可能是:①在低浓度咪唑洗脱杂蛋白时有不少重组蛋白rHs-BD1被洗脱,导致最终纯化的重组蛋白rHs-BD1量减少;②纯化均在室温条件下进行,而温度与重组蛋白纯化量呈负相关,在相对高温条件下蛋白纯化效率会降低[7]。后续可通过降低纯化温度或增大粗蛋白上样量再经超滤浓缩方法获得更高浓度的纯化蛋白。
Hs-BD1成熟蛋白的C端包含由6个Cys残基形成的3对二硫键,空间构象稳定,不易被蛋白酶水解,具有α-螺旋和β-折叠片结构,化学结构牢固[13],富含正电荷并易吸附在带负电荷的病原菌磷脂膜表面,引起细胞膜破损[5,20]。本研究发现,重组蛋白rHs-BD1不受His标签影响,无需酶切处理即可显示广谱抗菌活性,与Su等[21]、Zhou等[22]、符梅等[23]的研究结果相似;重组蛋白rHs-BD1对3种革兰氏阴性菌的抗菌效果稍强于2种革兰氏阳性菌,可能与革兰氏阳性菌和阴性菌的细胞壁结构和组成成分不同有关;与其他人工合成的抗菌肽相比,重组蛋白rHs-BD1对革兰氏阳性菌金黄色葡萄球菌的抑菌活性稍强于人巨噬细胞重组β-防御素130(MIC为45.00 μg/mL)[9],但弱于化学合成的绿蝇防御素phormicin A的抑菌活性(MIC为2.00 μg/mL)[8]和脆皮大头蛙抗菌肽Lf-CATHla的抑菌活性(MIC为12.25 μg/mL)[16];对革兰氏阴性菌大肠杆菌的抑菌活性强于Lf-CATHla(MIC为50.00 μg/mL)[16]、β-防御素130(MIC为60.00 μg/mL)[9]和防御素phormicin A(MIC为300.00 μg/mL)[8],但相较于传统抗生素氨苄青霉素,重组蛋白rHs-BD1的抗菌效果存在一定差距,后续可通过氨基酸定点突变技术增加多肽的带正电性或采取改良分子结构来提高重组蛋白rHs-BD1的抗菌活性[24]。
溶血性是检测生物制剂对机体是否安全的重要指标。已报道的各种β-防御素重组蛋白的溶血率均相对较低,如500.0 μg/mL鸽重组蛋白AvBD1的溶血率仅1.94%[25],500.0 μg/mL鸭重组蛋白AvBD5对鸭血红细胞的溶血率为7.47%[26],而猪重组蛋白rPBD114在含量小于256.0 μg/mL时,其溶血率均小于3.90%,且对细胞的毒性也较低[21]。本研究结果表明,当重组蛋白rHs-BD1含量小于80.0 μg/mL时,其溶血率低于4.20%,说明重组蛋白rHs-BD1对黄沙鳖血细胞伤害较小、安全性较高,具有作为生物制剂进行开发的潜力。
在正常机体中,活性氧自由基代谢失调会干扰机体细胞的正常功能[27]。已报道的许多重组抗菌肽均具有DPPH自由基清除作用,如86.8 μmol/L的亚洲璃眼蜱重组防御素蛋白Ha-defensin-1和160.0 μg/mL的脆皮大头蛙Lf-CATHla对DPPH自由基的清除率分别为20.50%[28]和57.79%[16]。本研究结果表明,当重组蛋白rHs-BD1含量为20.0、40.0、80.0和120.0 μg/mL时,其对DPPH自由基的清除率分别为2.6%、5.2%、11.6%和17.0%,说明重组蛋白rHs-BD1对DPPH自由基具有一定的清除作用和抗氧化能力,可作为一种新型抗氧化药物应用于因自由基过量累积引起的疾病治疗。
为有效控制黄沙鳖细菌性疾病提供新途径,本研究前期克隆获得了黄沙鳖cathelicidin基因cDNA序列。本研究中,通过对Hs-BD1进行原核表达成功获得具有广谱抗菌活性及一定抗氧化能力的可溶性重组蛋白rHs-BD1,对开展黄沙鳖病害绿色防治及稳定和发展黄沙鳖养殖产业具有重要意义。但有关蛋白纯化条件优化及重组蛋白rHs-BD1的毒理作用仍需深入探究,以便将研究结果更好地应用于生产实践。
4 结 论
基于Hs-BD1基因成熟肽序列成功构建了pCold-TF-Hs-BD1原核表达载体。经大肠杆菌原核表达的重组蛋白rHs-BD1主要为可溶性表达,其分子量约58.1 kDa。经纯化的重组蛋白rHs-BD1含量为400.0 μg/mL,具有一定的广谱抗菌活性和抗氧化能力,对黄沙鳖血细胞的溶血作用相对较弱,且对机体毒副作用较低,可用于新型黄沙鳖抗菌药物开发。
