基于SSR标记的花菜类作物遗传多样性及群体结构分析
2022-10-28卢俊浩木万福张建华黄晓蓉管俊娇
卢俊浩,张 婷,张 鹏,木万福,杨 龙,张建华,黄晓蓉,,寸 婕,,管俊娇
(1.云南大学资源植物研究院,昆明 650504;2.云南省种子管理站,昆明 650031;3.云南省农业科学院质量标准与检测技术研究所,昆明 650205;4.云南省农业科学院热区生态农业研究所,云南 元谋 651300;5.云南省农业科学院粮食作物研究所,昆明 650205)
【研究意义】花菜类作物包括青花菜(BrassicaoleraceaL.var.italicPlenck)、花椰菜(B.oleraceaL.var.botrytisL.)和芥蓝(B.oleraceaL.var.alboglabra)、结球甘蓝(B.oleraceaL.var.capitataL.)等,由甘蓝野生种经过自然和人工的双重选择形成的不同的栽培类型[1]。该类作物起源于欧洲的地中海沿岸地区,19世纪起中国从国外引进品种,经多年驯化栽培,已育出若干地方特色品种[2]。由于花椰菜和青花菜含有丰富的维生素、矿物质、粗纤维等营养物质及独特的保健功能,多年来倍受消费者的青睐,其栽培面积不断加大,在蔬菜市场上占有越来越重要的地位[3]。种质资源是遗传育种的基础。尽管目前中国是世界上最大的花椰菜和青花菜的生产国和消费国,但是拥有的种质资源非常匮乏,优良新品种的选育进程有一定程度滞缓[4],亟需加强花菜类作物品种资源和材料的共享、交流和评价,重视对遗传背景差异大、亲缘关系远的种质资源的发掘利用,对促进花菜类作物种业的发展有重要指导意义。【前人研究进展】前人利用不同分子标记技术和不同来源结构的种质材料群体,导致对花菜类蔬菜的分析结果一致性不高,如姚雪琴等[5]利用SRAP技术分析花椰菜遗传多样性及与其近缘种亲缘关系,认为花椰菜和宝塔花菜亲缘关系最近,青花菜次之,芥蓝最远;熟性是影响花椰菜品种资源类群的主要因素。刘运霞等[6]利用形态学标记和分子标记相结合的方法,将78份花椰菜材料按照熟性和花球性状进行了分类,为花椰菜育种提供理论依据。【本研究切入点】SSR分子标记技术是一种具有操作简单、重复性好、位点特异稳定性强,并且为共显性遗传,能在近缘种属之间通用等优点的DNA分子标记技术,已被广泛应用于玉米[7]、水稻[8]、马铃薯[9]、小麦[10]等大田作物的遗传多样性及群体结构的研究,使新品种选育效率有较大提高。目前国内花菜种质资源匮乏,遗传多样性狭窄,主栽品种依赖进口,亟需加快优良新品种的选育进程。【拟解决的关键问题】本研究采用SSR标记对96份花菜类作物种质材料的遗传多样性和群体结构进行分析,以期揭示花菜品种间的遗传差异和亲缘关系,为提高优异种质资源利用效率和杂交亲本的选配提供参考。
1 材料与方法
1.1 试验材料
试验材料选取花椰菜、青花菜品种材料共96份(表1)。其中,花椰菜材料有72份,包括7份主栽品种材料(No.30、No.47、No.48、No.49、No.63、No.67、No.69)、29份松花菜亲本自交系和36份松花菜杂交一代材料;青花菜材料有24份。
表1 96份供试材料基本信息

续表1 Continued table 1
1.2 DNA的提取
采用改良CTAB法[11]提取植株幼嫩叶片总DNA,分别用琼脂糖凝胶电泳和紫外分光光度计进行DNA纯度、质量和浓度检测,稀释DNA浓度至20~30 ng/μL,作为SSR电泳的模板。
1.3 引物的设计和筛选
依据前人[12-16]研究公布的甘蓝类微卫星遗传标记,经过初筛,在每条染色体上均匀选择1~3对,最终共筛选22对SSR荧光标记引物(表2)用于遗传多样性检测。引物由上海擎科生物有限公司提供。
1.4 PCR体系与毛细管电泳荧光检测
PCR总反应体系为10 μL,包括2×mix混合液5 μL、10 mol/L正向引物0.3 μL、10 mol/L反向引物0.3 μL、样品DNA 1 μL、超纯水3.4 μL。PCR扩增程序为94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次,72 ℃下延伸10 min,4 ℃保存。
扩增产物在毛细管荧光电泳系统AB3730XL DNA分析仪(Applied Biosystems,USA)上检测。用GeneMapper Ver.3.7(Applied Biosystems,USA)对原始数据进行统计和校正,读出每个样品各位点的等位变异片段大小数据。
1.5 数据统计与分析
利用软件Popgen 32和软件PowerMarker 3.25计算对应引物的观察等位基因数(Na),有效位点数(Ne)、Shannon’s 信息指数(I)、观测杂合度(Ho)、期望杂合度(He)、多态性指数(PIC)、基因多样性(GD)和Nei’s遗传距离,并按非加权配对法(UPGMA)进行聚类分析。分析结果使用在线软件iTOL(https://itol.embl.de/)进行优化。以软件Structure 2.3.4推断材料构成群体的遗传结构,采用混合模型设置K值范围为1~10,每个K值运算重复10次,将MCMC(Markov Chain Monte Carlo)设置10000次迭代,初始burn-in次数为50000次,计算Q值。参考Evanno等[17]的统计模型进行分析计算ΔK,由ΔK来确定最优群体数K。
表2 22对SSR引物基本信息
2 结果与分析
2.1 SSR标记多态性分析
毛细管电泳检测结果显示,22对SSR引物在96份材料的DNA样品中共扩增出91个等位位点,平均每对引物为4.136个位点(表3)。96份材料的群体有效等位基因数(Ne)变异范围在1.043~3.489,平均为2.246;Shannon’s信息指数(I)和基因多样性(GD)的变异范围分别为0.101~1.720和0.041~0.766,平均值分别为0.909和0.496;观测杂合度(Ho)和期望杂合度(He)的变异范围分别为0~0.573和0.041~0.766,平均值分别为0.278和0.496;22对引物扩增产物的多态性信息含量(PIC)值变异范围在0.040~0.735,平均值为0.443,其中PIC值大于0.5的高多态性引物有10对,表明该10对引物在96份材料群体中的扩增多态性较高,可用于花菜类种质资源的鉴定和研究。
2.2 群体的遗传多样性分析
根据96份种质材料的花球性状,将其分为2个组群,即组群1:青花菜和西兰苔(24份)和组群2:花椰菜(72份)。对2个组群SSR标记多态性进行分析,结果显示(表4),组群1和组群2的观察等位基因数值(Na)分别为2.727和3.091;有效等位基因数(Ne)分别为1.910和1.841;Shannon’s 指数(I)分别为0.675和0.667。表明经过高强度的人工选择,花菜类作物2个组群的遗传多样性均不够丰富。
2.3 聚类分析
利用软件PowerMarker计算Nei’s遗传距离,按非加权配对法(UPGMA)进行聚类分析。结果显示全部材料可划分为2个组群(图1),第Ⅰ组为1份西兰苔材料和23份青花菜材料。西兰苔来源于青花菜与芥蓝的杂交后代,亲缘关系较近,被聚到同一组内。其中“女神”(No.19)与“NS女神”(No.68)遗传距离最小仅为0.0080,为不同来源的同一品种;其次是“翡翠11号”(No.55)和“雅翠91”(No.66)遗传距离为0.0130;“贝绿美”(No.50)和“祥云90”(No.63)的遗传距离最大,为0.6896。
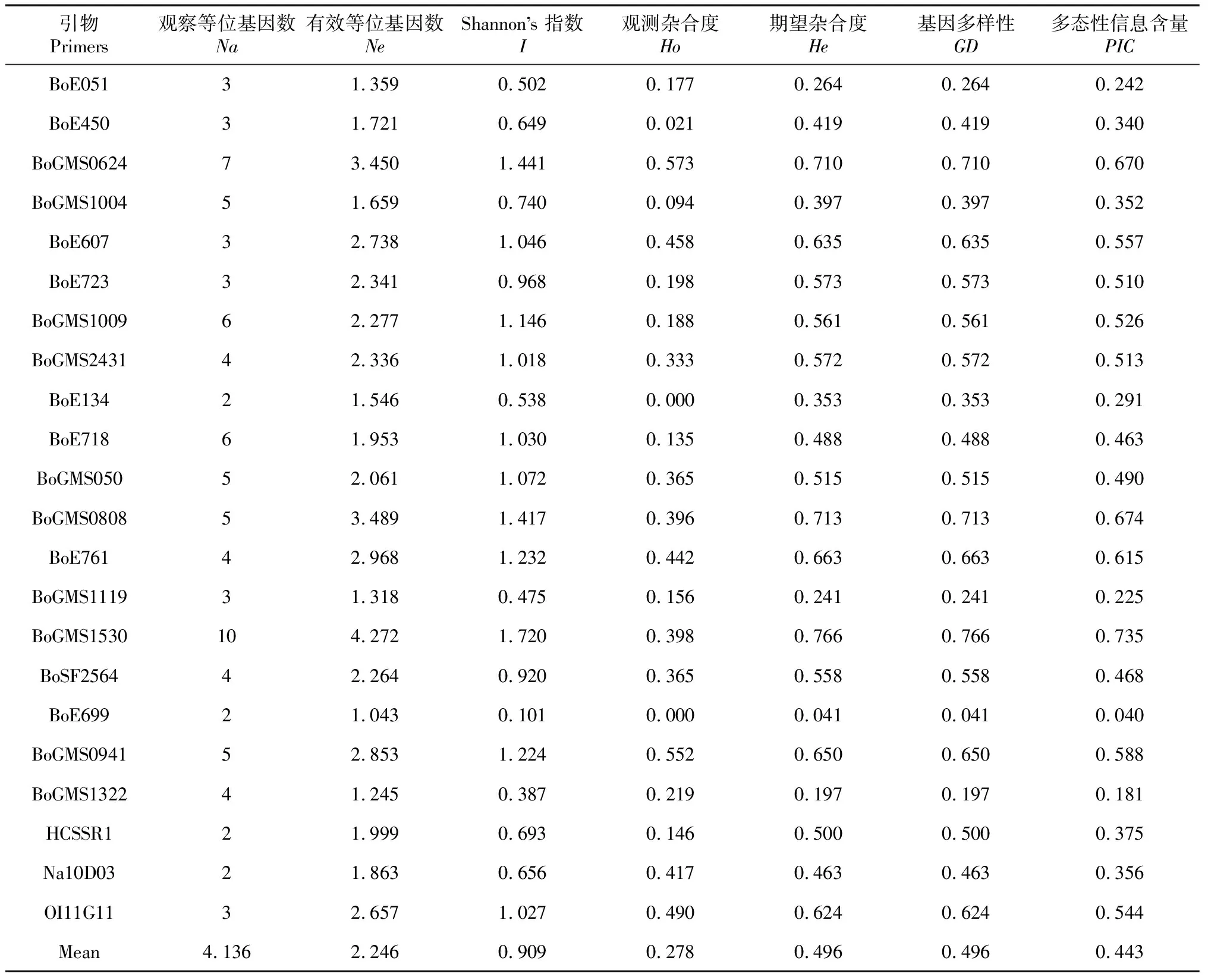
表3 22对SSR标记引物遗传信息统计

表4 群体材料的遗传多样性
第Ⅱ组包括全部的花椰菜材料。作为亲本的29份自交系分别被聚到了4类亚群,第1类仅1份材料No.17,第2类中有11份材料,第3类中有4份,第4类中有7份。在各类中的自交系材料彼此之间的遗传距离较小,如No.21与No.22遗传距为0.0418,为同一个品系分出来的不同材料,仅1个性状上存在差异,表现为一个叶片有蜡质,一个无蜡质。杂交亲本配组时,用不同类中的材料进行杂交,可获得杂种优势。材料No.17与其他28份材料的亲缘关系较远,利用这个材料与其他材料杂交,更有可能获得突出的杂种优势。
综上,96份花菜种质资源总体遗传多样性较低,但部分材料存在较大的遗传多样性,为供试材料在杂交亲本选配利用方面提供了参考。
2.4 群体遗传结构分析
利用均匀分布在花菜基因组9条染色体上的22对SSR标记引物对96份种质材料进行群体遗传结构分析。由图2-A和图2-B可以看出,随着K值的增加,lnP(D)值也持续增加,当K=2时,ΔK出现明显的峰值,最大值为1658.48,表明可以将96份花菜资源划分为2个组群(图3):第1组群(图3红色部分)共24份,包括23份青花菜杂交一代品种和1份西兰苔材料;第2组群(图3绿色部分)共72份,为全部的花椰菜材料。
群体百分比Q值越大,说明该资源材料遗传背景相对单一,否则认为该资源材料遗传背景相对较复杂[18]。群体结构的分析结果显示,96份花菜材料的Q值均大于0.6,说明该花菜资源的遗传结构较为单一,可以清楚的划分到不同组群中。群体结构分析结果与聚类分析的结果基本一致。
3 讨 论
3.1 SSR标记评价
随着分子标记技术的发展,分子标记技术在花菜类作物中得到应用,其中SSR标记是应用较多的技术之一[19]。本试验毛细管电泳检测结果显示,22对引物在96份材料中共扩增出91个等位位点,平均每对引物为4.136个;22对引物扩增产物的PIC值平均值为0.443,其中大于0.5的高多态性引物有10对。一方面表明毛细管电泳检测的灵敏度较高,另一方面表明所选引物在96份材料群体中的扩增多态性较高,可用于花菜类种质资源的鉴定和研究。前人的研究中,SSR标记技术在玉米、水稻中的实际应用价值也得到了验证[20-21]。SSR标记技术具有操作简便、多态性高、成本较低[22],在种质遗传多样性研究中有广阔的应用前景。
3.2 不同种质材料的遗传多样性
种质资源是进行新品种选育的重要因素,遗传基础过于狭窄往往会制约种质创新。本研究中,“西兰苔贝绿美”(No.50)来源于青花菜与芥蓝的杂交后代,与青花菜杂交种遗传距离更近,聚到青花菜组内。花椰菜杂交种“亚松20007”(No.73)、“亚松20008”(No.74)、“亚松19001”(No.86)分别与主栽品种“强雪”(No.47)、“庆扬90”(No.48)、“亚非100”(No.49)之间的遗传距离较小,亲缘关系较近,相互渗透,具有相似的遗传背景。目前大部分的品种都由个别自交系培育而来,加上在人为选择和环境不适宜导致所选育出的品种遗传相似度较高,品种遗传多样性低,遗传差异小[23]。盛小光等[15]研究表明,花椰菜和青花菜被清晰地分到了两个极端,两者之间没有交叉,群体内的遗传变异丰度低,是经过长期高强度的人工选择后,形成了相对独立的栽培类型;刘春晴等[24]将青花菜、松花菜、紧花菜和芥蓝145份材料,按亲缘关系分成了4个类群,类群内品种间的遗传多样性较低,与本研究结果一致。因此,在今后的研究中,需要扩大群体的范围,尽可能挑选遗传背景不同、亲缘关系相对较远的材料作为亲本,提高杂种优势,选育出优良创新品种。也可以利用SSR标记构建花菜类作物种质资源的DNA指纹图谱,以更高效地区分该类作物地品系或品种,对杂交种纯度鉴定和品种保护等方面具有重要意义。
3.3 遗传距离聚类和Structure模型聚类结果比较
种质遗传聚类方法有多种,包括遗传遗传距离法、相似系数法、模型聚类法等,选择不同的方法也会导致分析结果不同[25]。本研究通过Nei’s遗传距离按非加权配对法(UPGMA)将96份花菜材料划分为2个组群,分别包括24份青花菜和72份花椰菜材料,从聚类分析图上来看,花椰菜和青花菜被清晰地分到了两个组群,进一步说明了这两个组群是相对独立的栽培类型。同时基于Structure模型的群体遗传结构分析也将这些材料分为两个组群。这与前人[15,23]的研究结果一致。
研究发现,Structure软件的群体结构分析可以避免人为因素对类群划分的影响,进而对材料群体的遗传结构进行校正,有利于研究种质间的遗传关系,将类群划分更加细致[26]。而结合聚类分析和Structure模型聚类法能更准确地确定多份种质间的亲缘关系。
4 结 论
本研究选用22对SSR引物,利用毛细管电泳荧光检测技术对96份青花菜、花椰菜材料的遗传多样性和群体结构进行了分析,96份种质材料群体内遗传多样性不丰富,根据遗传距离并按UPGMA的方法聚类,可以将96份材料划分为花椰菜和青花菜2个组群,与Structure模型群体遗传结构分析结果一致。花椰菜自交系被分到了4个亚群,但在各亚群中材料之间的遗传距离较小,杂交组配时,可以选用不同亚群的自交系进行组配,以获得更大的杂交优势。本试验为青花菜、花椰菜在杂交亲本选配、育种研究等方面提供了参考。
