鲁丽苹果植株再生体系的建立
2022-10-28袁嘉玮田时敏张战备梁哲军山西农业大学棉花研究所山西运城044000果树种质资源创制与应用运城市重点实验室山西运城044000
张 健, 王 璐, 袁嘉玮, 田时敏, 张战备, 梁哲军(1.山西农业大学棉花研究所, 山西 运城 044000;2.果树种质资源创制与应用运城市重点实验室, 山西 运城 044000)
我国对苹果高效离体再生的研究始于20世纪90年代,近年来得到快速发展,目前已建立嘎啦、乔纳金、宫藤富士、鲁加6号等品种以及珠美海棠、M 26、BP-176、M 9 T 337等砧木的再生体系[1-3]。在上述体系研究中,基因型、植物生长调节剂种类及配比、培养基种类、碳源种类和培养条件都是诱导苹果植株再生过程中的主要影响因素。植物生长调节剂常以细胞分裂素和生长素配合使用,其中6-BA、IBA和TDZ以其较高的活性和稳定性在组培工作中受到了广泛的使用。在周爱琴等[4]研究中,柱形苹果品种鲁加5号体细胞胚的诱导使用6-BA 1.0 mg/L+NAA 5.0 mg/L+TDZ 0.5 mg/L效果最佳。高兵等[5]在嘎啦叶片离体诱导再生的相关研究中,使用2,4-D 2.0 mg/L+NAA 0.5 mg/L+IBA 2.0 mg/L效果最佳。在碳源的选择上,孙清荣等[6]发现不同基因型砧木品种适宜的碳源存在差异,54-118的最适碳源为蔗糖,而BP-174和M 9 T 337的最适碳源为山梨醇;在叶片处理方式上,叶片经横切、纵切、切块等不同方式处理后,诱导再生的效果无明显差异。而在诱导培养的初期通过暗处理的方式可产生大量分化潜力较大的愈伤组织,处理时间通常以14~21 d为宜[7-8]。苹果的基因型决定了其离体叶片再生能力的强弱,是限制苹果叶片高效再生体系的关键因素,再生频率达到85%以上的品种较少,从而造成转化效率极低的结果,限制了该技术的应用。再生能力与基因型之间的关系尚不明确,仍需不同品种再生体系的建立予以佐证。
鲁丽苹果作为中早熟苹果新品种,具有优质、丰产、广适、抗逆等突出特点,是当前中早熟苹果更新的首选品种之一。但目前尚无其组培及叶片再生体系的相关研究,制约了该品种的快速发展。在本试验前期研究中,以Bai-Quan Li等[9]研究报道的嘎啦叶片再生体系对鲁丽叶片进行再生培养后发现其并非完全适用于鲁丽。因此本试验以鲁丽嫩茎为材料建立无菌苗体系,进一步以无菌苗叶片为试材,建立鲁丽苹果离体叶片再生体系,以期为该品种的组培快繁和遗传改良提供参考。
1 材料和方法
1.1 试验材料
以山西农业大学棉花研究所杨包试验基地果树资源圃中栽植的鲁丽苹果为试材。试验基地位于山西省运城市盐湖区,试验地年均气温11.9 ℃,年降雨量约500 mm,无霜期约190 d。供试品种为5年生鲁丽,南北行向定植,株行距为4 m×1.5 m,树体整形方式为主干型。常规管理,灌溉方式为微喷灌。
1.2 方 法
1.2.1试管苗的建立
5月上旬,剪取大田一年生幼嫩枝条,去除叶片后首先将嫩茎依次进行自来水冲洗30 min、洗洁精清洗10 min、自来水漂洗。清洗干净的茎段用75%的酒精处理30 s,再于0.1%的HgCl2溶液中分别处理3 min、5 min、8 min和10 min,处理后用无菌水冲洗5遍接于MS培养基,每个处理5瓶,每瓶5株。15 d后统计污染率,30 d后统计成活率。培养条件:温度(25±2)℃,光照强度2 000 lx,光照时间16 h/d,下同。
1.2.2试管苗的增殖
茎段在启动培养基培养30 d,诱导产生无菌芽苗,将其转入继代培养基中。继代培养基以MS为基本培养基(附加30 g/L蔗糖和7 g/L琼脂),IBA浓度采用0.1 mg/L,6-BA浓度分别为0(ck)、0.2、0.4、0.6、0.8、1.0 mg/L,pH值5.8。每个处理接种5瓶,每瓶5株,继代3次统计增殖系数和玻璃化率。
1.2.3离体叶片不定梢诱导
剪取继代30 d的健壮试管苗顶端第2、3片展开叶,用手术刀在垂直于叶脉的方向将叶片割伤,转接在叶片不定芽诱导培养基上。暗培养15 d后转入光照培养16 h/d,45 d后统计再生频率和再生叶片平均再生芽数。不定芽再生培养基以MS为基本培养基,碳源为30 g/L的蔗糖、葡萄糖和D-山梨醇,植物生长调节剂为IBA(0.3、0.5 mg/L)、6-BA(2、4、6 mg/L)和TDZ(2、4、6 mg/L)构成24个处理,每个处理5瓶,每瓶10片叶。
1.2.4试管苗生根诱导
选择在继代培养中株高2 cm左右的试管苗转入生根培养基,暗培养7 d后转入不含植物生长调节剂的1/2 MS培养基中进行培养,25 d后统计生根率和生根条数。生根培养基以1/2 MS培养基为基本培养基,碳源为20 g/L的蔗糖、琼脂7 g/L,pH值5.8,植物生长调节剂为IBA(0.4、0.6、1.0 mg/L)、IAA 0.1 mg/L构成7个处理,每个处理3瓶,每瓶5株。
1.3 统计分析
本实验数据采用Excel 2010软件进行处理,并采用SAS软件对数据进行分析。
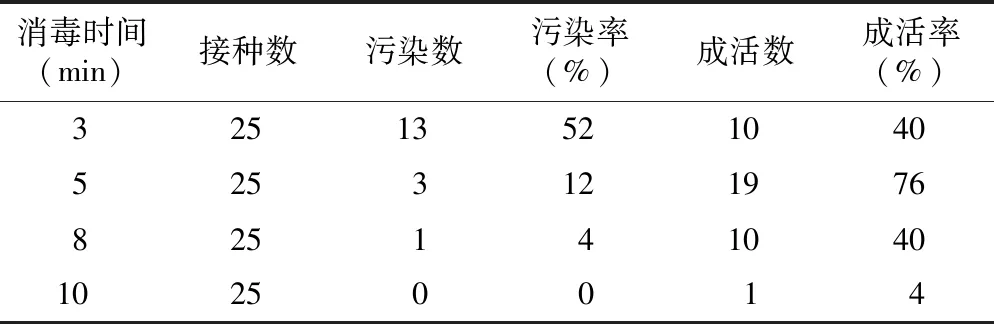
表1 HgCl2消毒时间对鲁丽外植体消毒效果的影响Table 1 Effect of disinfection time of HgCl2 on the Luli explants stertlizing
2 结果与分析
2.1 试管苗的建立
使用0.1% HgCl2溶液对鲁丽外植体进行处理,处理3 min的污染率最高,为52%,处理10 min的污染率最低,为0。HgCl2处理时间过短无法完全杀死外植体表面细菌,处理过长会增加对外植体的毒害作用致其死亡。因而选择成活率最高的处理为最佳处理方式,即75%酒精处理30 s后0.1% HgCl2处理5 min。
2.2 细胞分裂素6-BA浓度对鲁丽试管苗增殖的影响
6-BA浓度在0~1.0 mg/L的范围内,试管苗增殖系数随6-BA浓度的升高而增加,处理间差异显著。0.8 mg/L和1.0 mg/L两个处理的增殖系数均大于7且显著高于其他处理。当6-BA浓度达到1.0 mg/L时,试管苗玻璃化率达到最高,为20.2%,此时部分丛生芽表现出质地较脆、叶片肥大的玻璃化特征。而6-BA浓度为0.8 mg/L时,丛生芽长势较好,苗色翠绿,苗高适宜。因此适合于鲁丽试管苗增殖的植物生长调节剂配比为IBA 0.1 mg/L,6-BA 0.8 mg/L。
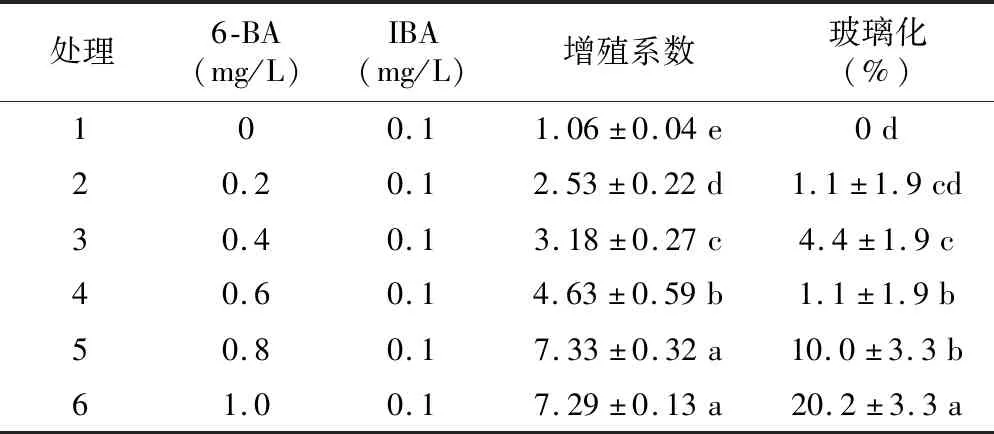
表2 6-BA和IBA浓度对鲁丽增殖的影响Table 2 Effect of different concentrations of 6-BA and IBA on the multiplication of Luli
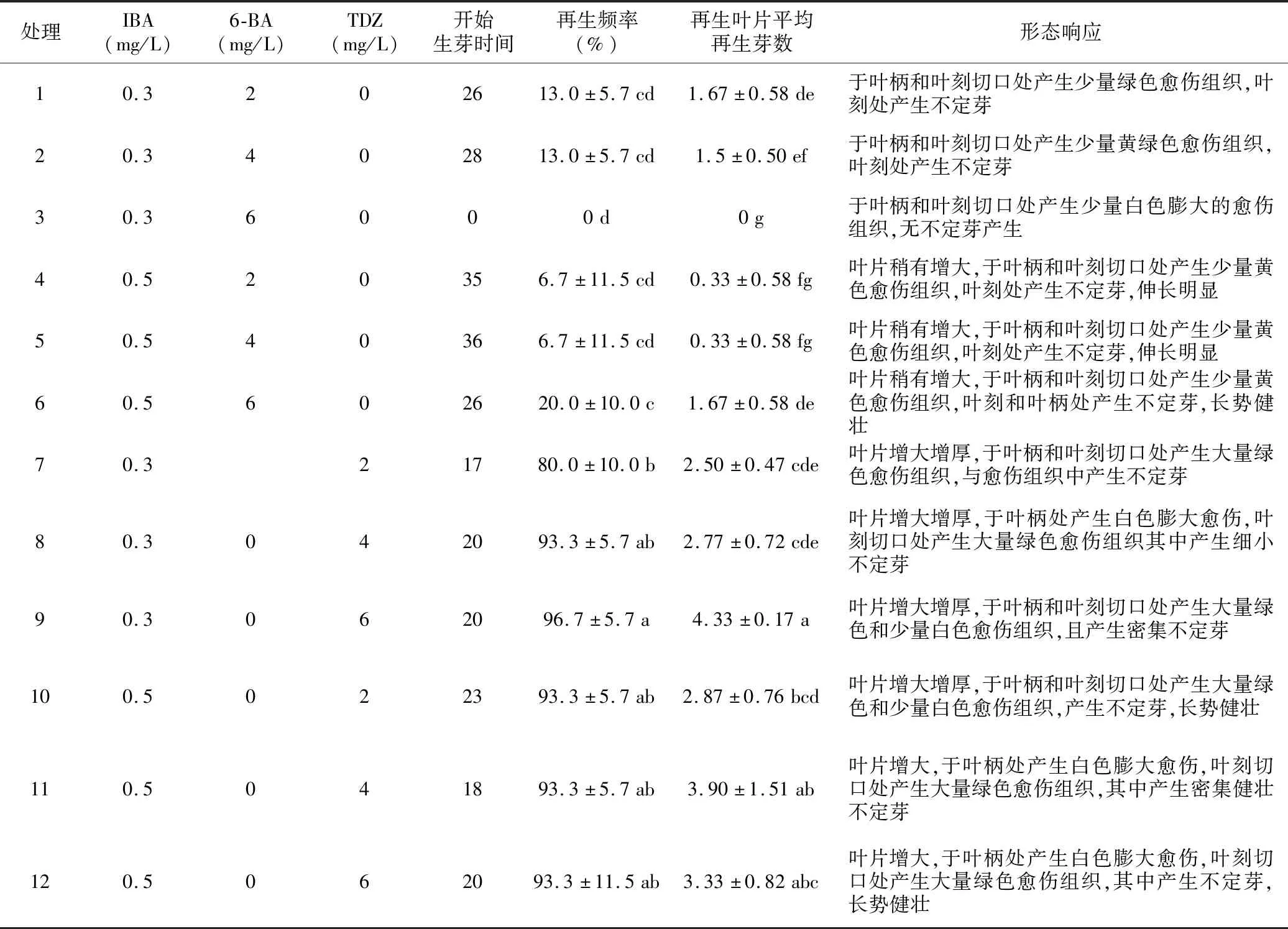
表3 不同植物生长调节剂组合对叶片再生的影响Table 3 Effects of different combinations of plant growth regulators on leaf regeneration
2.3 植物生长调节剂组合对鲁丽叶片再生的影响
在诱导鲁丽苹果试管苗叶片再生的过程中,首先表现为叶片不同程度增大增厚,于叶柄和叶刻部位膨大形成愈伤组织,再形成绿色颗粒状凸起,这些颗粒状凸起最终分化成为不定芽。以TDZ为细胞分裂素的处理其叶片再生频率和平均再生芽数均高于6-BA。
在以6-BA为细胞分裂素的处理中,IBA浓度为0.3 mg/L时,叶片再生频率和平均再生芽数呈现随6-BA浓度升高而降低的趋势,6-BA浓度达到6 mg/L时再生率和再生芽数显著低于其他处理,均降为0。而当IBA浓度为0.5 mg/L时,叶片再生频率和平均再生芽数有随6-BA浓度升高而升高的趋势,6-BA浓度达到6 mg/L时再生率为20%、平均再生芽数为1.67,显著高于其他处理。IBA浓度为0.3 mg/L时叶片增大程度较0.5 mg/L时小,且产生不定芽长势略弱于后者。说明IBA在叶片增大和不定芽生长中发挥作用较为明显,在诱导效率中需同6-BA协同发挥作用。
在使用TDZ为细胞分类素的处理中,当IBA浓度为0.3 mg/L时,叶片再生频率和平均再生芽数均随TDZ浓度升高而增加,其浓度达到6 mg/L时再生率达到96.7%、平均再生芽数达到4.33,显著高于其他处理。而当IBA浓度为0.5 mg/L时,各处理间叶片再生频率无明显差异,但IBA浓度高的处理其诱导产生不定芽的长势较低浓度处理健壮。细胞分裂素使用TDZ的处理,其叶片不定芽再生的时间早于使用6-BA的处理,又以处理7和处理11再生最早,这可能与IBA与TDZ浓度比有关。同时TDZ处理的叶片再生频率显著和再生叶片平均再生芽数均显著高于6-BA的处理。这表明TDZ比6-BA更有利于鲁丽苹果离体叶片的再生。综上分析,最适宜鲁丽苹果叶片离体再生的植物生长调节剂组合为TDZ 6 mg/L,IBA 0.3 mg/L。
2.4 不同碳源对鲁丽叶片再生的影响
在IBA和6-BA浓度一定的情况下,以葡萄糖作为碳源的处理其叶片再生频率最高达到40%,再生叶片平均再生芽数达到1.91,均略高于以山梨醇和蔗糖作为碳源的处理,但差异未达显著水平。
2.5 不同植物生长调节剂组合对试管苗生根的影响
不同浓度的植物生长调节剂对鲁丽试管苗生根率和平均根条数的影响不同。当生根培养基中仅添加IAA时,试管苗生根率最低,为13.3%,平均根条数最少,仅0.7。当培养基中同时添加IAA和IBA时,生根率和平均根条数显著高于仅添加一种生长素的处理,其形态为白色粗壮的根系,试管苗基部无膨大、仅有极少量的愈伤组织,同时其诱导根系出现的时间早于其他处理,其中,处理4的生根率达到100%,平均根条数为12.8。综上分析,鲁丽试管苗的最佳生根培养基为:1/2 MS+IBA 1.0 mg/L+IAA 0.1 mg/L。
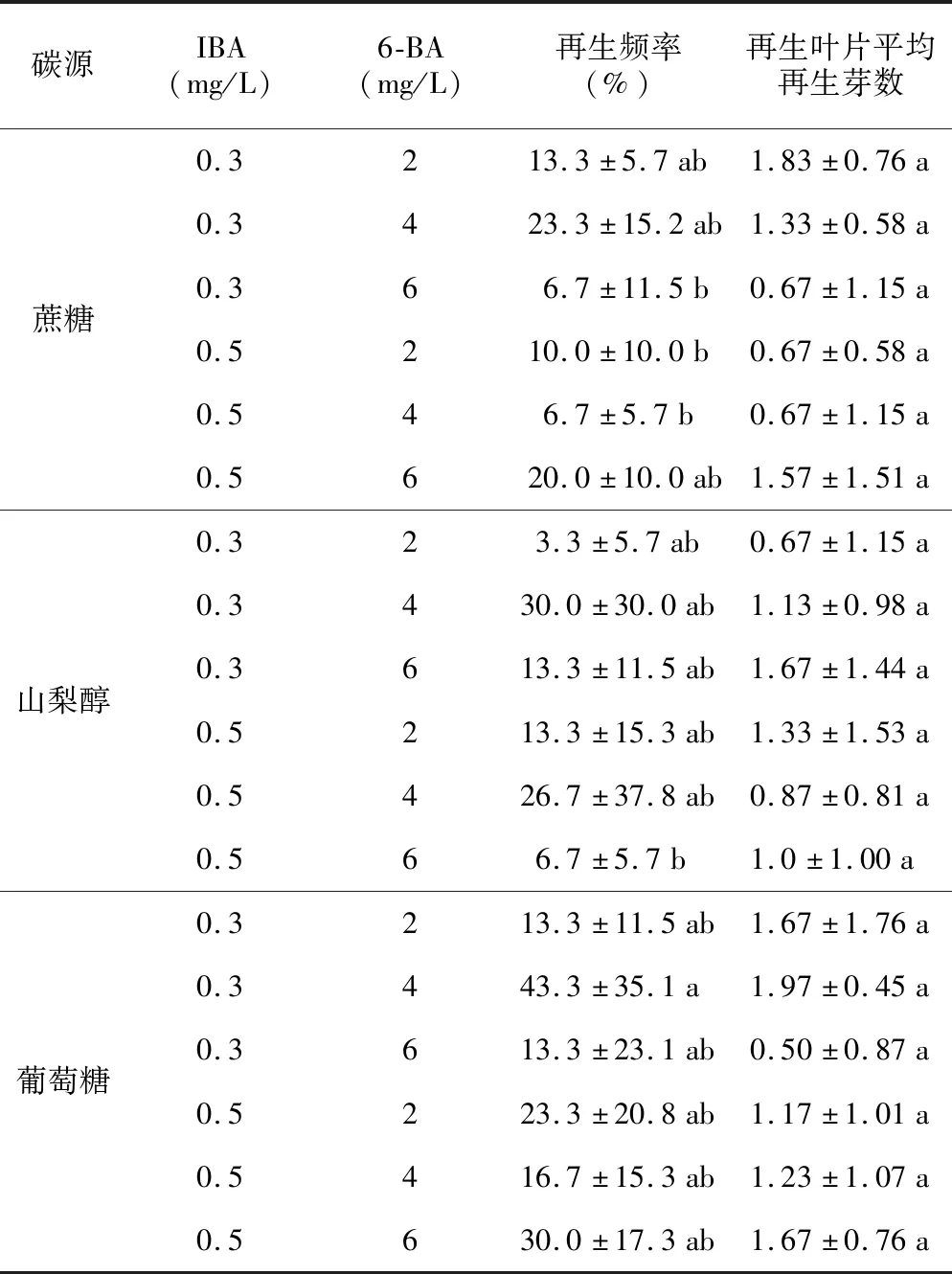
表4 不同碳源对叶片再生的影响Table 4 Effects of different carbon sources on leaf regeneration
3 讨 论
在已建立的相关体系研究中,常用的消毒试剂为75%的酒精和0.1% HgCl2溶液。但不同基因型外植体对消毒试剂的不同耐受程度,会导致消毒时间存在差异。如烟富6号、玉华早富、中秋王,砧木SH 6和M 9 T 337等消毒以新芽为外植体,0.1% HgCl2溶液的处理时间多为7~10 min[10-12];马冬菁[13]以红肉苹果茎尖和茎段作为外植体,与本试验结果相同,鲁丽品系外植体经0.1% HgCl2溶液处理的最佳时间同样为5 min。同品种间由于基因型不同,在消毒程序与培养过程中植物生长调节剂使用配比存在差异,植物生长调节剂在诱导组培苗生根的过程中作用效果显著,使用IBA、IAA植物激素处理嘎啦系品种可显著提高生根率[15]。因此在本试验条件下,将IBA和IAA配合使用,其浓度分别为1 mg/L和0.1 mg/L时生根率达100%,平均根条数为12.8,且根系粗壮洁白,其诱导结果优于单独使用,这说明两种植物生长调节剂在诱导生根的过程中发挥协同作用。但其所生根系与茎之间仍有少量愈伤的存在,可能造成根部的维管束与茎内维管束无法连通,影响营养物质的运输,导致移栽成活率的下降。
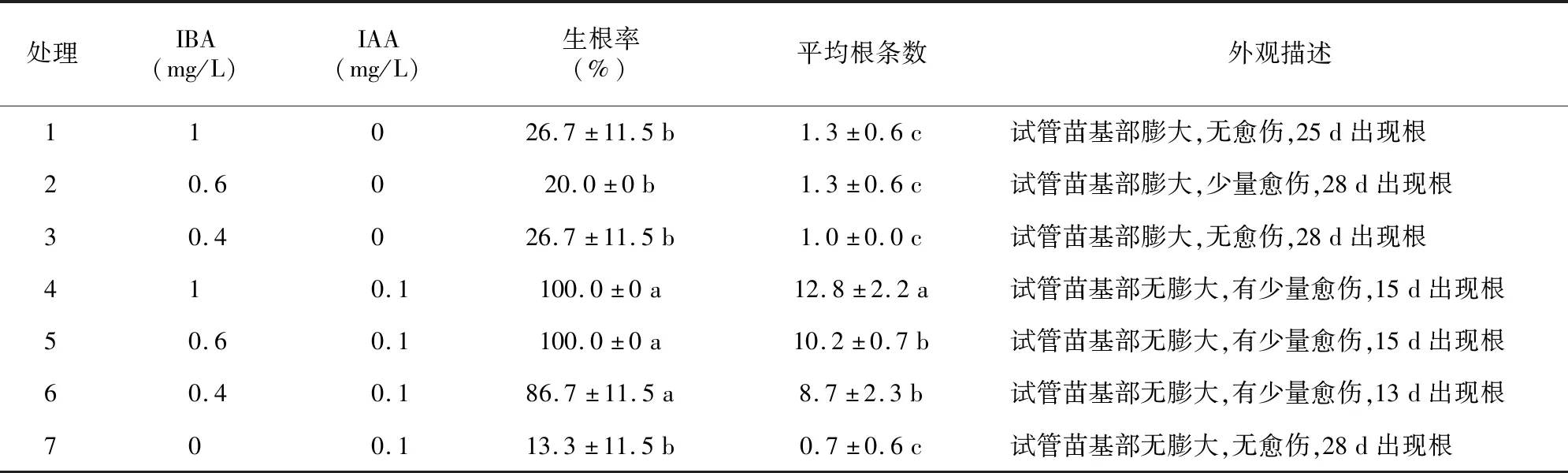
表5 不同植物生长调节剂组合对试管苗生根的影响Table 5 Effects of different combinations of plant growth regulators on rooting of test-tube seedlings

图1 鲁丽苹果试管苗增殖与生根Fig.1 Proliferation and rooting of in vitro shoots of Luli apple
本研究在利用形态学响应分析鲁丽苹果叶片离体再生的发生途径中发现,鲁丽离体再生过程中细胞分裂和分化的生理过程受细胞分裂素和生长素调控。本试验中T 7和T 11的不定芽在诱导20 d以内出现,早于其他处理,且TDZ为细胞分裂素的处理再生效率远高于使用6-BA的处理。说明TDZ与IBA共同作用于离体的叶片再生的诱导过程且诱导活力与其浓度比有关。在早期的研究中认为TDZ具备类细胞分裂素的活性[16],也有研究表明TDZ通过调节植物内源细胞分裂素和生长素的合成从而影响相应生理过程[17-18]。TDZ发挥细胞分裂素活性的同时也促进了植物内源生长调节剂的合成与积累,导致其在离体叶片诱导过程中表现出高效再生的效果。但经TDZ诱导后植株不定芽细小而密集,伸长生长不足,在继代培养过程中需要将其转接至6-BA的培养基中培养,以促其伸长生长。
已有研究中,珠美海棠叶片再生最适宜的碳源为果糖[19],砧木BP-176和54-118最适宜的碳源是山梨醇[6,20],而大部分的果树芽再生诱导中最适宜的碳源是蔗糖,这可能与基因型差异试材对不同碳源物质响应不同有关,葡萄糖、蔗糖、果糖等碳源均是具备信号分子功能的细胞代谢因子,受基因调控影响植株生长发育[21]。在培养基的制备过程中,碳源经高温灭菌之后形成了不同的渗透压和pH,从而影响了叶片再生过程中营养元素的吸收和植物生长调节剂的调控。在本研究中最适宜的碳源是葡萄糖,表明鲁丽叶片更适应葡萄糖灭菌后形成的培养环境,从而影响了其再生的效率。再生途径一般分为器官再生途径和体细胞胚途径。本研究通过分析诱导过程的形态学响应发现叶片再生诱导的过程中,先产生愈伤组织,诱导的非胚性愈伤呈现白色和疏松膨大的状态,而胚性愈伤呈现黄绿色或绿色的状态,这与陈春玲等[22-23]的研究结果一致。但其再生途径为芽再生途径还是体细胞胚再生途径,还需在组织细胞学水平进一步研究确定。
4 结 论
以鲁丽苹果嫩茎为外植体适宜的消毒方式为75%酒精处理30 s,0.1% HgCl2溶液处理5 min;试管苗增殖的最适培养基是MS+6-BA 0.8 mg/L+IBA0.1 mg/L+30 g/L蔗糖+琼脂7 g/L;叶片离体再生的最适培养基为:MS+IBA 0.3 mg/L+TDZ 6.0 mg/L+蔗糖30 g/L+琼脂7 g/L,再生率达到96.5%,再生叶片平均再生芽数为4.33;1/2 MS+IBA 1.0 mg/L+IAA 0.1 mg/L+蔗糖20 g/L+琼脂7 g/L适用于生根培养,生根率为100%。本研究建立的鲁丽苹果组培快繁和叶片再生体系,为其组培快繁和遗传改良提供了技术参考,为离体叶片诱导芽再生的机理研究提供了先决条件。本体系的建立可加快促进北方苹果产业的发展,进一步助力注重产业优势和经济效益的果业结构性改革。

图2 鲁丽苹果叶片离体再生Fig.2 Adventitious shoot regeneration from leaf explants of Luli apple
