不同填充材料在眼眶骨折修复中的应用比较
2022-10-28张珺婷
张珺婷
( 辽宁省抚顺市眼病医院,辽宁 抚顺 113000 )
眼眶骨折最早是在1889年由Lang描述的。从那时起,已经有许多研究来评估这种损伤的机制。眶缘创伤(屈曲机制)导致较小的缺损,孤立于眶底内侧一半,眼眶内容物有一定的疝出[1]。直接创伤眼眶(水力机制)导致更大的缺损,包括眶底和眶内壁,以及严重的眶内容物突出。眶底骨折是颅脑颌面部创伤的常见病。单纯性眶底骨折约占所有面部骨折的10%,其中涉及眼眶的面部骨折约占30%-40%。眼眶骨折是头面部骨折的高发部位[2]。有研究报道[3],264眼眶骨折患者中高发年龄主要集中于31-40岁(25.7%),其次为11-20岁患者占比为22.0%,以及21-30岁患者占比为21.6%;该类型主要病因前5名由高到低依次为交通事故(36.4%)、攻击伤(32.5%),跌倒(27.3%),工伤(1.9%)以及运动损伤(1.9%);患者多表现出创伤区域疼痛、视力下降、眼周水肿、瘀斑等临床症状及体征。流行病学统计显示,眶底骨折的骨折碎片常损伤或压迫眶下神经,引起受支配区域麻木。眼眶骨折可以单独发生,也可以合并其他颌面部骨折,同时发生骨折,如颧骨骨折、额骨骨折或上颌骨折等[4]。治疗眼眶骨折目的在于复位嵌顿,并修复眶壁缺损部位,改善眼部临床症状(包括眼球内陷、移位、运动障碍、复视等)。针对保守治疗不理想患者,临床推荐手术治疗。修复手术治疗效果与手术方案以及修复材料的选择有着密切关联性。随着医疗技术的进步以及医疗材料的改进,修复材料的应用选择越来越多,其中MEDPORE、可吸收板植入物属于近年来常用修复材料,且各有优劣势,但目前临床对于修复材料的选择及应用尚未达成统一共识,如何选择及应用修复材料仍然是当前研究的重要课题。基于此,本研究选取2017年5月-2020年5月我院收治的84例眼眶骨折患者,比较不同填充材料在眼眶骨折修复中的应用,旨在为临床筛选更加安全、可靠的修复材料提供参考意见。现报告如下。
临床资料
1 一般资料:选择2017年5月-2020年5月辽宁省抚顺市眼病医院收治的84例择期行修复手术的眼眶骨折患者,按随机数字表法进行分组,2组各42例。观察组42例,其中男32例,女10例;年龄33-56岁,平均年龄为(41.56±0.47)岁;骨折病因:交通事故24例、攻击伤10例、跌倒5例、工伤2例、运动损伤1例;左右眼损伤分布情况:左眼眶骨折22例,右眼眶骨折20例;损伤眶壁分布:均为单纯独立性眶壁骨折,其具体分布为眶内侧壁13例,眶外侧壁14例,眶底骨折10例,眶顶骨折5例。对照组男22例,女20例;年龄31-55岁,平均年龄为(42.03±0.38)岁;骨折病因:交通事故23例、攻击伤11例、跌倒5例、工伤2例、运动损伤1例;左右眼损伤分布情况:左眼眶20例,右眼眶22例;损伤眶壁分布:均为单纯独立性眶壁骨折,其具体分布为眶内侧壁14例,眶外侧壁13例,眶底骨折11例,眶顶骨折4例。对照组与观察组患者一般资料(性别、年龄、骨折病因、左右眼损伤分布情况、损伤眶壁分布情况)对比差异无统计学意义(P>0.05)。(1)诊断标准:参照《眼眶爆裂性骨折诊疗专家共识(2014年)》:患者表现出创伤区域疼痛、视力下降、眼周水肿、瘀斑等临床症状及体征,经影像学、眼科检查证实存在眼眶骨折。(2)纳入标准:①符合上述眼眶骨折的诊断标准;②患者符合修复手术治疗适应证,且经保守治疗后仍无法缓解,眼球(>2mm)内陷或移位,存在持续复视及软组织或眼外肌嵌顿,经被动牵拉试验证实为阳性;③患者及其家属自愿参与本研究,并在知情声明后签署同意书的患者。(3)排除标准:①患者中途退出研究者;②患有严重疾病;③伴随脑损伤、面部粉碎性骨折等严重骨折患者。
2 材料:(1)MEDPOR外科种植体(生产厂家:上海申旭仪器有限公司,批准文号:国食药监械(进)字2008第3461114号):孔隙容积达50%,在82℃盐水中可塑形切割,适用范围用于修复和再造手术。(2)可吸收网板(钛板和钛网(STRYKER,规格为1.7 mm))。
3 手术方法:对照组用MEDPORE填充材料填充骨折缺损区,观察组用可吸收板植入物填充骨折缺损区。具体操作如下:2组患者均在同一手术医师的全身麻醉下,采用结膜切口入路进行复位手术。下壁骨折皮肤切口在睑缘下2mm处,内眦皮肤(由轮匝肌下至眶下缘外侧5mm处)行切口分离治疗内壁骨折。应用电刀将眼眶下缘骨膜切开,分离眶缘,并沿着骨膜下边缘进行分离,直到眶后部,显露骨膜,将缺损暴露于骨膜下,充分暴露骨折边缘,完成上颌窦内嵌入的软组织及肌肉分离操作。内壁骨折:首先做一内直肌牵引缝线,选择患眼内眦部内上方做一手术切口,完成皮下组织切开及逐层分离,直到骨膜层,将骨膜切开并完成分离眶内壁骨折处嵌顿的软组织及肌肉,将其骨折边缘充分暴露。并根据断裂缺陷的大小和范围,选择适当大小和体积的填充物,根据需要进行形状切割,于直视下将修复材料放置于断裂区域骨膜外间隙处,确保植入物覆盖面积应略大于骨折缺损区域面积,且未压迫到软组织,对该修复材料应用螺钉进行固定。观察患者眼球突出程度,一般术眼比健眼突出2mm,若仍存在眼球凹陷问题,需要在眶壁缺损覆盖的修复材料内侧再次植入1块修复材料,对眼眶内容进行补充,并对其眼球内陷进行矫正;对于眶壁深部骨折患者需要再内镜观察辅助下将该修复材料覆盖于骨折边缘骨壁处进行固定。完成上述操作后需要进行被动牵拉试验,确保患者眼部无软组织嵌顿,再应用可吸收线进行眶缘骨膜、肌层、皮下及皮肤逐层缝合操作。术后2组均给予常规抗生素用药,并于术后2-3天进行眼球及眼肌运动训练。
4 观察指标:(1)对比2组术前术后眼球突出度差值:记录术前、术后2个月患者患侧与健侧眼球突出度差值。(2)手术前后2组患者的眼球内陷矫正率:参照诊断标准中,眼球内陷矫正标准为患侧与健侧眼球突出度差值≤2mm,>2mm视作不完全矫正。于术后2周、1个月、2个月统计矫正率。(3)复视情况:复视消失标准为眼球四方位(上下左右)转动30°时,眼球均为斜视且未引出。记录术后2周、1个月、2个月、1年复视率。(4)CT复查骨折的修复情况;观察2组影像学特征。(5)跟踪观察2组患者的术后并发症:常见并发症包括面中部麻木、植入物移位、眶蜂窝组织炎、残留眼球内陷等。
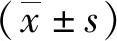
6 结果
6.1 2组术前术后眼球突出度差值对比:术前、术后2组眼球突出度差值均无统计学差异(P>0.05),术后眼球突出度差值低于术前(P<0.05)。见表1。
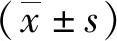
表1 2组术前术后眼球突出度差值对比
6.2 2组患者的眼球内陷矫正率对比:2组术后2周、1个月、2个月眼球内陷矫正率无统计学差异(P>0.05)。见表2。
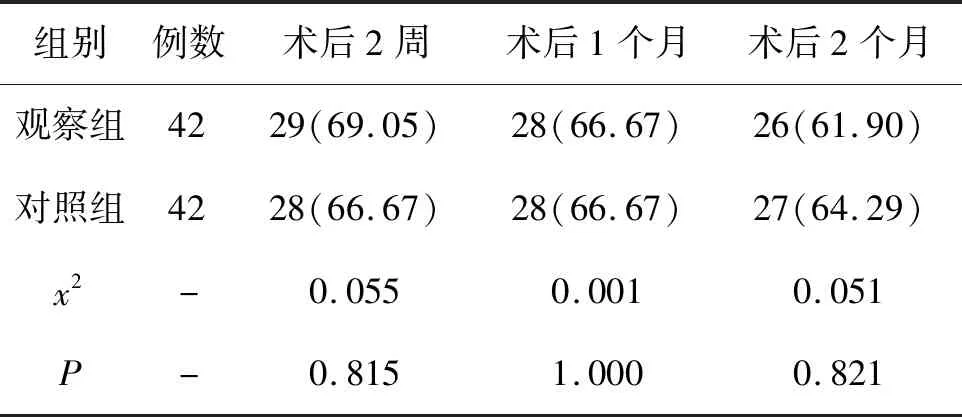
表2 2组患者的眼球内陷矫正率比较(n,%)
6.3 2组患者的复视情况对比:2组术后2周、1个月、2个月、1年复视率对比无统计学差异(P>0.05)。见表3。

表3 2组患者的复视情况比较(n,%)
6.4 2组患者并发症对比:随访过程中,观察组生物材料均未发生排斥反应、面中部麻木、植入物移位或感染等并发症情况,而对照组在术后1年出现1例迟发性眶蜂窝组织炎,1例植入物移位,经上颌窦开放术治疗取出该植入材料后患者出现明显好转。2组总并发症率对比无统计学差异(P>0.05)。见表4。
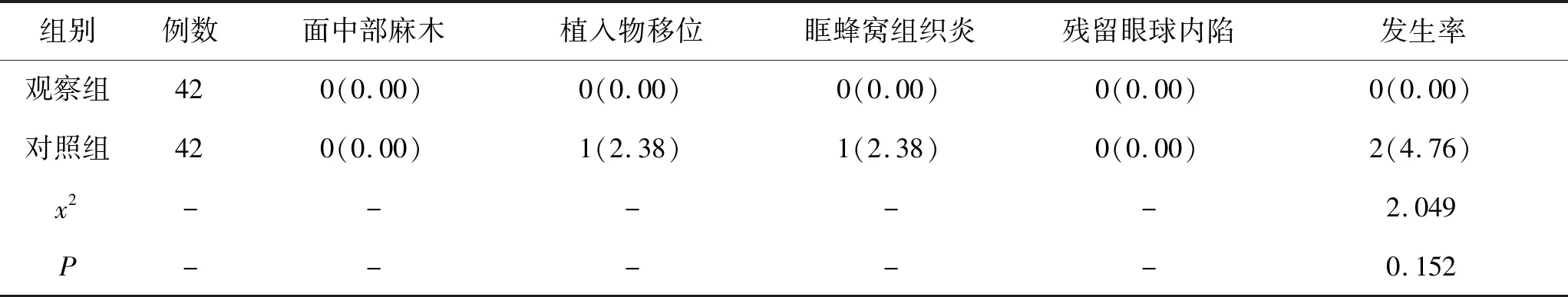
表4 2组患者并发症比较(n,%)
6.5 2组CT影像学结果对比:CT结果显示,可吸收植入网板材料修复的观察组患者术前CT图像呈现眶壁连续性中断,且骨折断端出现位移;而植入修复材料后,受损组织(嵌顿软组织)完全复位,吸收板在位,CT图像显影呈现高密度特征。MEDPOR修复的对照组患者植入材料相较于术前CT检查结果(清晰图像),其嵌顿软组织、肌肉均完全修复,CT图像显影呈现低密度特征。
讨 论
眼眶骨折属于常见的面中部外伤,其发病机制目前尚未完全明确,临床研究学说主要为“屈曲理论”、“水力学理论”2种学说,屈曲理论认为眼眶骨折原因在于某种影响眼眶边缘的力量并未发生断裂,而是引起屈曲运动性变形,且这种变形对眼窝壁内侧等薄壁产生形成骨折的力量;水力学理论认为眼眶骨折原因在于眼眶内压力增加,继而形成眶壁骨折[5]。骨折的严重程度从不需要手术干预的孤立壁的微小移位骨折到骨质严重破坏,导致出现眼周软组织的卡压及嵌顿。非共同性斜视引起复视是复杂的。这使得多方面治疗的选择变得复杂。内侧壁骨折和眶底骨折是最常见的骨折。内侧壁骨折常引起水平复视。垂直复视是眶底骨折的常见症状。在大多数病例中,这导致高度受限,在较小程度上导致凹陷受限。随着医学材料学的逐渐发展,使眶壁骨折整复手术得到不断完善。随着同种异体植入物的引入和生物相容性的提高,用于眼眶重建的材料发生了显著的变化。眼眶骨折后眼球内陷可导致明显的面部不对称。眼睑位置不正,包括下眼睑内翻、内翻或外翻,都可能发生在创伤和手术暴露骨折部位后。中壁和眶底合并骨折,可能会失去对眶的鼻下支持,造成眶容量重建的挑战。手术整复是治疗眼眶骨折损伤直接而有效的方法,修复手术可以尽快松解嵌顿的眼部软组织及眼外肌,降低眼部肿胀、粘连、缺血等风险;同时松解减压由于骨折压迫到的神经组织,促进眼眶下神经支配区域感觉障碍恢复[6]。选择用于治疗眼眶骨折组织重建的材料是影响手术效果的关键因素,但寻找合适的材料进行眼眶重建并非易事。在过去的几十年里,已经有大量的生物或合成物质经过测试可用于临床,外科医生可以根据需求选择相应的材料来治疗眼眶骨折。自体移植物、异体移植物以及人工合成材料等是当前已知的用于眼眶整复的主要类别。目前根据实际情况和个人经验在术中临时对植入材料进行手工切削是大多数临床医生在眼眶整复手术中的操作方法,植入材料尺寸的精确性无法保障。眼眶的解剖结构复杂特殊,骨折状态没有规律,为了提高眼眶整复的治疗效果,需要寻求一种能够个性化定制的理想植入材料。结合眼眶特殊解剖结构和和复杂的组织构成,理想的眼眶整复植入材料应满足:(1) 良好的生物相容性;(2) 可靠的力学特性,足以支持眼眶内容和相关的压力;(3) 易塑形,以填补缺损部位恢复生理解剖;(4) 良好的促血管化作用和成骨诱导;(5) 降解速率与缺损部位新骨生成相匹配;(6) 在缺损部位植入安装简便,不易移位。眼眶骨折的修复材料有很多种[7],MEDPOR填充材料以及羟基磷灰石为临床常用修复材料,上述材料均为不可吸收的异质材料。羟基磷灰石复合物有很多优点:最首要的就是它的生物相容性好,并且在术后的CT检查中影像清晰,有利于术后观察。缺点:非常坚硬,从而导致在手术应用中难以成形和切割,并且表面不光滑,易于在植入过程中对组织造成2次损伤。MEDPOR属于临床常用高分子植入性修复材料,其工作机制是通过内部相互连接孔径结构,促使毛细血管长入,并使得植入部位可以快速完成血管化。MEDPOR外科植入物的优点是该材料开放性多孔结构易生长到软组织、血管中,可与眼眶壁贴合良好,并且易于成形和切割。其缺点在于CT检查中不能显影,不利于术后效果评估,且不可吸收异质材料极易诱发慢性炎症反应,对于大范围缺损骨折支撑力较弱[8-10]。可吸收板植入物优势在于具有良好的组织相容性,更薄,且术后可以刺激其周围结缔组织生长桥接纤维组织,逐渐被吸收形成致密瘢痕组织,继而替代患者原发骨壁缺损区域;无需2次手术取出,降低再次手术风险及患者家庭经济负担;但该材料存在费用相对高昂,对于大面积眶壁缺损治疗效果不够理想等局限性[11-12]。本研究中采用MEDPOR填充材料、可吸收板植入物材料对照。研究结果显示,术前、术后2组眼球突出度差值均无统计学差异(P>0.05),术后眼球突出度差值低于术前(P<0.05)。2组术后2周、1个月、2个月眼球内陷矫正率无统计学差异(P>0.05)。2组术后2周、1个月、2个月、1年复视率对比无统计学差异(P>0.05)。说明可吸收板植入物和MEDPOR外科种植体在眼眶骨折修复中的效果相当。随访过程中,观察组生物材料均未发生排斥反应、面中部麻木、植入物移位或感染等并发症情况,而对照组在术后1年出现1例迟发性眶蜂窝组织炎,1例植入物移位,经上颌窦开放术治疗取出该植入材料后患者出现明显好转。2组总并发症率对比无统计学差异(P>0.05)。残留眼球内陷属于修复手术常见并发症,其形成原因主要与填充眶壁缺损未完全修复成功有关,而充填材料出现移位或量不足以矫正骨折均可能导致病灶软组织出现萎缩。而本研究中较为少见,可能与植入物放置靠前有关。而MEDPOR组出现感染,可能与其本身属于不可吸收材料有关。由于修复材料属于不可吸收材料,人体无法吸收及降解,植入眼眶后无法完全融合,出现移位或感染风险。而可吸收板植入物具有较好降解能力,可以自动水解吸收,且对于组织刺激相对较小,对眼眶内容物影响较小,产生炎症等并发症风险较低[13]。影像学可能有助于评估持续性眼内狭窄,以指导可能的骨折修复翻修[6]。CT结果显示,可吸收植入网板材料修复的观察组患者术前CT图像呈现眶壁连续性中断,且骨折断端出现位移;而植入修复材料后,受损组织(嵌顿软组织)完全复位,吸收板在位,CT图像显影呈现高密度特征。MEDPOR修复的对照组患者植入材料相较于术前CT检查结果(清晰图像),其嵌顿软组织、肌肉均完全修复,CT图像显影呈现低密度特征。
综上所述,可吸收板植入物和MEDPOR外科种植体在眼眶骨折修复中的效果相当,但可吸收板植入物并发症更低,更有利于术后CT复诊显影;且可吸收板植入物吸收降解后产物对机体身体影响较小。
